
探讨不同剂量的右美托咪定(DEX)对妇科恶性肿瘤腹腔镜手术患者炎性因子和免疫功能的影响。
选取山西医科大学第二医院2021年1月至12月收治的60例妇科恶性肿瘤行腹腔镜手术患者为研究对象,采用随机数字表法将其分为对照组、小剂量DEX组(D1组)和大剂量DEX组(D2组)各20例。D1和D2组分别于麻醉诱导前静脉输注0.5、1.0 μg/kg DEX,10 min输注完成,并在麻醉维持期间分别泵注0.5、1.0 μg·kg-1·h-1 DEX,至手术结束前30 min停药;对照组泵注等量0.9% NaCl溶液。分别于麻醉诱导前10 min(T1)、解除气腹后1 h(T2)、解除气腹后24 h(T3)后抽取外周静脉血10 ml进行检测,比较3组患者白细胞介素(IL)-6、IL-10水平和CD4+细胞比例、CD8+细胞比例、CD4+/CD8+变化,记录围术期心动过缓和低血压发生情况及术后首次排气时间。
在T1、T2、T3时刻,对照组IL-6表达水平分别为(7.95±0.26)pg/ml、(8.30±0.24)pg/ml、(8.35±0.28)pg/ml,差异有统计学意义(F=14.14,P<0.001);IL-10表达水平分别为(38.9±2.6)pg/ml、(44.5±6.6)pg/ml、(46.3±4.6)pg/ml,差异有统计学意义(F=12.45,P<0.001);CD4+细胞比例分别为(38.5±2.1)%、(29.5±4.6)%、(29.6±3.5)%,差异有统计学意义(F=40.82,P<0.001);CD8+细胞比例分别为(30.1±3.7)%、(35.1±6.3)%、(40.3±8.2)%,差异有统计学意义(F=13.02,P<0.001);CD4+/CD8+分别为1.29±0.14、0.84±0.09、0.75±0.14,差异有统计学意义(F=99.94,P<0.001)。D1、D2组T2时IL-6表达水平分别为(8.10±0.32)pg/ml、(8.01± 0.30)pg/ml,T3时分别为(8.12±0.35)pg/ml、(8.05±0.34)pg/ml,较对照组均降低,差异均有统计学意义(均P<0.05)。T2时D2组IL-10表达水平为(40.6±3.5)pg/ml,较对照组下降,差异有统计学意义(P<0.05);T3时D1、D2组IL-10表达水平分别为(43.7±3.5)pg/ml、(42.4±3.9)pg/ml,较对照组均下降,差异均有统计学意义(均P<0.05)。T2时刻D2组CD4+细胞比例为(34.5±4.3)%,较对照组升高,差异有统计学意义(P<0.05);T3时D1、D2组CD4+细胞比例分别为(32.1±4.2)%、(33.7±2.8)%,较对照组均上升,差异均有统计学意义(均P<0.05)。T2时D2组CD8+细胞比例为(30.7±5.5)%,较对照组下降,差异有统计学意义(P<0.05);T3时D1、D2组CD8+细胞比例分别为(35.4±5.8)%、(32.5±5.1)%,较对照组均下降,差异均有统计学意义(均P<0.05)。D1、D2组T2时CD4+/CD8+分别为0.99±0.17、1.14±0.16,T3时分别为0.93±0.19、1.05±0.16,较对照组均上升,差异均有统计学意义(均P<0.05)。对照组和D1组发生低血压各1例,D2组出现心动过缓3例,低血压2例。对照组术后首次排气时间晚于D1组和D2组,差异有统计学意义(P<0.05)。
DEX可以抑制妇科恶性肿瘤患者腹腔镜手术的炎症反应,减轻患者的免疫损伤。高剂量DEX比低剂量DEX的抗炎作用和免疫保护作用明显,但高剂量DEX更易引起围术期患者血流动力学的波动。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
腹腔镜技术具有创伤小、出血少、术后恢复快等优点,已逐渐应用于妇科恶性肿瘤手术[1]。肠道作为人体最大的免疫器官[2],含有大量的淋巴组织和免疫细胞[3]。由于CO2吸收入血、手术刺激、体位改变等,使得肠道始终处于氧化应激状态,严重影响了机体的免疫功能;恶性肿瘤病变本身对机体的免疫功能有损伤[4]。右美托咪定(DEX)可通过减轻围术期的炎症反应,降低患者的免疫抑制[5],但是何种剂量的DEX对妇科恶性肿瘤患者腹腔镜手术免疫功能的保护作用更明显,目前的相关报道还很少。本研究探讨妇科恶性肿瘤患者腹腔镜术中采用不同剂量的DEX预处理后,对患者炎性因子和免疫功能、术后首次排气时间的影响,从而优化麻醉方案,指导临床应用。
纳入标准:患者年龄30~65岁,体质量指数(BMI)18~25 kg/m2,美国麻醉医师协会(ASA)分级Ⅱ~Ⅲ级。排除标准:(1)中转开腹或有药物过敏史;(2)严重心、肺、肝、肾疾病;(3)免疫系统疾病;(4)糖尿病;(5)高血压。选取2021年1月至12月山西医科大学第二医院收治的60例妇科恶性肿瘤患者,均在全身麻醉下行腹腔镜手术。采用随机数字表法将符合纳入、排除标准的患者分为3组,每组各20例。其中对照组包括子宫颈癌12例、子宫内膜癌6例、卵巢癌2例,小剂量DEX组(D1组)包括子宫颈癌14例、子宫内膜癌4例、卵巢癌2例,大剂量DEX组(D2组)包括子宫颈癌10例、子宫内膜癌7例、卵巢癌3例。本研究经山西医科大学第二医院医学伦理委员会批准[批准文号:(2021)YX(061)],并与患者或其家属签署知情同意书。
所有患者术前常规禁饮食8 h,入室后开放外周静脉通路,输注乳酸钠林格液(上海百特医疗用品有限公司,500 ml),监测心率、心电图、有创动脉压(MAP)、血氧饱和度(SpO2)、脑电双频指数(BIS),面罩吸氧。手术均在气管插管全身麻醉下进行。若心率低于50次/min,静脉滴注阿托品0.5 mg,维持术中平均动脉压波动不超过术前平均动脉压的±20%;若收缩压低于90 mmHg(1 mmHg=0.133 kPa),加快液体输注速度并使用麻黄碱10 mg静脉滴注。D1组和D2组:麻醉诱导前分别静脉给予0.5、1.0 μg/kg DEX,10 min输注完成,然后分别按0.5、1.0 μg·kg-1·h-1 DEX恒速泵注,至手术结束前30 min停药;对照组:泵注等量0.9% NaCl溶液。3组均常规麻醉诱导和维持:诱导使用咪达唑仑(宜昌人福药业有限责任公司,2 ml∶2 mg)0.03 mg/kg、舒芬太尼(宜昌人福药业有限责任公司,1 ml∶50 μg)0.5 μg/kg、依托咪酯(江苏恩华药业有限公司,10 ml∶20 mg)0.3 mg/kg、罗库溴铵(浙江仙琚股份有限公司,5 ml∶50 mg)0.6 mg/kg,肌松完全后人工辅助通气3 min,行气管插管;麻醉维持采用丙泊酚(德国Corden Pharma公司,50 ml∶500 mg)、瑞芬太尼(宜昌人福药业有限责任公司,1 mg)、罗库溴铵,麻醉深度监测指标BIS维持在45~60,呼气末CO2分压(PETCO2)维持在35~45 mmHg。
(1)炎性因子白细胞介素(IL)-6、IL-10水平和免疫指标CD4+细胞比例、CD8+细胞比例、CD4+/CD8+的变化:3组均在麻醉诱导前10 min(T1)、解除气腹后1 h(T2)、解除气腹后24 h(T3)后抽取外周静脉血10 ml,平均分成2份,一份离心后采用酶联免疫吸附试验(ELISA)检测静脉血中IL-6、IL-10水平,另外一份采用流式细胞术测定CD4+、CD8+细胞比例,并计算CD4+/CD8+。(2)记录两组患者术后首次排气时间。
采用SPSS 25.0软件进行统计学分析。计量资料符合正态分布,以 ±s表示,多组数据比较采用方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
±s表示,多组数据比较采用方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
3组患者年龄、BMI、手术时间、气腹时间、麻醉时间比较,差异均无统计学意义(均P>0.05)(表1)。
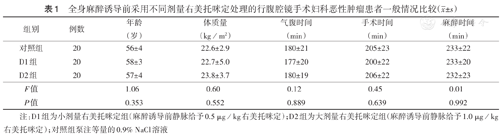
全身麻醉诱导前采用不同剂量右美托咪定处理的行腹腔镜手术妇科恶性肿瘤患者一般情况比较( ±s)
±s)
全身麻醉诱导前采用不同剂量右美托咪定处理的行腹腔镜手术妇科恶性肿瘤患者一般情况比较( ±s)
±s)
| 组别 | 例数 | 年龄(岁) | 体质量(kg/m2) | 气腹时间(min) | 手术时间(min) | 麻醉时间(min) |
|---|---|---|---|---|---|---|
| 对照组 | 20 | 56±4 | 22.6±2.9 | 180±21 | 205±23 | 233±22 |
| D1组 | 20 | 58±3 | 22.7±5.0 | 177±20 | 200±22 | 233±20 |
| D2组 | 20 | 57±4 | 23.8±3.7 | 180±19 | 206±22 | 232±23 |
| F值 | 1.06 | 0.60 | 0.12 | 0.45 | 0.01 | |
| P值 | 0.353 | 0.552 | 0.889 | 0.639 | 0.992 |
注:D1组为小剂量右美托咪定组(麻醉诱导前静脉给予0.5 μg/kg右美托咪定);D2组为大剂量右美托咪定组(麻醉诱导前静脉给予1.0 μg/kg右美托咪定);对照组泵注等量的0.9% NaCl溶液
与T1时相比,对照组T2、T3时IL-6表达水平均升高,差异均有统计学意义(均P<0.05);T2、T3时,与对照组相比,D1、D2组IL-6表达水平均下降,差异均有统计学意义(均P<0.05)(表2)。
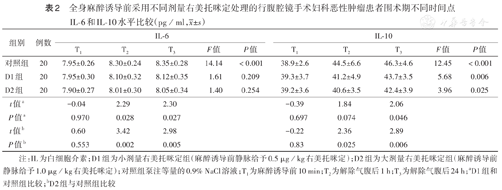
全身麻醉诱导前采用不同剂量右美托咪定处理的行腹腔镜手术妇科恶性肿瘤患者围术期不同时间点IL-6和IL-10水平比较(pg/ml, ±s)
±s)
全身麻醉诱导前采用不同剂量右美托咪定处理的行腹腔镜手术妇科恶性肿瘤患者围术期不同时间点IL-6和IL-10水平比较(pg/ml, ±s)
±s)
| 组别 | 例数 | IL-6 | IL-10 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| T1 | T2 | T3 | F值 | P值 | T1 | T2 | T3 | F值 | P值 | ||
| 对照组 | 20 | 7.95±0.26 | 8.30±0.24 | 8.35±0.28 | 14.14 | <0.001 | 38.9±2.6 | 44.5±6.6 | 46.3±4.6 | 12.45 | <0.001 |
| D1组 | 20 | 7.95±0.30 | 8.10±0.32 | 8.12±0.35 | 1.61 | 0.209 | 39.3±3.7 | 41.2±4.9 | 43.7±3.5 | 5.68 | 0.006 |
| D2组 | 20 | 7.90±0.27 | 8.01±0.30 | 8.05±0.34 | 1.40 | 0.254 | 39.2±3.6 | 40.6±3.5 | 42.4±3.9 | 3.96 | 0.025 |
| t值a | -0.04 | 2.29 | 2.30 | -0.39 | 1.84 | 2.06 | |||||
| P值a | 0.970 | 0.028 | 0.027 | 0.697 | 0.074 | 0.046 | |||||
| t值b | 0.60 | 3.42 | 2.98 | -0.22 | 2.36 | 2.89 | |||||
| P值b | 0.553 | 0.002 | 0.005 | 0.83 | 0.025 | 0.006 | |||||
注:IL为白细胞介素;D1组为小剂量右美托咪定组(麻醉诱导前静脉给予0.5 μg/kg右美托咪定);D2组为大剂量右美托咪定组(麻醉诱导前静脉给予1.0 μg/kg右美托咪定);对照组泵注等量的0.9% NaCl溶液;T1为麻醉诱导前10 min;T2为解除气腹后1 h;T3为解除气腹后24 h;aD1组和对照组比较;bD2组与对照组比较
与T1时相比,对照组T2、T3时IL-10表达水平均升高,差异均有统计学意义(均P<0.05);T2时,与对照组相比,D1组IL-10表达水平差异无统计学意义(P>0.05),D2组IL-10表达水平下降,差异具有统计学意义(P<0.05);T3时,与对照组相比,D1、D2组IL-10表达水平均下降,差异均有统计学意义(P<0.05)(表2)。
与T1时相比,对照组T2、T3时CD4+细胞比例下降,差异均有统计学意义(均P<0.05);T2时,与对照组相比,D1组CD4+细胞比例差异无统计学意义(P>0.05),D2组CD4+细胞比例升高,差异具有统计学意义(P<0.05);T3时,与对照组相比,D1、D2组CD4+细胞比例均升高,差异均有统计学意义(均P<0.05)(表3)。
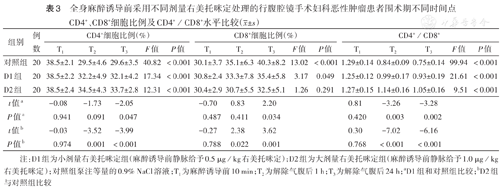
全身麻醉诱导前采用不同剂量右美托咪定处理的行腹腔镜手术妇科恶性肿瘤患者围术期不同时间点CD4+、CD8+细胞比例及CD4+/CD8+水平比较( ±s)
±s)
全身麻醉诱导前采用不同剂量右美托咪定处理的行腹腔镜手术妇科恶性肿瘤患者围术期不同时间点CD4+、CD8+细胞比例及CD4+/CD8+水平比较( ±s)
±s)
| 组别 | 例数 | CD4+细胞比例(%) | CD8+细胞比例(%) | CD4+/CD8+ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T1 | T2 | T3 | F值 | P值 | T1 | T2 | T3 | F值 | P值 | T1 | T2 | T3 | F值 | P值 | ||
| 对照组 | 20 | 38.5±2.1 | 29.5±4.6 | 29.6±3.5 | 40.82 | <0.001 | 30.1±3.7 | 35.1±6.3 | 40.3±8.2 | 13.02 | <0.001 | 1.29±0.14 | 0.84±0.09 | 0.75±0.14 | 99.94 | <0.001 |
| D1组 | 20 | 38.5±2.2 | 32.2±4.9 | 32.1±4.2 | 17.34 | <0.001 | 30.8±2.4 | 33.3±7.8 | 35.4±5.8 | 3.17 | 0.049 | 1.25±0.12 | 0.99±0.17 | 0.93±0.19 | 21.61 | <0.001 |
| D2组 | 20 | 38.5±2.4 | 34.5±4.3 | 33.7±2.8 | 12.31 | <0.001 | 30.4±2.9 | 30.7±5.5 | 32.5±5.1 | 1.26 | 0.291 | 1.27±0.15 | 1.14±0.16 | 1.05±0.16 | 9.51 | <0.001 |
| t值a | -0.08 | -1.73 | -2.05 | -0.70 | 0.83 | 2.20 | 0.81 | -3.26 | -3.28 | |||||||
| P值a | 0.941 | 0.091 | 0.047 | 0.487 | 0.411 | 0.034 | 0.420 | 0.003 | 0.002 | |||||||
| t值b | -0.03 | -3.52 | -3.99 | -0.27 | 2.38 | 3.62 | 0.30 | -7.02 | -6.16 | |||||||
| P值b | 0.974 | 0.001 | <0.001 | 0.788 | 0.022 | 0.001 | 0.768 | <0.001 | <0.001 | |||||||
注:D1组为小剂量右美托咪定组(麻醉诱导前静脉给予0.5 μg/kg右美托咪定);D2组为大剂量右美托咪定组(麻醉诱导前静脉给予1.0 μg/kg右美托咪定);对照组泵注等量的0.9% NaCl溶液;T1为麻醉诱导前10 min;T2为解除气腹后1 h;T3为解除气腹后24 h;aD1组和对照组比较;bD2组与对照组比较
与T1时相比,对照组T2、T3时刻CD8+细胞比例均升高,差异均有统计学意义(均P<0.05);T2时,与对照组相比,D1组CD8+细胞比例差异无统计学意义(P>0.05),D2组CD8+细胞比例下降,差异有统计学意义(P<0.05);T3时,与对照组相比,D1、D2组CD8+细胞比例均下降,差异均有统计学意义(均P<0.05)(表3)。
与T1时相比,对照组T2、T3时刻CD4+/CD8+均下降,差异均有统计学意义(均P<0.05);T2、T3时,与对照组相比,D1、D2组CD4+/CD8+均升高,差异均有统计学意义(均P<0.05)(表3)。
对照组和D1组未出现心动过缓患者,对照组和D1组各出现低血压1例,均用麻黄碱干预。D2组出现心动过缓3例,均使用阿托品干预;出现低血压2例,均使用麻黄碱干预。
对照组、D1组和D2组术后首次排气时间分别为(25.1±4.0)h、(18.6±4.4)h、(18.1±2.9)h,3组间差异有统计学意义(F=20.57,P<0.05),对照组排气时间均晚于D1组和D2组,差异均有统计学意义(均P<0.05)。
麻醉、手术创伤可引起机体释放大量的炎性介质,其中IL-6在炎症反应中起重要作用,与多种肿瘤发生、发展密切相关[6];IL-10也参与机体的免疫抑制。Carelli等[7]提出DEX可以抑制炎性因子的释放,从而降低机体的炎性因子水平。王丽等[8]研究表明,不同剂量的DEX均可减轻老年腹腔镜手术患者的炎症反应,且中高剂量的DEX作用更显著。本研究发现,低、高剂量DEX均能降低妇科恶性肿瘤腹腔镜手术患者炎性因子释放,而高剂量DEX作用较明显,与上述结果一致。Yang等[9]发现DEX不仅具有抗炎作用,还能降低机体的免疫抑制,改善患者的免疫功能。
机体免疫功能的下降可增加术后肿瘤的播散,不利于患者的康复[10,11]。CD4+细胞与CD8+细胞平衡的打破,是导致免疫功能降低的重要原因[12]。张静贻[13]认为DEX可通过抗炎作用来减轻肿瘤手术患者免疫功能的抑制。本研究结果表明低、高剂量的DEX均可以改善妇科恶性肿瘤腹腔镜手术患者的免疫功能,但高剂量DEX的作用更明显。
DEX作为高选择性的α2肾上腺素能受体激动剂,具有镇痛、镇静、抑制交感神经等作用,DEX还可保护肠屏障功能,并促进胃肠蠕动[14]。本研究发现,DEX组术后排气时间显著缩短,说明DEX对肠屏障功能起到保护作用,减轻了机体围术期免疫功能的损伤,利于患者术后的康复。此外,DEX对血流动力学的影响和剂量密切相关,长时间、大剂量泵入可出现低血压或心动过缓等不良反应[15]。本研究通过对3组患者术中血压、心率的观察,发现高剂量DEX更易引起患者围术期血流动力学的波动。
综上所述,低、高剂量DEX均可以抑制妇科恶性肿瘤患者腹腔镜手术的炎症反应,减轻患者的免疫损伤,且都可以促进肠屏障功能的恢复,而高剂量DEX的效果更明显,但是由于高剂量DEX更能引起患者围术期血压和心率的下降,建议老年人和心动过缓的患者在麻醉期间适当降低DEX的使用剂量或及时进行人为干预,以维持围术期血流动力学的稳定。
所有作者均声明不存在利益冲突



























