
探讨血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)的变化对乳腺癌新辅助治疗效果的预测价值。
回顾性分析2020年2月至2022年1月在南通市肿瘤医院接受新辅助治疗的72例Ⅲ期浸润性乳腺癌患者的临床资料,分析新辅助治疗前后PLR、NLR的变化。采用受试者工作特征(ROC)曲线评估PLR、NLR及其变化对新辅助治疗后达到病理完全缓解(pCR)的预测价值。
治疗前PLR、治疗前NLR、治疗前后PLR的差值(ΔPLR)、治疗前后NLR的差值(ΔNLR)预测pCR的ROC曲线下面积分别为0.520、0.505、0.724及0.686,截断值分别为269.231、2.559、-2.840及-1.457,根据截断值分组。治疗前NLR与患者临床病理特征均无相关性(均P>0.05),治疗前PLR与肿瘤长径相关(P=0.029),ΔPLR与孕激素受体表达(P=0.025)、人表皮生长因子受体2表达(P<0.001)、分子分型(P<0.001)、N分期(P=0.002)、临床分期(P=0.002)及治疗方案(P<0.001)均相关,ΔNLR与人表皮生长因子受体2表达(P=0.002)、分子分型(P=0.024)、肿瘤长径(P=0.007)、神经侵犯(P=0.006)、N分期(P=0.006)、临床分期(P=0.016)及治疗方案(P=0.014)均相关。ΔPLR、ΔNLR是患者新辅助治疗后达pCR的影响因素(均P<0.05)。
Ⅲ期浸润性乳腺癌患者新辅助治疗后ΔPLR和ΔNLR较高者预后较好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乳腺癌是全球女性最常见的恶性肿瘤,病死率居女性肿瘤之首[1]。近年来,乳腺癌发病趋于年轻化,且发病率呈逐年上升趋势[2]。乳腺癌的治疗包括手术、放化疗、靶向治疗、内分泌治疗、免疫治疗等。对于局部晚期乳腺癌,在手术前进行新辅助治疗可有效降期从而获得更好的预后。近来研究发现,炎性细胞是构成肿瘤微环境的重要部分,一些炎性细胞的改变与肿瘤细胞的增殖、侵袭及迁移密切相关[3]。血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)作为全身炎性反应的监测指标,可动态监测乳腺癌患者体内炎症状态,且经济方便。本研究分析乳腺癌新辅助化疗患者PLR、NLR的动态变化对疗效的预测价值。
回顾性分析2020年2月至2022年1月南通市肿瘤医院Ⅲ期浸润性乳腺癌患者的临床病理资料。纳入标准:女性,经空芯针活组织检查术病理明确诊断为浸润性乳腺癌;Karnofsky评分≥80分;入院前未行抗肿瘤治疗;需经新辅助治疗后行手术治疗;住院病历资料完整;血常规均在正常范围内。排除标准:影像学诊断有远处转移无法行手术切除;伴随严重高血压、糖尿病、血液系统疾病、肺部疾病、肝脏疾病、心脏疾病、终末期肾病、感染性疾病及自身免疫性疾病;入院前曾接受抗肿瘤治疗;治疗过程中断;服用任何抗血小板药物。共纳入72例患者,中位年龄为53.5岁(21~74岁),均伴有腋窝淋巴结转移并进行新辅助治疗,TNM分期依据第8版美国癌症联合委员会(AJCC)标准。本研究经南通市肿瘤医院伦理委员会批准,患者均签署知情同意书。
采集患者晨起空腹外周静脉血2~5 ml,采样时间为首次化疗前及手术前。采用血液分析仪记录中性粒细胞、淋巴细胞及血小板数值。ΔPLR、ΔNLR分别为治疗前后PLR、NLR的差值。
采用SPSS 23.0软件进行统计学分析,临床病理特征与病理完全缓解(pCR)及治疗前PLR、治疗前NLR、ΔPLR、ΔNLR的关系用Pearson χ2检验(T≥5)、耶茨校正χ2检验(1≤T<5)、Fisher确切概率法(T=0)进行分析;通过计算受试者工作特征(ROC)曲线下面积(AUC)评估治疗前NLR、治疗前PLR、ΔPLR、ΔNLR对pCR的预测价值,明确相关变量的截断值;应用单变量logistic回归分析pCR与治疗前NLR、治疗前PLR、ΔPLR、ΔNLR的相关性。所有检验均为双侧,以P<0.05为差异有统计学意义。多重统计检验无校正。
72例患者临床资料见表1。18例患者在新辅助治疗后获得pCR,患者pCR与雌激素受体(ER)表达、孕激素受体(PR)表达、HER2表达、分子分型、肿瘤长径、血管侵犯、神经侵犯、N分期、临床分期和治疗方案均相关(均P<0.05)(表1)。
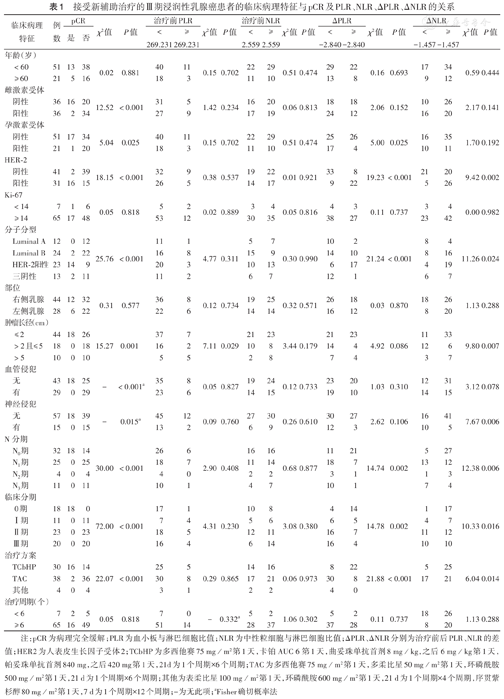
接受新辅助治疗的Ⅲ期浸润性乳腺癌患者的临床病理特征与pCR及PLR、NLR、ΔPLR、ΔNLR的关系
接受新辅助治疗的Ⅲ期浸润性乳腺癌患者的临床病理特征与pCR及PLR、NLR、ΔPLR、ΔNLR的关系
| 临床病理特征 | 例数 | pCR | χ2值 | P值 | 治疗前PLR | χ2值 | P值 | 治疗前NLR | χ2值 | P值 | ΔPLR | χ2值 | P值 | ΔNLR | χ2值 | P值 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 是 | 否 | <269.231 | ≥269.231 | <2.559 | ≥2.559 | <-2.840 | ≥-2.840 | <-1.457 | ≥-1.457 | |||||||||||||
| 年龄(岁) | ||||||||||||||||||||||
| <60 | 51 | 13 | 38 | 0.02 | 0.881 | 40 | 11 | 0.15 | 0.702 | 22 | 29 | 0.51 | 0.474 | 29 | 22 | 0.16 | 0.693 | 17 | 34 | 0.59 | 0.444 | |
| ≥60 | 21 | 5 | 16 | 18 | 3 | 11 | 10 | 13 | 8 | 9 | 12 | |||||||||||
| 雌激素受体 | ||||||||||||||||||||||
| 阴性 | 36 | 16 | 20 | 12.52 | <0.001 | 31 | 5 | 1.42 | 0.234 | 16 | 20 | 0.06 | 0.813 | 18 | 18 | 2.06 | 0.152 | 10 | 26 | 2.17 | 0.141 | |
| 阳性 | 36 | 2 | 34 | 27 | 9 | 17 | 19 | 24 | 12 | 16 | 20 | |||||||||||
| 孕激素受体 | ||||||||||||||||||||||
| 阴性 | 51 | 17 | 34 | 5.04 | 0.025 | 40 | 11 | 0.15 | 0.702 | 22 | 29 | 0.51 | 0.474 | 25 | 26 | 5.00 | 0.025 | 16 | 35 | 1.70 | 0.192 | |
| 阳性 | 21 | 1 | 20 | 18 | 3 | 11 | 10 | 17 | 4 | 10 | 11 | |||||||||||
| HER-2 | ||||||||||||||||||||||
| 阴性 | 41 | 2 | 39 | 18.15 | <0.001 | 32 | 9 | 0.38 | 0.537 | 19 | 22 | 0.01 | 0.921 | 33 | 8 | 19.23 | <0.001 | 21 | 20 | 9.42 | 0.002 | |
| 阳性 | 31 | 16 | 15 | 26 | 5 | 14 | 17 | 9 | 22 | 5 | 26 | |||||||||||
| Ki-67 | ||||||||||||||||||||||
| <14 | 7 | 1 | 6 | 0.05 | 0.818 | 5 | 2 | 0.02 | 0.889 | 3 | 4 | 0.05 | 0.816 | 4 | 3 | 0.11 | 0.737 | 3 | 4 | 0.00 | 0.982 | |
| ≥14 | 65 | 17 | 48 | 53 | 12 | 30 | 35 | 38 | 27 | 23 | 42 | |||||||||||
| 分子分型 | ||||||||||||||||||||||
| Luminal A | 12 | 0 | 12 | 25.76 | <0.001 | 11 | 1 | 4.77 | 0.311 | 5 | 7 | 0.30 | 0.990 | 10 | 2 | 21.24 | <0.001 | 8 | 4 | 11.26 | 0.024 | |
| Luminal B | 24 | 2 | 22 | 16 | 8 | 15 | 9 | 14 | 10 | 8 | 16 | |||||||||||
| HER-2阳性 | 23 | 14 | 9 | 20 | 3 | 10 | 13 | 6 | 17 | 4 | 19 | |||||||||||
| 三阴性 | 13 | 2 | 11 | 11 | 2 | 6 | 7 | 12 | 1 | 6 | 7 | |||||||||||
| 部位 | ||||||||||||||||||||||
| 右侧乳腺 | 44 | 12 | 32 | 0.31 | 0.577 | 36 | 8 | 0.12 | 0.734 | 19 | 25 | 0.32 | 0.571 | 26 | 18 | 0.03 | 0.870 | 18 | 26 | 1.13 | 0.288 | |
| 左侧乳腺 | 28 | 6 | 22 | 22 | 6 | 14 | 14 | 16 | 12 | 8 | 20 | |||||||||||
| 肿瘤长径(cm) | ||||||||||||||||||||||
| ≤2 | 44 | 18 | 26 | 15.27 | 0.001 | 37 | 7 | 7.11 | 0.029 | 21 | 23 | 3.44 | 0.179 | 21 | 23 | 4.92 | 0.086 | 11 | 33 | 9.80 | 0.007 | |
| >2且≤5 | 18 | 0 | 18 | 16 | 2 | 10 | 8 | 14 | 4 | 12 | 6 | |||||||||||
| >5 | 10 | 0 | 10 | 5 | 5 | 2 | 8 | 7 | 4 | 3 | 7 | |||||||||||
| 血管侵犯 | ||||||||||||||||||||||
| 无 | 43 | 18 | 25 | - | <0.001a | 35 | 8 | 0.05 | 0.827 | 19 | 24 | 0.12 | 0.733 | 23 | 20 | 1.03 | 0.310 | 12 | 31 | 3.12 | 0.078 | |
| 有 | 29 | 0 | 29 | 23 | 6 | 14 | 15 | 19 | 10 | 14 | 15 | |||||||||||
| 神经侵犯 | ||||||||||||||||||||||
| 无 | 57 | 18 | 39 | - | 0.015a | 45 | 12 | 0.09 | 0.760 | 27 | 30 | 0.26 | 0.610 | 30 | 27 | 2.62 | 0.106 | 16 | 41 | 7.67 | 0.006 | |
| 有 | 15 | 0 | 15 | 13 | 2 | 6 | 9 | 12 | 3 | 10 | 5 | |||||||||||
| N分期 | ||||||||||||||||||||||
| N0期 | 32 | 18 | 14 | 30.00 | <0.001 | 26 | 6 | 2.90 | 0.408 | 16 | 16 | 0.68 | 0.877 | 11 | 21 | 14.74 | 0.002 | 5 | 27 | 12.38 | 0.006 | |
| N1期 | 25 | 0 | 25 | 18 | 7 | 11 | 14 | 18 | 7 | 13 | 12 | |||||||||||
| N2期 | 4 | 0 | 4 | 4 | 0 | 2 | 2 | 3 | 1 | 1 | 3 | |||||||||||
| N3期 | 11 | 0 | 11 | 10 | 1 | 4 | 7 | 10 | 1 | 7 | 4 | |||||||||||
| 临床分期 | ||||||||||||||||||||||
| 0期 | 18 | 18 | 0 | 72.00 | <0.001 | 17 | 1 | 4.31 | 0.230 | 10 | 8 | 3.08 | 0.380 | 4 | 14 | 14.78 | 0.002 | 1 | 17 | 10.33 | 0.016 | |
| Ⅰ期 | 11 | 0 | 11 | 7 | 4 | 5 | 6 | 6 | 5 | 4 | 7 | |||||||||||
| Ⅱ期 | 23 | 0 | 23 | 18 | 5 | 12 | 11 | 16 | 7 | 11 | 12 | |||||||||||
| Ⅲ期 | 20 | 0 | 20 | 16 | 4 | 6 | 14 | 16 | 4 | 10 | 10 | |||||||||||
| 治疗方案 | ||||||||||||||||||||||
| TCbHP | 30 | 16 | 14 | 22.07 | <0.001 | 25 | 5 | 0.29 | 0.865 | 14 | 16 | 0.06 | 0.973 | 8 | 22 | 21.88 | <0.001 | 5 | 25 | 6.04 | 0.014 | |
| TAC | 38 | 2 | 36 | 30 | 8 | 17 | 21 | 30 | 8 | 17 | 21 | |||||||||||
| 其他 | 4 | 0 | 4 | 3 | 1 | 2 | 2 | 4 | 0 | |||||||||||||
| 治疗周期(个) | ||||||||||||||||||||||
| <6 | 7 | 2 | 5 | 0.05 | 0.818 | 7 | 0 | - | 0.332a | 5 | 2 | 1.06 | 0.302 | 5 | 2 | 0.11 | 0.737 | 18 | 26 | 1.13 | 0.288 | |
| ≥6 | 65 | 16 | 49 | 51 | 14 | 28 | 37 | 37 | 28 | 8 | 20 | |||||||||||
注:pCR为病理完全缓解;PLR为血小板与淋巴细胞比值;NLR为中性粒细胞与淋巴细胞比值;ΔPLR、ΔNLR分别为治疗前后PLR、NLR的差值;HER2为人表皮生长因子受体2;TCbHP为多西他赛75 mg/m2第1天,卡铂AUC 6第1天,曲妥珠单抗首剂8 mg/kg,之后6 mg/kg第1天,帕妥珠单抗首剂840 mg,之后420 mg第1天,21d为1个周期×6个周期;TAC为多西他赛75 mg/m2第1天,多柔比星50 mg/m2第1天,环磷酰胺500 mg/m2第1天,21 d为1个周期×6个周期;其他为表柔比星100 mg/m2第1天,环磷酰胺600 mg/m2第1天,21 d为1个周期×4个周期,序贯紫杉醇80 mg/m2第1天,7 d为1个周期×12个周期;-为无此项;aFisher确切概率法
治疗前PLR、治疗前NLR、ΔPLR、ΔNLR预测pCR的AUC分别为0.520、0.505、0.724及0.686,截断值分别为269.231、2.559、-2.840及-1.457。根据截断值分组。治疗前NLR与患者临床病理特征均无相关性(均P>0.05),治疗前PLR与肿瘤长径相关(P=0.029),ΔPLR与PR表达、HER2表达、分子分型、N分期、临床分期及治疗方案均相关(均P<0.05),ΔNLR与HER2表达、分子分型、肿瘤长径、神经侵犯、N分期、临床分期及治疗方案均相关(均P<0.05)(表1)。
ΔPLR、ΔNLR与患者新辅助治疗后达pCR相关(均P<0.05)(表2)。logistic回归分析显示,ΔPLR、ΔNLR是患者治疗后pCR的影响因素(表3)。
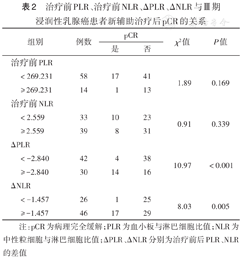
治疗前PLR、治疗前NLR、ΔPLR、ΔNLR与Ⅲ期浸润性乳腺癌患者新辅助治疗后pCR的关系
治疗前PLR、治疗前NLR、ΔPLR、ΔNLR与Ⅲ期浸润性乳腺癌患者新辅助治疗后pCR的关系
| 组别 | 例数 | pCR | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| 是 | 否 | |||||
| 治疗前PLR | ||||||
| <269.231 | 58 | 17 | 41 | 1.89 | 0.169 | |
| ≥269.231 | 14 | 1 | 13 | |||
| 治疗前NLR | ||||||
| <2.559 | 33 | 10 | 23 | 0.91 | 0.339 | |
| ≥2.559 | 39 | 8 | 31 | |||
| ΔPLR | ||||||
| <-2.840 | 42 | 4 | 38 | 10.97 | <0.001 | |
| ≥-2.840 | 30 | 14 | 16 | |||
| ΔNLR | ||||||
| <-1.457 | 26 | 1 | 25 | 8.03 | 0.005 | |
| ≥-1.457 | 46 | 17 | 29 | |||
注:pCR为病理完全缓解;PLR为血小板与淋巴细胞比值;NLR为中性粒细胞与淋巴细胞比值;ΔPLR、ΔNLR分别为治疗前后PLR、NLR的差值
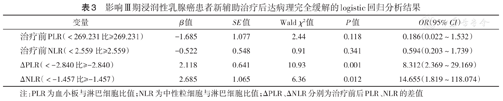
影响Ⅲ期浸润性乳腺癌患者新辅助治疗后达病理完全缓解的logistic回归分析结果
影响Ⅲ期浸润性乳腺癌患者新辅助治疗后达病理完全缓解的logistic回归分析结果
| 变量 | β值 | SE值 | Wald χ2值 | P值 | OR(95% CI) |
|---|---|---|---|---|---|
| 治疗前PLR(<269.231比≥269.231) | -1.685 | 1.077 | 2.44 | 0.118 | 0.186(0.022~1.532) |
| 治疗前NLR(<2.559比≥2.559) | -0.522 | 0.548 | 0.91 | 0.341 | 0.594(0.203~1.739) |
| ΔPLR(<-2.840比≥-2.840) | 2.118 | 0.641 | 10.93 | 0.001 | 8.312(2.369~29.169) |
| ΔNLR(<-1.457比≥-1.457) | 2.685 | 1.065 | 6.36 | 0.012 | 14.655(1.819~118.074) |
注:PLR为血小板与淋巴细胞比值;NLR为中性粒细胞与淋巴细胞比值;ΔPLR、ΔNLR分别为治疗前后PLR、NLR的差值
近年来多项研究发现,炎症与肿瘤的发生发展、血管生成及远处转移密切相关[3,4,5]。外周血中的中性粒细胞、血小板与淋巴细胞的比值可在一定程度上反映患者炎性反应状态。NLR能综合反映外周血中性粒细胞与淋巴细胞之间的动态变化水平。既往研究表明,高基线NLR在肺癌、肝癌、食管癌、胃癌、结直肠癌及乳腺癌中均为独立预后危险因素,高基线NLR与较差的预后显著相关[6,7,8,9,10,11]。PLR也是一种全身炎性反应检测指标,可反映外周血小板与淋巴细胞之间的动态变化水平。研究发现高基线PLR与食管癌、肺癌、结直肠癌、乳腺癌等较差的预后相关[10,11,12,13]。因此,应用中性粒细胞、血小板及淋巴细胞等血液炎症指标可反映机体免疫炎症状态及肿瘤发展预后。
本研究发现治疗前PLR、NLR预测新辅助治疗效果的AUC分别为0.520、0.505,预测价值不高,且与pCR无相关性;而ΔPLR、ΔNLR与患者新辅助治疗后的pCR相关,且AUC分别为0.724及0.686,准确性较高。logistic分析表明,高ΔPLR较低ΔPLR增加了7.312倍的pCR率,高ΔNLR较低ΔNLR增加了13.655倍的pCR率。另一方面,本研究发现HER2阳性比HER2阴性患者的pCR率更高,表明HER2阳性患者对新辅助治疗的反应更好。本研究纳入的所有HER2阳性患者均使用了抗HER2治疗的TCbHP方案,而对于HER2阴性的Luminal B型和三阴性型患者,大部分使用了TAC方案,尽管分子分型不一样,但既往研究结果也显示,三阴性型和Luminal型均对化疗敏感性欠佳,我们的结果也显示,使用TAC方案的38例中仅有2例达到pCR,远低于使用TCbHP方案的HER2阳性患者(16/30),所以我们认为使用TAC方案的患者,对化疗的反应率都低于使用TCbHP方案的HER2阳性患者。因为HER2阳性乳腺癌患者有疗效较好的抗HER2靶向药,所以对于新辅助治疗的疗效优于HER2阴性患者。
肿瘤微环境中的炎症标志物包括中性粒细胞、血小板、淋巴细胞、单核细胞等。中性粒细胞可分泌多种炎性介质包括白细胞介素、血管内皮因子等,促进肿瘤进展[14]。血小板可分泌血小板驱化生长因子等刺激肿瘤分化,其分泌释放的血管生成调节因子不仅可以促进肿瘤血管生成,还可以稳定肿瘤血管,辅助形成癌栓,阻止自然杀伤细胞溶解肿瘤细胞[15,16]。淋巴细胞是机体免疫微环境的重要组成部分,尤其是肿瘤浸润淋巴细胞(TIL),它是CD8+和CD4+细胞的混合物,可以对肿瘤细胞产生高特异性免疫应答[17,18]。TIL可通过参与机体的细胞与体液免疫来抑制肿瘤的发生、发展,通过诱导癌细胞凋亡抑制癌细胞增殖。因此,淋巴细胞在抗肿瘤免疫反应和肿瘤免疫监测中起着关键作用[19,20]。因PLR、NLR所包括的淋巴细胞、中性粒细胞、血小板与患者的全身炎症情况密切相关,而肿瘤治疗效果与肿瘤组织周围炎症细胞浸润也密切相关,化疗一方面可以直接杀伤肿瘤细胞,另一方面可导致患者淋巴细胞、中性粒细胞及血小板的改变,化疗前后PLR及NLR等炎症指标的变化情况可能与患者免疫系统的敏感性及储备能力相关,在手术前监测相关指标可以预测新辅助治疗效果。本研究发现,高ΔPLR、高ΔNLR患者在新辅助治疗后更易获得pCR。本研究还发现新辅助化疗可降低PLR及NLR的基线,即预防炎症反应、抗凝治疗、提高患者免疫细胞功能可以提高乳腺癌新辅助治疗效果。
综上所述,通过动态监测患者治疗中PLR、NLR的变化趋势,能为预测乳腺癌患者疗效和预后提供参考,对临床治疗策略的选择及预后模型的建立有一定指导意义。但本研究为回顾性分析,且随访时间短、入组病例偏少,结果可能存在一定偏倚,未来需要更多前瞻性、多中心、随机对照研究进一步验证。
所有作者均声明不存在利益冲突































