
提高对男性乳腺癌(MBC)的认识。
回顾性分析2021年1月青岛市市立医院收治的1例有乳腺癌家族史的双侧异时性MBC诊断及治疗过程,并复习相关文献。
患者65岁,行单侧乳腺癌改良根治术+腋窝淋巴结清扫术,术中病理检查结果为三阴性浸润性导管癌。术后采用环磷酰胺+多西他赛方案化疗,因患者无法耐受消化道不良反应,放弃治疗。
对于MBC的治疗仍以女性乳腺癌治疗方案为基础;对有家族史或已罹患乳腺癌的MBC进行跟踪随访对于MBC的规范化治疗标准的建立具有重要意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
男性乳腺癌(MBC)在北美和欧洲的发病率较亚洲高,其发病率明显低于女性乳腺癌(FBC),且男性双侧乳腺癌更为少见。现报道1例家族性双侧异时性MBC,并复习相关文献。
患者,男性,65岁,因右侧乳腺癌术后13年,左侧乳腺肿物10 d于2021年1月入我院。入院前当地医院行超声检查示:左侧乳腺体内低回声影,未行特殊治疗。患者高血压病史30年,血压最高200 mmHg/95 mmHg(1 mmHg=0.133 kPa),冠心病史1年,平时规律服用药物,日常控制尚可。糖尿病史3年,未行规律治疗。骨关节炎病史8年,未行特殊治疗。患者有乳腺癌家族史。查体:右乳缺如,有陈旧性手术瘢痕;左侧乳头未见脱屑,无内陷,无溢液;左侧乳房外上象限可扪及一肿物,距离乳头3 cm,大小约2 cm×2 cm,质硬,边界不清,活动度差,伴压痛;双侧腋下及锁骨上未扪及肿大淋巴结。超声检查见:右侧乳腺术后右侧胸壁未见明显占位性病变;左侧乳腺1点方向紧邻乳头旁可见低回声结节,大小0.9 cm×0.9 cm×1.0 cm,边界尚清,形态不规则,内回声不均匀,彩色多普勒血流成像(CDFI)检查示条状血流信号(图1)。超声提示:左侧乳腺实性结节BI-RADS 4A类。各项肿瘤标志物水平正常。患者行全身骨显像检查示:双膝关节代谢增高,考虑关节炎;无其他异常。
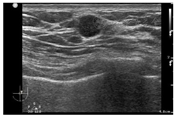

既往史:患者13年前因发现右侧乳腺肿物1个月入院。查体:双侧乳头对称,右侧乳晕外侧触及一1.0 cm×1.0 cm大小肿物,质硬,表面光滑,可活动;左侧乳腺未触及异常;双侧腋窝未触及肿大淋巴结。术前超声检查见:右侧乳腺乳晕外侧一1.6 cm×1.1 cm×1.0 cm低回声光团,形态不规则,边界欠清;CDFI未探及明显血流信号,右侧腋窝结构尚清,未探及明显异常回声。行右侧乳腺癌改良根治术,肿瘤大小1.6 cm×1.1 cm×1.0 cm,边界清。术后病理示:(右侧)浸润性乳腺癌,癌组织分化低,癌组织未累及基底切缘,右腋窝10个淋巴结均反应性增生。免疫组织化学检查示:雌激素受体(ER)、p53、LCA、孕激素受体(PR)均阴性,CerbB-Ⅱ、CA153、EMA均阳性。
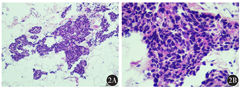
患者入我院后,在全身麻醉下行单侧乳腺癌改良根治术+腋窝淋巴结清扫术,术中将肿瘤完整切除送冰冻病理示:(左侧乳腺肿物)浸润性癌,手术切缘未见癌细胞累及。术后病理示:(左侧乳腺)浸润性癌,非特殊型,Ⅱ级,肿瘤大小1.5 cm×1.0 cm×1.0 cm,未见脉管内瘤栓及癌组织侵犯神经现象。左侧乳腺癌组织学检查示:癌细胞呈腺管样或单个散在弥漫浸润周围脂肪组织(图2A),癌细胞边界不清,可见核分裂象(图2B)。腋窝17个淋巴结未见癌组织转移。免疫组织化学检查示:ER 80%阳性、PR 15%阳性、Ki-67 50%阳性,人表皮生长因子受体2(HER2)、E-cadherin、EMA、GATA3均阳性,p120膜阳性,p53野生型,D2-40淋巴管阳性、瘤栓阴性,GCDFP-15弱阳性,mammaglobin弱阳性,AR、p63、CD117、SMMHC、表皮生长因子受体(EGFR)、calponin、CK5/6均阴性,CD34血管阳性、瘤栓阴性。程序性死亡受体配体1(SP142)表达检测示:免疫细胞评分0%。肿瘤无异质性。荧光原位杂交(FISH)检测结果示:计数20个细胞,HER2基因信号点状分布;CEP17染色体信号平均2.1;HER2信号平均2.3;HER2与CEP17比值为1.1。患者术后恢复良好,术后采用环磷酰胺+多西他赛方案治疗:多西他赛注射液120 mg,注射用环磷酰胺1 g,化疗3次。监测乳腺癌肿瘤标志物未见异常。3次静脉注射化疗药物后,患者无法耐受恶心、呕吐等消化道不良反应,恢复相对缓慢,遂放弃化疗。

双侧乳腺癌可分为双侧同时性乳腺癌和双侧异时性乳腺癌,双侧同时性乳腺癌发病间隔一般≤6个月,双侧异时性乳腺癌一般>6个月[2]。一侧发病后患对侧乳腺癌的风险每年增加0.5%~0.8%;对于有家族性乳腺癌病史且年龄<50岁的FBC患者,10年后患对侧乳腺癌的风险约为20%;对于年龄>50岁的乳腺癌患者,10年后患对侧乳腺癌的风险约为7%[3]。MBC的主要风险因素可能是高龄、高雌激素水平和低雄激素水平、家族和遗传因素、辐射暴露以及睾丸疾病[4]。约10%的乳腺癌患者是由易感基因致病性胚系突变所致,而其家族中往往有乳腺癌患者[5]。在女性中,乳腺癌易感基因BRCA1和BRCA2被认为是大多数遗传性乳腺癌的原因;在男性中,BRCA1似乎与乳腺癌风险的明显增加无关,但有研究发现具有BRCA2突变的男性容易患乳腺癌[6]。
乳腺癌目前治疗仍以外科手术为主。绝大多数MBC患者采用改良根治术,包括腋窝淋巴结清扫或前哨淋巴结活组织检查[7]。辅助治疗包括化疗、放疗、内分泌治疗等多种治疗方案。对于有复发或转移高风险的MBC患者应接受辅助化疗,其可以延长生存期。MBC常用的化疗方案与FBC基本相同,以CMF(环磷酰胺+甲氨蝶呤+5-氟尿嘧啶)、FAC(5-氟尿嘧啶+多柔比星+环磷酰胺)以及蒽环类联合紫杉类为主[7]。本例患者采用环磷酰胺+多西他赛方案静脉注射化疗,后因无法耐受不良反应而放弃化疗。根据FBC临床指南要求,对于改良根治术后受累腋窝淋巴结≥4个、累及内乳、锁骨上及锁骨下淋巴结,肿瘤累及胸壁或皮肤,有脉管侵犯、切缘阳性和炎性癌的乳腺癌患者,建议行乳腺癌切除术后放疗,其可以改善患者的预后。MBC患者也可应用此治疗方案行术后辅助放疗[8]。
内分泌治疗在MBC辅助治疗中也发挥着重要作用。他莫昔芬作为ER拮抗剂,已经成为MBC治疗的主要药物[9]。对于FBC,有研究表明芳香化酶抑制剂(AI)对于绝经后的晚期FBC患者的疗效优于他莫昔芬,而对于MBC患者效果不理想。这可能是男性体内激素与女性存在差异所导致[10] 。氟维司群是一种新型药物,作为ER下调剂,可以加速雌激素的降解,根据指南,已推荐用于绝经后内分泌治疗失败的FBC[9]。在MBC中,雄激素可通过刺激雄激素受体(AR)的乳腺癌细胞生长发挥致癌作用[11],Rangel等[12]通过对402例ER阳性的乳腺癌患者进行回顾性分析发现,作为生物标志物,AR在预测FBC预后中有着重要作用。
靶向治疗,如细胞周期蛋白依赖性激酶4/6抑制剂(CDK4/6),是雌激素的下游因子,对于ER阳性的患者,CDK4/6抑制剂能够从源头位置调控细胞周期,细胞无法形成cyclin D-CDK4/6复合物,将细胞增殖阻滞于G1期向S期的进程中,从而达到抑制肿瘤增殖的目的。对于MBC,美国临床肿瘤学会(ASCO)指南推荐CDK4/6抑制剂可应用于临床[9,13]。
MBC的平均发病年龄范围为60~70岁[4],且发病率较低,男性患者通常忽略乳房早期临床症状,错过最佳治疗时机。出现明显异常表现时,病情已经发展为中晚期,患者淋巴结转移的风险也随之增大,肿瘤晚期的可能性也增高。与FBC相比,MBC的发病率较低[14]。与女性乳房相比,男性乳房胸壁淋巴管较短,更容易发生转移,MBC最常见的转移部位是骨,其次是肺和远处淋巴结。有研究显示MBC预后比FBC差[15]。本例MBC患者年龄大,且合并多种基础疾病,无法耐受长时间手术和不良反应,术后恢复相对较慢。
家族性双侧异时MBC病例较少,也无充分的数据来预测患对侧乳腺癌的风险程度。目前MBC的治疗方案尚无明确指南规定,对于MBC的治疗仍以FBC治疗方案为基础。由于男性乳腺与女性存在差异,手术方式也略有不同,激素治疗效果会因体内激素水平不同而产生明显差异,靶向治疗也只见少数个案报告。对于有乳腺癌家族史男性,建议定期行乳腺检查,以预防乳腺癌发生,做到对乳腺癌早发现、早治疗;对于乳腺癌男性患者,现尚无明确专家共识,应以FBC临床治疗指南进行规范化治疗及术后复查,做到对罹患二次肿瘤的有效预防。
所有作者均声明不存在利益冲突



























