
探讨长链非编码RNA(lncRNA)DHRS4-AS1与骨肉瘤患者无病生存的关系及其体外对骨肉瘤细胞增殖和迁移影响的机制。
收集GEPIA数据库建库以来骨肉瘤患者DHRS4-AS1转录组水平和生存情况数据,依据DHRS4-AS1转录组中位水平将患者分为DHRS4-AS1高表达组和低表达组,各59例,采用Kaplan-Meier法分析两组无病生存情况。采用实时荧光定量聚合酶链反应(qRT-PCR)检测DHRS4-AS1在骨肉瘤细胞株MG-63、HOS、143B、U-2OS、Saos2及正常成骨细胞株hFOB1.19中的表达,选择DHRS4-AS1表达水平最低的骨肉瘤细胞株进行后续实验。将载有DHRS4-AS1序列的质粒和载有阴性对照序列的质粒分别转染至选取的骨肉瘤细胞中,分别为DHRS4-AS1组和对照组。CCK-8法检测各组细胞增殖情况,以吸光度值为细胞增殖能力;细胞划痕实验检测各组细胞迁移情况。采用生物信息学网站starBase V2.0预测DHRS4-AS1的靶基因,双荧光素酶报告基因法验证DHRS4-AS1与靶基因的靶向关系。采用qRT-PCR和蛋白质印迹法检测对照组和DHRS4-AS1组骨肉瘤细胞靶基因及下游基因表达水平。
生存分析显示,GEPIA数据库中DHRS4-AS1高表达组骨肉瘤患者无病生存优于DHRS4-AS1低表达组(P<0.001)。与正常成骨细胞hFOB1.19细胞相比,各骨肉瘤细胞中DHRS4-AS1的表达水平均低(均P<0.01),其中U-2OS细胞中DHRS4-AS1的表达水平最低(P<0.001)。DHRS4-AS1组U-2OS细胞培养1、2、3、4 d后细胞增殖能力均较对照组降低(均P<0.05)。DHRS4-AS1组U-2OS细胞迁移率低于对照组[(31±6)%比(63±4)%,t=4.38,P=0.005]。starBase V2.0网站预测DHRS4-AS1与miRNA-411-3p(miR-411-3p)互补结合;双荧光素酶报告基因实验显示,miR-411-3p过表达降低了野生型DHRS4-AS1报告基因的荧光素酶活性(P<0.001),但对突变型DHRS4-AS1报告基因荧光素酶活性无影响(P>0.05)。qRT-PCR检测显示,与对照组相比,DHRS4-AS1组U-2OS细胞miR-411-3p相对表达量低(0.22±0.06比1.06±0.23,t=3.55,P=0.012),转移抑制因子MTSS1 mRNA相对表达量高(5.58±1.03比1.06±0.22,t=4.28,P=0.005);蛋白质印迹法检测显示,MTSS1表达升高,细胞增殖表型蛋白CDK3、cyclin C和细胞迁移表型蛋白ZEB2、KLF8表达水平均低。
lncRNA DHRS4-AS1高表达骨肉瘤患者无病生存较好,其在骨肉瘤细胞株中低表达。DHRS4-AS1可能通过靶向下调骨肉瘤细胞miR-411-3p的表达,促进MTSS1基因表达,抑制细胞增殖和迁移。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨肉瘤是最常见的恶性骨肿瘤,好发于长骨干骺端[1]。骨肉瘤常见于青少年,男性多于女性[2]。骨肉瘤进展快,易发生以肺部转移为主的远处转移,预后较差[3]。探究骨肉瘤发病机制可能为其治疗带来希望。长链非编码RNA(lncRNA)是一类长度大于200个核苷酸的单链RNA,无编码蛋白能力,广泛存在于各种细胞中[4,5]。lncRNA通过调节靶基因的表达,影响关键蛋白的表达,进而参与细胞增殖、分化、转移、凋亡等的调控[6]。lncRNA在各种肿瘤中存在表达上调或下调的现象,恢复lncRNA的表达平衡有利于抑制肿瘤细胞恶性生物学行为[7,8]。研究显示,lncRNADHRS4-AS1在非小细胞肺癌、肾透明细胞癌等多种肿瘤组织中表达降低,发挥抑癌作用[9,10]。DHRS4-AS1在骨肉瘤中的表达和具体作用机制尚不明确。本研究分析DHRS4-AS1与骨肉瘤患者无病生存的关系,并检测DHRS4-AS1在骨肉瘤细胞株中的表达情况及其体外对骨肉瘤细胞增殖、迁移能力的影响,并探讨其可能的分子机制。
检索GEPIA数据库建库以来骨肉瘤患者无病生存和DHRS4-AS1转录组表达水平信息,根据DHRS4-AS1转录组中位表达水平,将患者分为DHRS4-AS1高表达组和低表达组,每组各59例。分析比较两组患者无病生存情况。
正常成骨细胞株hFOB1.19及骨肉瘤细胞株MG-63、HOS、143B、U-2OS、Saos2购自中国科学院上海细胞库。RPMI 1640培养液、胎牛血清、DMEM/F12培养液购自美国Gibco公司。实时荧光定量聚合酶链反应(qRT-PCR)试剂盒、反转录试剂盒购自日本TaKaRa公司。载有DHRS4-AS1序列的质粒及载有对应阴性对照序列质粒、miR-411-3p模拟物及对应的阴性对照序列模拟物(miR-NC)、双荧光素酶报告基因载体(DHRS4-AS1野生型质粒pGL3-DHRS4-AS1-WT和DHRS4-AS1突变型质粒pGL3-DHRS4-AS1-Mut)购自广州锐博生物科技有限公司。PCR引物购自上海吉玛生物制药有限公司。CCK-8试剂盒购自美国Sigma公司。双荧光素酶报告基因检测试剂盒购自美国Promega公司。KLF8、β-tubulin、MTSS1、cyclin C、CDK3、ZEB2相关一抗及二抗购自美国BD公司。转染试剂Lipofectamine 2000购自美国Invitrogen公司。
MG-63、U-2OS、Saos2细胞用含10%胎牛血清的DMEM/F12培养液,HOS、143B细胞用含10%胎牛血清的RPMI 1640培养液,于37 ℃、5% CO2培养箱中培养。hFOB1.19细胞用含10%胎牛血清的DMEM/F12培养液,于34 ℃、5% CO2培养箱中培养。根据qRT-PCR检测结果,选择DHRS4-AS1水平最低的细胞株进行后续实验。取对数生长期细胞,接种在6孔板,培养至30%融合,按照Lipofectamine 2000转染试剂说明书转染载有DHRS4-AS1序列的质粒及载有对应阴性对照序列质粒,分别为DHRS4-AS1组和对照组,转染48 h后进行后续实验。
利用TRIzol提取细胞总RNA,根据反转录试剂盒说明书合成cDNA。以cDNA为模板进行qRT-PCR。其中,DHRS4-AS1正向引物为5'-GCCTTGTGCATGG ATCAGAC-3',反向引物为5'-GACCATCCCTGTGTGT TAGTGAG-3';miR-411-3p正向引物为5'-UAUGUAA CACGGUCCACUAA-3',反向引物为5'-UUAGUGGAC CGUGUUACAUA-3';MTSS1正向引物为5'-AGCAGC CTGAACAGTGTCAA-3',反向引物为5'-GGGATGGT GACTTGGACTGG-3';内参照U6正向引物为5'-CTCG CTTCGGCAGCACA-3',反向引物为5'-AACGCTTCACGAATTTGCGT-3';内参照β-actin正向引物为5'-CTG GAACGGTGAAGGTGACA-3',反向引物为5'-AAGGG ACTTCCTGTAACAATGCA-3'。PCR检测条件:95 ℃预变性9 min;95 ℃变性10 s,60 ℃退火25 s,72 ℃延伸25 s,共35个循环。目的基因相对表达量采用2-ΔΔCt法计算;其中,miR-411-3p相对表达量以U6为内参照进行计算,DHRS4-AS1和MTSS1 mRNA相对表达量以β-actin为内参照进行计算。实验重复4次。
收集对照组和DHRS4-AS1组细胞,以每孔3.5×103细胞接种至96孔板,培养1、2、3、4 d,每天相同时刻利用CCK-8试剂盒检测细胞增殖能力。简要操作步骤:每孔加入25 μl CCK-8试剂,培养4 h;取出培养板,用酶标仪测定450 nm波长处每孔吸光度(A)值,以A值为细胞增殖能力,绘制细胞生长曲线。实验重复4次。
收集对照组和DHRS4-AS1组细胞,以每孔3.5×105细胞接种至6孔板,培养至90%融合。利用200 μl移液器吸头在孔内底部直线划痕,磷酸盐缓冲液(PBS)清洗3次,加入不含胎牛血清的DMEM/F12培养液。分别在划痕后和培养24 h后于倒置显微镜下观察并拍照,测量划痕宽度。计算细胞迁移率。实验重复4次。
细胞迁移率(%)=(初始划痕宽度-培养24 h后划痕宽度)/初始划痕宽度×100%
利用starBase V2.0网站预测显示,与DHRS4-AS1具有结合位点的基因为miRNA-411-3p(miR-411-3p)(图1)。将pGL3-DHRS4-AS1-WT质粒或pGL3-DHRS4-AS1-Mut质粒分别与miR-411-3p模拟物或miR-NC转染至实验细胞中,每组5个复孔。培养48 h,采用双荧光素酶报告基因检测试剂盒检测每孔萤火虫荧光素酶活性和海肾荧光素酶活性,以海肾荧光素酶活性为内参照,计算得到报告基因相对荧光素酶活性。实验重复4次。
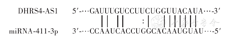
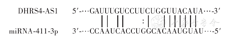
收集对照组和DHRS4-AS1组细胞,利用RIPA裂解液提取细胞总蛋白。每组取60 μg总蛋白行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),利用半湿法将凝胶中条带转至聚偏氟乙烯膜上;5%脱脂牛奶封闭,加入MTSS1(1∶1 000)、CDK3(1∶2 000)、β-tubulin(1∶2 000)、cyclin C(1∶1 000)、ZEB2(1∶ 1 000)、KLF8(1∶1 000)相关一抗,4 ℃下反应过夜。用TBST溶液洗膜3次,加入二抗(1∶10 000),室温反应。用TBST溶液洗膜3次,加入电化学发光液,在凝胶成像系统中曝光和拍照。以β-tubulin为内参蛋白,实验重复4次。
采用SPSS 21.0软件进行统计学分析。计量资料符合正态分布,用 ±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。采用Kaplan-Meire法绘制无病生存曲线,两组间比较采用log-rank检验。以P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。采用Kaplan-Meire法绘制无病生存曲线,两组间比较采用log-rank检验。以P<0.05为差异有统计学意义。
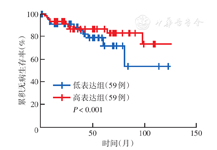
对从GEPIA数据库收集的DHRS4-AS1不同表达水平的骨肉瘤患者进行分析显示,DHRS4-AS1低表达患者无病生存较DHRS4-AS1高表达患者差,差异有统计学意义(P<0.001)(图2)。

qRT-PCR检测显示,正常成骨细胞株hFOB1.19和骨肉瘤细胞株MG-63、HOS、143B、U-2OS、Saos2中DHRS4-AS1的相对表达量分别为1.00±0.01和0.43±0.04、0.63±0.08、0.79±0.05、0.12±0.03和0.46±0.03,各骨肉瘤细胞株中DHRS4-AS1表达水平均低于hFOB1.19细胞(t=14.11,P<0.001;t=4.55,P=0.004;t=3.99,P=0.007;t=28.36,P<0.001;t=18.82,P<0.001),其中U-2OS细胞DHRS4-AS1表达水平最低。
qRT-PCR检测显示,DHRS4-AS1组和对照组U-2OS细胞中DHRS4-AS1相对表达量分别为9.11±1.86和1.08±0.24,差异有统计学意义(t=4.29,P=0.005),提示DHRS4-AS1基因转染成功。CCK-8法检测显示,DHRS4-AS1组U-2OS细胞培养1、2、3、4 d后的A值均低于对照组(均P<0.05)(图3),提示过表达DHRS4-AS1可降低U-2OS细胞增殖能力。细胞划痕实验显示,DHRS4-AS1组U-2OS细胞迁移率低于对照组[(31±6)%比(63±4)%,t=4.38,P=0.005](图4),提示过表达DHRS4-AS1可降低U-2OS细胞迁移能力。
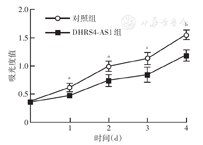

注:DHRS4-AS1组为转染载有DHRS4-AS1序列质粒的U-2OS细胞;对照组为转染载有阴性对照序列质粒的U-2OS细胞;以吸光度值为细胞增殖能力;实验重复4次;与DHRS4-AS1组比较,aP<0.05,bP<0.01
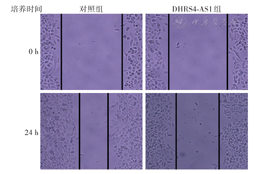

注:DHRS4-AS1组为转染载有DHRS4-AS1序列质粒的U-2OS细胞;对照组为转染载有阴性对照序列质粒的U-2OS细胞
双荧光素酶报告基因检测显示,pGL3-DHRS4-AS1-WT+miR-NC组和pGL3-DHRS4-AS1-WT+miR-411-3p组报告基因荧光素酶相对活性分别为1.01±0.08和0.30±0.05,差异有统计学意义(t=7.05,P<0.001),pGL3-DHRS4-AS1-Mut+miR-NC组和pGL3-DHRS4-AS1-Mut+miR-411-3p组报告基因荧光素酶活性相近(P>0.05),且与pGL3-DHRS4-AS1-WT+miR-NC组间比较,差异均无统计学意义(均P>0.05),提示DHRS4-AS1可互补结合miR-411-3p。
qRT-PCR检测显示,DHRS4-AS1组U-2OS细胞miR-411-3p相对表达量低于对照组(0.22±0.06比1.06±0.23,t=3.55,P=0.012),表明过表达DHRS4-AS1可抑制U-2OS细胞miR-411-3p的表达。DHRS4-AS1组U-2OS细胞转移抑制因子MTSS1 mRNA相对表达量高于对照组(5.58±1.03比1.06±0.22,t=4.28,P=0.005),提示过表达DHRS4-AS1可促进U-2OS细胞MTSS1的表达。
蛋白质印迹法检测显示,与对照组相比,DHRS4-AS1组U-2OS细胞MTSS1蛋白表达水平升高,细胞增殖表型蛋白CDK3、cyclin C表达水平降低,细胞迁移表型蛋白ZEB2、KLF8表达水平亦降低(图5)。提示过表达DHRS4-AS1可能通过影响细胞增殖、迁移相关蛋白的表达而降低U-2OS细胞的增殖和迁移能力。
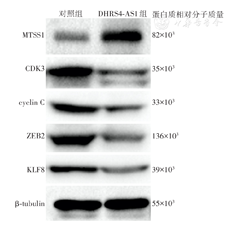

注:DHRS4-AS1组为转染载有DHRS4-AS1序列质粒的U-2OS细胞;对照组为转染载有阴性对照序列质粒的U-2OS细胞
研究表明,FLVCR1-AS1、DLEU2、GAS6-AS2、SPRY4-IT1等lncRNA的异常表达与骨肉瘤的发生、发展相关[11,12,13,14]。DHRS4-AS1由3 052个核苷酸组成,在多种肿瘤中发挥抑癌作用。如DHRS4-AS1在非小细胞肺癌组织中低表达,其可抑制非小细胞肺癌细胞增殖[9];DHRS4-AS1在肾透明细胞癌组织中表达水平与肿瘤的恶性程度负相关,其可抑制肿瘤细胞增殖和转移[10]。DHRS4-AS1在骨肉瘤中的表达和作用机制鲜见报道。本研究对GEPIA数据库骨肉瘤患者数据分析显示,DHRS4-AS1低表达患者无病生存较DHRS4-AS1高表达患者差。进一步对MG-63、HOS、143B、U-2OS、Saos2等多个骨肉瘤细胞株检测显示,DHRS4-AS1在各骨肉瘤细胞中的表达水平较正常成骨细胞株hFOB1.19均低,其中U-2OS细胞DHRS4-AS1表达水平最低;过表达DHRS4-AS1可抑制U-2OS细胞增殖和迁移,同时细胞增殖表型蛋白CDK3、cyclin C表达水平明显降低,细胞迁移表型蛋白ZEB2、KLF8表达水平亦明显降低,说明DHRS4-AS1可能在骨肉瘤的发生和发展中发挥抑癌作用。
本研究通过starBase V2.0网站预测显示,DHRS4-AS1可与miR-411-3p互补结合。已有研究报道,miR-411-3p在多种肿瘤中表达异常,如非小细胞肺癌组织和细胞系中miR-411-3p呈高表达,其可显著促进非小细胞肺癌细胞的生长和上皮间质转化[15];非小细胞肺癌患者血清miR-411-3p水平显著高于健康人,其表达水平与TNM分期、是否淋巴结转移和分化程度相关,miR-411-3p高表达是非小细胞肺癌患者的独立不良预后因素[16]。研究显示,miR-411-3p在骨肉瘤患者血清中的表达水平显著高于健康人,在骨肉瘤组织和细胞系中呈高表达,其可促进骨肉瘤细胞的增殖和迁移[17]。本研究双荧光素酶报告基因实验验证显示,miR-411-3p为DHRS4-AS1的靶基因。过表达DHRS4-AS1后,U-2OS细胞miR-411-3p表达水平明显降低,表明DHRS4-AS1可能通过靶向调节miR-411-3p表达,抑制骨肉瘤细胞的增殖和迁移。
研究表明,转移抑制因子MTSS1是一种抑癌基因,骨肉瘤细胞中miR-411-3p主要通过靶向抑制MTSS1蛋白而发挥致癌作用[17]。本研究结果显示,过表达DHRS4-AS1后,骨肉瘤U-2OS细胞中MTSS1 mRNA和蛋白的表达水平均明显升高,进一步表明DHRS4-AS1对骨肉瘤的抑制作用可能是通过抑制miR-411-3p而实现的。
本研究存在一定的局限性,如未明确DHRS4-AS1在体内是否能够抑制骨肉瘤细胞的增殖和迁移,下一步将通过动物实验观察和分析DHRS4-AS1在体内对骨肉瘤细胞功能的影响。
综上所述,DHRS4-AS1高表达的骨肉瘤患者无病生存较好,其在骨肉瘤细胞株中低表达。DHRS4-AS1可能通过抑制miR-411-3p表达而促进细胞转移抑制因子MTSS1的表达,进而抑制骨肉瘤U-2OS细胞增殖和迁移。本研究为骨肉瘤的治疗新靶点和相关机制提供了一定的参考。
所有作者均声明不存在利益冲突



























