
肝癌的早期诊断、有效的治疗和复发转移监测一直是困扰临床医师的难题。微RNA(miRNA)在肝癌细胞增殖、凋亡、代谢等过程中有重要作用,并且其可以释放到血液、尿液和唾液等体液中。外周血中miRNA可作为肝癌诊断、疗效评估、复发转移监测和预后判断的生物标志物,甚至可能成为肝癌的治疗靶标。文章就将外周血循环中的miRNA作为肝癌诊疗监测标志物的研究进展进行总结。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝细胞癌(HCC)占原发性肝癌的75%~85%,其发病率在世界范围内呈上升趋势,尤其是在亚洲地区[1]。根据GLOBOCAN 2020的数据,HCC的发病率在全球癌症中位居第6位,预计到2040年HCC患者将增加60.9%[2]。常用的肝癌标志物为甲胎蛋白(AFP),但并不是所有肝癌患者AFP均升高,有30%的早期肝癌患者AFP正常[3]。
近年来,循环微RNA(miRNA)的生物学功能及其作为潜在生物标志物在肝癌中的临床应用价值被不断证明。miRNA是一种由约22个核苷酸组成的单链内源性非编码RNA,miRNA基因由RNA聚合酶Ⅱ转录,受到与蛋白质编码基因相同类型的表观遗传调控[4]。在人类中已经发现了超过2 000个miRNA,大多数蛋白质的表达水平受到一个或多个miRNA的调控,单个miRNA可以具有许多mRNA靶标,而单个mRNA可以被多个miRNA靶向。作为非侵袭性标志物,miRNA被用于疾病的预后评估和肿瘤分类中[5]。文章总结了外周血循环miRNA在肝癌诊断、复发、转移、预后及疗效监测中的研究进展以及目前主要的miRNA检测技术。
血清miRNA的差异表达有助于HCC的诊断和预后判断。在肝癌诊断方面,应用受试者工作特征(ROC)曲线分析血清miR-122在区分HCC患者和健康人时的曲线下面积(AUC)值达到0.91[6]。有研究者对来自同一患者和非癌症的对照组的血清样本miRNA表达进行分析,发现miR-21通过外泌体从肿瘤组织输出到血清,血清中的miR-21对HCC诊断的ROC曲线的AUC值可达0.88[7]。Liu等[8]对血清miR-221在肝癌预后中的作用进行了Meta分析,发现miR-221的高表达可以预测HCC的不良预后,以总生存(OS)为预后指标时HR为1.91,以无进展生存(PFS)期为预后指标时HR为2.02。可见miR-221可成为HCC的有前途的预后生物标志物。
Cho等[9]通过TCGA数据分析发现exo-miR-10b-5p、exo-miR-18a-5p、exo-miR-215-5p和exo-miR-940在HCC组织中持续表达,将肝癌患者、肝硬化患者、慢性乙型肝炎患者和健康人血清作为队列时,血清exo-miR-10b-5p对肝癌有良好的诊断效能,从高肝癌风险组(肝硬化和慢性乙型肝炎患者)中诊断出肝癌的ROC曲线的AUC值为0.925。类似地,与非癌组织相比,miR-223-3p、miR-199a-5p和miR-451a在肝癌组织中的表达显著降低,在血清样本的验证队列中发现HCC组的循环miR-223-3p水平较健康人显著降低,它们的表达与肿瘤大小和肝癌巴塞罗那临床(BCLC)分期呈负相关,AUC值为0.81,血清miR-223-3p高表达患者的中位OS时间为44.4个月,显著优于血清表达水平低的患者(中位OS时间为20.7个月),因此血清miR-223-3p被认为是肝癌诊断和预后判断的重要因子[10]。
与单一miRNA标志物相比,多个miRNA或者miRNA联合AFP对HCC的诊断和预后判断具有更高的价值。ROC曲线分析miR-155、miR-96、miR-99a和AFP在HCC诊断中的AUC值分别为0.840、0.824、0.799和0.839,当miR-155、miR-96和miR-99a联合时,AUC为0.931,4项指标联合诊断时AUC为0.979[11]。联合循环miR-148/152家族诊断HCC的ROC曲线的AUC值为0.940,与单纯血清AFP(AUC值为0.866)相比,显著升高,提示循环miR-148/152家族可为HCC提供明确的诊断价值[12]。通过对数据库的检索,发现目前共有26项关于血清miRNA联合诊断肝癌的研究,涉及38个血清miRNA,具体诊断效能见表1。
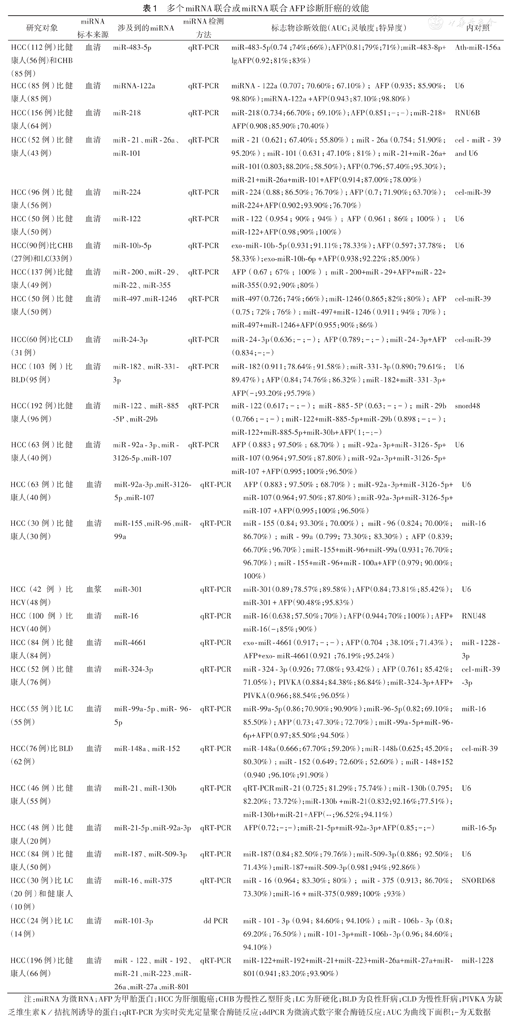
多个miRNA联合或miRNA联合AFP诊断肝癌的效能
多个miRNA联合或miRNA联合AFP诊断肝癌的效能
| 研究对象 | miRNA标本来源 | 涉及到的miRNA | miRNA检测方法 | 标志物诊断效能(AUC;灵敏度;特异度) | 内对照 |
|---|---|---|---|---|---|
| HCC(112例)比健康人(56例)和CHB(85例) | 血清 | miR-483-5p | qRT-PCR | miR-483-5p(0.74;74%;66%);AFP(0.81;79%;71%);miR-483-8p+lgAFP(0.92;81%;83%) | Ath-miR-156a |
| HCC(85例)比健康人(85例) | 血清 | miRNA-122a | qRT-PCR | miRNA-122a(0.707;70.60%;67.10%);AFP(0.935;85.90%;98.80%);miRNA-122a +AFP(0.943;87.10%;98.80%) | U6 |
| HCC(156例)比健康人(64例) | 血清 | miR-218 | qRT-PCR | miR-218(0.734;66.70%;69.10%);AFP(0.851;-;-);miR-218+AFP(0.908;85.90%;70.40%) | RNU6B |
| HCC(52例)比健康人(43例) | 血清 | miR-21、miR-26a、miR-101 | qRT-PCR | miR-21(0.621;67.40%;55.80%);miR-26a(0.754;51.90%;95.20%);miR-101(0.631;47.10%;81%);miR-21+miR-26a+miR-101(0.803;88.20%;58.50%);AFP(0.796;57.40%;95.30%);miR-21+miR-26a+miR-101+AFP(0.914;87.00%;78.00%) | cel-miR-39and U6 |
| HCC(96例)比健康人(56例) | 血清 | miR-224 | qRT-PCR | miR-224(0.88;86.50%;76.70%);AFP(0.7;71.90%;63.70%);miR-224+AFP(0.902;93.90%;76.70%) | cel-miR-39 |
| HCC(50例)比健康人(50例) | 血清 | miR-122 | qRT-PCR | miR-122(0.954;90%;94%);AFP(0.961;86%;100%);miR-122+AFP(0.98;90%;100%) | U6 |
| HCC(90例)比CHB(27例)和LC(33例) | 血清 | miR-10b-5p | qRT-PCR | exo-miR-10b-5p(0.931;91.11%;78.33%);AFP(0.597;37.78%;58.33%);exo-miR-10b-6p +AFP(0.938;92.22%;85.00%) | U6 |
| HCC(137例)比健康人(49例) | 血清 | miR-200、miR-29、miR-22、miR-355 | qRT-PCR | AFP(0.67;67%;100%);miR-200+miR-29+AFP+miR-22+miR-355(0.92;90%;80%) | |
| HCC(50例)比健康人(50例) | 血清 | miR-497、miR-1246 | qRT-PCR | miR-497(0.726;74%;66%);miR-1246(0.865;82%;80%);AFP(0.75;72%;76%);miR-497+miR-1246(0.911;94%;70%);miR-497+miR-1246+AFP(0.955;90%;86%) | cel-miR-39 |
| HCC(60例)比CLD(31例) | 血清 | miR-24-3p | qRT-PCR | miR-24-3p(0.636;-;-);AFP(0.789;-;-);miR-24-3p+AFP(0.834;-;-) | cel-miR-39 |
| HCC(103例)比BLD(95例) | 血清 | miR-182、miR-331-3p | qRT-PCR | miR-182(0.911;78.64%:91.58%);miR-331-3p(0.890;79.61%;89.47%);AFP(0.84;74.76%;86.32%);miR-182+miR-331-3p+AFP(-;93.20%;95.79%) | U6 |
| HCC(192例)比健康人(96例) | 血清 | miR-122、miR-885-5P、miR-29b | qRT-PCR | miR-122(0.617;-;-);miR-885-5P(0.63;-;-);miR-29b(0.766;-;-);miR-122+miR-885-5p+miR-29b(0.898;-;-);miR-122+miR-885-5p+miR-30b+AFP(1;-;-) | snord48 |
| HCC(63例)比健康人(40例) | 血清 | miR-92a-3p、miR -3126-5p、miR-107 | qRT-PCR | AFP(0.883;97.50%;68.70%);miR-92a-3p+miR-3126-5p+miR -107(0.964;97.50%;87.80%);miR -92a-3p+miR -3126-5p+miR-107 +AFP(0.995;100%;96.50%) | U6 |
| HCC(63例)比健康人(40例) | 血清 | miR-92a-3p、miR-3126-5p、miR-107 | qRT-PCR | AFP(0.883;97.50%;68.70%);miR-92a -3p+miR-3126 -5p+miR-107(0.964;97.50%;87.80%);miR-92a-3p+miR-3126-5p+miR-107 +AFP(0.995;100%;96.50%) | U6 |
| HCC(30例)比健康人(30例) | 血清 | miR-155、miR-96、miR-99a | qRT-PCR | miR-155(0.84;93.30%;70.00%);miR-96(0.824;70.00%;86.70%);miR-99a(0.799;73.30%;83.30%);AFP(0.839;66.70%;96.70%);miR-155+miR-96+miR-99a(0.931;76.70%;96.70%);miR-155+miR-96+miR-100a+AFP(0.979;90.00%;100%) | miR-16 |
| HCC(42例)比HCV(48例) | 血浆 | miR-301 | qRT-PCR | miR-301(0.89;78.57%;89.58%);AFP(0.84;73.81%;85.42%);miR-301 + AFP(90.48%;95.83%) | U6 |
| HCC(100例)比HCV(40例) | 血清 | miR-16 | qRT-PCR | miR-16(0.638;57.50%;70%);AFP(0.944;70%;100%);AFP+miR-16(-;85%;90%) | RNU48 |
| HCC(84例)比健康人(84例) | 血清 | miR-4661 | qRT-PCR | exo-miR-4661(0.917;-;-);AFP(0.704;38.10%;71.43%);AFP+exo-miR-4661(0.921;76.19%;95.24%) | miR-1228 -3p |
| HCC(52例)比健康人(76例) | 血清 | miR-324-3p | qRT-PCR | miR-324-3p(0.926;77.08%;93.42%);AFP(0.761;85.42%;71.05%);PIVKA(0.884;84.38%;86.84%);miR-324-3p+AFP+PIVKA(0.966;88.54%;96.05%) | cel-miR-39-3p |
| HCC(55例)比LC(55例) | 血清 | miR-99a-5p、miR- 96-5p | qRT-PCR | miR-99a-5p(0.86;70.90%;90.90%);miR-96-5p(0.82;69.10%;85.50%);AFP(0.73;47.30%;72.70%);miR-99a-5p+miR-96 -6p+AFP(0.97;85.50%;94.50%) | miR-16 |
| HCC(76例)比BLD(62例) | 血清 | miR-148a、miR-152 | qRT-PCR | miR-148a(0.666;67.70%;59.20%);miR-148b(0.625;45.20%;80.30%);miR-152(0.649;72.60%;52.60%);miR-148+152(0.940;96.10%;91.90%) | cel-miR-39 |
| HCC(46例)比健康人(55例) | 血清 | miR-21、miR-130b | qRT-PCR | qRT-PCR miR-21(0.725;81.29%;75.74%);miR-130b(0.795;82.20%;73.72%);miR-130b +miR-21(0.832;92.16%;77.51%);miR-130b+miR-21+AFP(--;96.52%;94.11%) | U6 |
| HCC(48例)比健康人(20例) | 血清 | miR-21-5p、miR-92a-3p | qRT-PCR | AFP(0.72;-;-);miR-21-5p+miR-92a-3p+AFP(0.85;-;-) | miR-16-5p |
| HCC(84例)比健康人(50例) | 血清 | miR-187、miR-509-3p | qRT-PCR | miR-187(0.84;82.50%;79.76%);miR-509-3p(0.886;92.50%;71.43%);miR-187+miR-509-3p(0.981;94%;92.86%) | U6 |
| HCC(30例)比LC(20例)和健康人(10例) | 血清 | miR-16、miR-375 | qRT-PCR | miR-16(0.964;83.30%;80%);miR-375(0.913;86.70%;73.30%);miR-16 + miR-375(0.989;100%;93%) | SNORD68 |
| HCC(24例)比LC(14例) | 血清 | miR-101-3p | dd PCR | miR-101-3p(0.94;84.60%;94.10%);miR-106b-3p(0.8;69.20%;76.50%);miR-101-3p+miR-106b-3p(0.96;84.60%;94.10%) | |
| HCC(196例)比健康人(66例) | 血清 | miR-122、miR-192、miR-21、miR-223、miR-26a、miR-27a、miR-801 | qRT-PCR | miR-122+miR-192+miR-21+miR-223+miR-26a+miR-27a+miR-801(0.941;83.20%;93.90%) | miR-1228 |
注:miRNA为微RNA;AFP为甲胎蛋白;HCC为肝细胞癌;CHB为慢性乙型肝炎;LC为肝硬化;BLD为良性肝病;CLD为慢性肝病;PIVKA为缺乏维生素K/拮抗剂诱导的蛋白;qRT-PCR为实时荧光定量聚合酶链反应;ddPCR为微滴式数字聚合酶链反应;AUC为曲线下面积;-为无数据
Hu等[13]发现与原发的结直肠癌相比,发生肝转移的患者miR-425和miR-576表达升高,miR-425与miR-576的组合是肝转移和不良临床结果的有效预测模型,推测二者是结直肠癌肝转移预防和免疫治疗的新型生物标志物。Tian等[14]发现miR-221/222可促进结直肠癌进展,并可作为肝转移性结直肠癌的新预后标志物和治疗靶点。另外有研究发现miR-30a的过表达和miR-200c、miR-141和miR-425的表达降低可以区分肝内胆管癌和来自胃肠道的肝转移[15]。
索拉非尼是治疗晚期HCC的一线药物之一,但很多患者会产生耐药,治疗效果并不理想。目前迫切需要研发评估索拉非尼疗效的预测性生物标志物和靶点。Fernández-Tussy等[16]检测了接受索拉非尼治疗的肝癌患者的循环miR-518d-5p,并分析了miR-518d-5p与治疗时间和患者OS的关系,结果发现与健康人相比,miR-518d-5p水平在肝癌患者的肝脏和血清样本中表达高。血清中miR-518d-5p高于中位水平的肝癌患者组索拉非尼治疗时间为4.46个月(Q1,Q3:1.61,7.76),治疗后生存期为6.49个月(95% CI 4.40~12.75),而表达高于中位水平的患者治疗时间为8.02个月(Q1,Q3:4.57,13.64),治疗后生存期为12.39个月(95% CI 8.81~17.09),循环miR-518d-5p可能是一种对索拉非尼疗效预测的生物标志物。Kohno等[17]发现索拉非尼治疗肝癌有效组的miR-30d表达较无效组高,血清miR-30d可以作为索拉非尼治疗肝细胞癌疗效的预测性生物标志物。在45例接受索拉非尼治疗的晚期HCC患者中,与miR-10b-3p水平低的患者相比,miR-10b-3p水平高的患者OS时间显著延长(13.9个月比3.5个月,P=0.021),提示索拉非尼治疗的晚期HCC患者的血清miR-10b-3p水平可作为预测索拉非尼疗效的生物标志物[18]。ROC曲线分析发现,治疗前miR-181a-5p的血清ΔCq最能反映索拉非尼治疗3个月后的疾病控制情况。ΔCq临界值为3.25,是鉴别疾病控制与非疾病控制病例的最佳方法,灵敏度为75.00%,特异度为67.57%[19]。
姜黄素、胡椒碱和牛磺酸联合治疗HCC的患者外周血中白细胞介素(IL)-10和miR-21水平均降低,二者可能作为该联合治疗方法的疗效监测标志物[20]。经肝动脉插管化疗栓塞(TACE)治疗失败的HCC患者的血浆micoRNA-122高于治疗成功组,提示血浆miR-122可作为HCC患者TACE后治疗反应的预测指标[21]。肿瘤切除和肝移植是早期HCC患者重要的治疗选择,但如何筛选手术获益的人群较为困难。miR-193a-5p是肝癌的抑癌因子,有研究者通过反转录-聚合酶链反应评估41例接受肿瘤切除(33例)与肝移植(8例)的HCC患者和20例对照者的血清miR-193a-5p水平,结果显示,与健康对照相比,HCC患者的循环miR-193a-5p水平显著升高,术前相对miR-193a-5p水平高于临界值(3.57)的HCC患者的中位OS时间仅为451 d,而水平低于临界值的患者中位OS时间1 158 d。提示miR-193a-5p可作为早期HCC患者的生物标志物,有助于评估术后结局[22]。Yokota等[23]检测了54例行切除手术治疗的肝癌患者的血清miR-638,发现miR-638高表达组的2年无病生存率为47.1%,低于表达组的为77.4%。Canale等[24]对行切除术和射频消融治疗的肝癌患者术前的血清miRNA进行检测,发现射频消融后肿瘤复发的患者let-7c表达水平高于未复发患者和切除术治疗的患者,let-7c可以帮助选择肝癌的治疗方式。
有50%~70%的肝癌患者在术后5年内出现复发[25],高复发率和转移率限制了肝癌患者的治疗[26]。因此寻找可靠的标志物,准确预测肝癌患者的早期复发和术后生存是非常重要的。血清miRNA的表达水平会随着肝癌的转移和复发发生变化,如miR-497在肝癌中的表达水平低于健康对照组,当无淋巴结转移的肝癌患者miR-497的表达水平为1.0时,发生淋巴结转移的患者为0.4;未发生远处转移的患者miR-497的表达水平为1.0时,发生远处转移的患者为0.4[27]。miR-143也在肝癌患者血清中表达降低,研究者对行切除术的131例HCC患者随访3年,发现miR-143低表达组的肝癌转移/复发率为30.19%(16/53),高表达组为8.97%(7/78),提示miR-143高表达组患者的预后更佳[28]。血清miR-638与肝癌的转移相关,高表达组远处转移率为11.1%,肝内转移率为51.9%,而低表达组远处转移率为7.4%,肝内转移率为25.9%。肝癌远处转移患者血清miR-21阳性率为83.3%(10/12),未发生转移的患者为59.5%(97/163),提示血清miR-21水平可能与远处转移有关[29]。
血清miRNA可以作为肝癌的术后复发转移监测标志物。在一项对110例接受射频消融治疗的肝癌患者进行5年随访的研究中,64例患者出现复发,复发患者血清miR-130b水平显著高于未复发患者(3.79±1.06比3.19±1.02,P<0.05),miR-130b在可作为监测HCC患者射频消融治疗后复发的指标之一[30]。有研究者检测了接受肝移植手术前后肝癌患者的血清miRNA panel(miR-21、miR-26a、miR-27a、miR-122、miR-192、miR-223、miR-801),miRNA panel阴性和阳性患者的肿瘤复发率具有可比性,miRNA检测阳性组的复发率高于检测阴性组[31]。miR-486-5p也可以预测肝癌的术后复发率,将术后肝癌患者分为术后12个月内复发组和术后12个月未复发组,AFP+微血管侵犯(MVI)预测的ROC曲线的AUC值为75.98%(灵敏度为85.90%,特异度为63.13%),AFP+MVI+ miR-486-5p的预测AUC值为88.02%(灵敏度为92.1%,特异度为69.2%)[32]。有研究者根据术前血清外泌体中miR-718的平均水平将59例肝移植的HCC病例分为两组,发现6例复发患者的miR-718均在低表达组,而高miR-718表达组无复发病例[33]。
成熟的miRNA由于片段小,而且无poly(A)尾部。导致在检测过程中序列不稳定,容易降解、家族成员间相似性高、各种细胞在不同时期的表达水平都有差异且普遍偏低、pre-miRNA中包含miRNA序列,对检测的特异性容易造成干扰等问题[34]。现将目前常用的miRNA检测技术总结如下。(1)RNA印迹:操作简单易行,不需要专门的设备;耗时长,操作繁琐,样品需要量大,且灵敏度低。(2)微阵列:快速高通量检测,但容易发生交叉反应,成像仪器昂贵,检测动态范围小。(3)实时荧光定量聚合酶链反应:能大幅度增加DNA的量,有较高的灵敏度和实用性,但操作复杂、耗时长,对引物的设计要求很高且温度难以控制。(4)等温扩增法:扩增效率高,特异性强,反应时间短,温度恒定,并且无需复杂仪器,但对引物要求高,敏感性强,容易造成假阳性结果。产物不能用于克隆测序。(5)新一代大规模测序技术:检测效率高;适用于任何miRNA的检测,包括未被发现的序列和已知的序列,但测序时间长,读长短,末端质量差。
miRNA通过影响细胞凋亡、增殖、细胞周期、转移、DNA甲基化等在肝癌发展中发挥重要作用,如let-7通过靶基因caspase-3、STAT3、HMGA2影响肝癌的细胞凋亡和增殖;miR-26a通过作用于CDK6、IL-6、cyclin D2、E1、E2影响细胞周期[35];miR-21通过促进肝纤维化导致肝癌发生,miR-21的表达水平在肝癌患者血清和组织中均显著上调[36]。循环miRNA在肝癌的诊断、复发转移监测、疗效和预后评估中具有一定潜力,但仍存在诸多问题,比如灵敏度和特异度有待进一步提高,还有很多miRNA在肝癌中的作用机制有待探究,此外,血清miRNA含量较少,尚未找到最佳检测方法和统一的内对照。相信随着miRNA在肝癌中作用的深入研究和检测技术的发展,miRNA在肝癌早期诊断和临床监测中将发挥更加重要的作用。
所有作者均声明不存在利益冲突



























