
2022年世界卫生组织(WHO)推出肾肿瘤的第5版分类。此版分类继续沿用了既往以细胞形态为主、兼顾组织结构的肾肿瘤分类框架,并首次提出分子特征定义的肾细胞癌概念。文章从WHO肾肿瘤病理分类、分级历史变迁,2022版及2016版WHO肾肿瘤分类对比,分子特征在ELOC突变型肾细胞癌、ALK重排性肾细胞癌、嗜酸性实性及囊性肾细胞癌等新增病理类型的作用3个方面对新版WHO分类进行解读。旨在更好地认识WHO从传统的以组织形态为基础的分类体系转变为一类涵盖形态、免疫表型和基因特征的三体一位的整合分类体系,并理解在新的分类体系下分子病理学对病理医师及临床医师工作的重要指导价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2022年世界卫生组织(WHO)推出肾肿瘤的第5版分类。此版分类继续沿用了既往以细胞形态为主、兼顾组织结构的肾肿瘤分类框架,并首次提出分子特征定义的肾细胞癌概念;明确提出各类肿瘤诊断的必要标准和期待标准;细化了病理分级的适用范围[1]。为了更好地理解和再认识此版分类,现将2022年版WHO肾细胞癌分类要点解读如下。
最初的观点认为,肾上皮源性的恶性肿瘤均起源于肾小管上皮,称为肾细胞癌。因此,在1981年第1版分类中,肾肿瘤仅有肾细胞癌一种类型,不区分亚型[2]。1986年,Thoenes等[3]通过对510例肾细胞癌详细的组织形态学及电子显微镜的观察,构建了依据细胞形态,兼顾组织结构特征的分类体系。1998年的第2版WHO肾细胞癌分类在此基础上将肾细胞癌分成透明细胞癌、颗粒细胞癌、嫌色细胞癌、肉瘤样癌、乳头状肾细胞癌、未分类肾细胞癌6种病理类型[4];并且依据肿瘤部位提出了肾集合管癌病理类型。多种分类依据的出现可区分更多的肾肿瘤类型,使之成为一个动态系统。之后的WHO肾癌分类体系致力于其他分类依据的拓展,提出了综合细胞形态及组织结构、疾病背景、分子特征等的新类型,而分子特征成为肾细胞癌病理类型增多的主因[5,6]。2022年版首次将具有特定分子改变的肾细胞癌归集为分子特征定义的肾细胞癌,更是凸显了分子病理在WHO分类中的支撑作用[1](图1)。
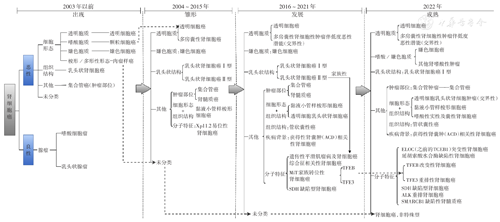

病理分级是肾细胞癌预后预测的重要因素。最初的肾细胞癌病理分级系统主要依据组织结构,兼顾细胞形态/类型、细胞核特征或核分裂象及坏死,并适用于所有类型。而后,随着肾细胞癌分类依据进展,组织结构和细胞形态/类型成为肾细胞癌病理分型的主要依据,两者逐渐淡出了病理分级系统;而细胞核特征,如核大小、核形状及核仁等,成为肾细胞癌病理分级的依据。其中1985年Fuhrman等提出的以核大小、核形状以及核仁明显作为分级依据的4级Fuhrman分级被广泛接受。2012年WHO及国际泌尿病理协会(ISUP)对此分级作了进一步改良,提出WHO/ISUP分级标准,并被WHO第4版分类采用[7],此分级仅适用透明细胞癌和乳头状肾细胞癌[6]。2022年版WHO分类则更详细地说明了此分级的应用范围[1]。虽然我们在不同类型的肾细胞癌中均可见到病理分级的信息,但临床意义存在明显区别。首先,透明细胞癌和乳头状肾细胞癌必须使用WHO/ISUP分级,嫌色细胞癌则可应用嫌色肿瘤分级系统(CTG)分级;其次,集合管癌、SMARCB1缺陷性肾细胞癌因呈高度恶性临床经过,无需分级;再次,TFE3易位性肾细胞癌其病理分级与预后无关,而管状囊性癌、获得性肾囊肿相关性肾细胞癌、嗜酸性实性/囊性肾细胞癌及嗜酸性空泡状肿瘤因呈现高核级与惰性临床经过不匹配的特征,均不应用分级系统;此外,乳头状腺瘤、低度恶性潜能多房囊性肾肿瘤及透明细胞乳头状肾肿瘤则以低核级为确诊的必要条件。因此,在进行肾细胞癌病理分级时,要充分重视各分级的应用范围,避免造成过度诊断或诊断不足,最终影响临床治疗方案的制订(表1)[1,8]。
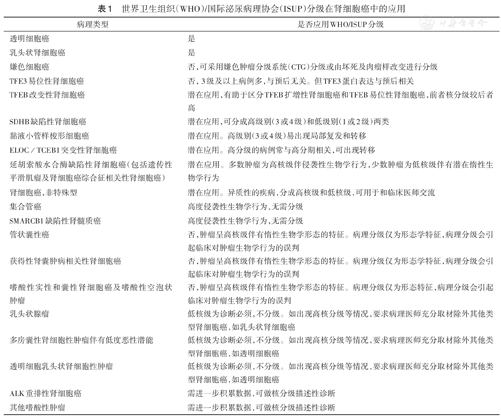
世界卫生组织(WHO)/国际泌尿病理协会(ISUP)分级在肾细胞癌中的应用
世界卫生组织(WHO)/国际泌尿病理协会(ISUP)分级在肾细胞癌中的应用
| 病理类型 | 是否应用WHO/ISUP分级 |
|---|---|
| 透明细胞癌 | 是 |
| 乳头状肾细胞癌 | 是 |
| 嫌色细胞癌 | 否,可采用嫌色肿瘤分级系统(CTG)分级或由坏死及肉瘤样改变进行分级 |
| TFE3易位性肾细胞癌 | 否,3级及以上病例多,与预后无关。但TFE3蛋白表达与预后相关 |
| TFEB改变性肾细胞癌 | 潜在应用,有助于区分TFEB扩增性肾细胞癌和TFEB易位性肾细胞癌,前者核分级较后者高 |
| SDHB缺陷性肾细胞癌 | 潜在应用,可分成高级别(3或4级)和低级别(1或2级)两类 |
| 黏液小管样梭形细胞癌 | 潜在应用。高级别(3或4级)易出现局部复发和转移 |
| ELOC/TCEB1突变性肾细胞癌 | 潜在应用。高分级的病例常与高分期相关,可出现转移 |
| 延胡索酸水合酶缺陷性肾细胞癌(包括遗传性平滑肌瘤及肾细胞癌综合征相关性肾细胞癌) | 潜在应用。多数肿瘤为高核级伴侵袭性生物学行为,少数肿瘤为低核级伴有潜在惰性生物学行为 |
| 肾细胞癌,非特殊型 | 潜在应用。异质性的疾病,分成高核级和低核级,可用于和临床医师交流 |
| 集合管癌 | 高度侵袭性生物学行为,无需分级 |
| SMARCB1缺陷性肾髓质癌 | 高度侵袭性生物学行为,无需分级 |
| 管状囊性癌 | 否,肿瘤呈高核级伴有惰性生物学形态的特征。病理分级仅为形态学特征,病理分级会引起临床对肿瘤生物学行为的误判 |
| 获得性肾囊肿病相关性肾细胞癌 | 否,肿瘤呈高核级伴有惰性生物学形态的特征。病理分级仅为形态学特征,病理分级会引起临床对肿瘤生物学行为的误判 |
| 嗜酸性实性和囊性肾细胞癌及嗜酸性空泡状肿瘤 | 否,肿瘤呈高核级伴有惰性生物学形态的特征。病理分级仅为形态特征,病理分级会引起临床对肿瘤生物学行为的误判 |
| 乳头状腺瘤 | 低核级为诊断必须,不分级。如出现高核分级等情况,要求病理医师充分取材除外其他类型肾细胞癌,如乳头状肾细胞癌 |
| 多房囊性肾细胞性肿瘤伴有低度恶性潜能 | 低核级为诊断必须,不分级。如出现高核分级等情况,要求病理医师充分取材除外其他类型肾细胞癌,如透明细胞癌 |
| 透明细胞乳头状肾细胞性肿瘤 | 低核级为诊断必须,不分级。如出现高核分级等情况,要求病理医师充分取材除外其他类型肾细胞癌,如透明细胞癌 |
| ALK重排性肾细胞癌 | 需进一步积累数据,可做核分级描述性诊断 |
| 其他嗜酸性肿瘤 | 需进一步积累数据,可做核分级描述性诊断 |
2022年版WHO肾细胞性肿瘤总计分为21大类。各类肿瘤关于分子病理描述的重点是与诊断相关的分子病理改变,缺乏与预后或治疗相关的信息。相信在不远的将来,针对肿瘤预后预测以及治疗方案筛选的特定基因或基因组改变会加入肿瘤分子病理学描述。与2016年版WHO分类相比,2022年版WHO分类主要变化如下[1,6](表2)。

2022年版与2016年版世界卫生组织肾细胞性肿瘤分类对比
2022年版与2016年版世界卫生组织肾细胞性肿瘤分类对比
| 2022年版肾细胞性肿瘤分类命名 | 与2016年版肾细胞性肿瘤分类对比 |
|---|---|
| 透明细胞肿瘤 | |
| 透明细胞性肾细胞癌 | 相同 |
| 低度恶性潜能的多房囊性肾肿瘤 | 相同 |
| 乳头状肾肿瘤 | |
| 乳头状腺瘤 | 相同 |
| 乳头状肾细胞癌 | 分类范围缩小a |
| 嗜酸性和嫌色性肾肿瘤 | |
| 嗜酸细胞瘤 | 相同 |
| 嫌色细胞癌 | 相同 |
| 其他嗜酸性肾肿瘤 | 新增b |
| 集合管肿瘤 | |
| 集合管癌 | 相同 |
| 其他肾肿瘤 | |
| 透明细胞乳头状肾细胞性肿瘤 | 重命名(2016版:透明细胞乳头状肾细胞癌) |
| 黏液小管样和梭形细胞癌 | 相同 |
| 管状囊性癌 | 相同 |
| 获得性肾囊肿病相关性肾细胞癌 | 相同 |
| 嗜酸性实性和囊性肾细胞癌 | 新增 |
| 肾细胞癌,非特殊型 | 重命名及分类缩小(2016版:肾细胞癌,未分类) |
| 分子类型肾细胞癌 | |
| TFE3重排性肾细胞癌 | 重新分类(2016版:MiT家族转位性肾细胞癌) |
| TFEB改变性肾细胞癌 | 重新分类c(2016版:MiT家族转位性肾细胞癌) |
| ELOC(之前的TCEB1)突变型肾细胞癌 | 新增 |
| 延胡索酸水合酶缺陷性肾细胞癌 | 重命名d(2016版:遗传性平滑肌瘤病和肾细胞,癌综合征相关性肾细胞癌) |
| 琥珀酸脱氢酶缺陷性肾细胞癌 | 相同 |
| ALK重排性肾细胞癌 | 新增 |
| SMARCB1缺陷性肾髓质癌 | 重命名e(2016版:肾髓质癌) |
注:a仅指经典型乳头状肾细胞癌,I型;b组织形态不能归入嗜酸细胞瘤及嫌色细胞癌以及其他类型肾肿瘤伴有嗜酸性胞质特征;c包括TFEB转位性肾细胞癌和TFEB扩增性肾细胞癌;d包括散发性及家族性延胡索酸水合酶缺陷性肾细胞癌;e分成SMARCB1缺陷性髓质样肾细胞癌、SMARCB1缺陷性未分化肾细胞癌,非特殊型及SMARCB1缺陷性去分化其他特殊类型肾细胞癌
首先,2022年版分类中乳头状肾细胞癌范围缩小,仅指Ⅰ型乳头状肾细胞癌。该肿瘤以7号及17号染色体三倍体和四倍体、Y染色体的缺失以及MET基因的突变为分子特征;Ⅱ型乳头状肾细胞癌不再视为独立病理类型。2022年版提出延胡索酸水合酶缺陷性肾细胞癌(FH-RCC)即是从Ⅱ型乳头状肾细胞癌分出的病理类型。该肿瘤以延胡索酸水合酶基因胚系或体细胞突变/失活为特征,涵盖了2016年版中的遗传性平滑肌瘤病肾细胞癌综合征相关性肾细胞癌(HLRCC)亚型,多呈激进性临床经过。此外,2022年版还提出了其他的类似Ⅱ型乳头状结构的肾细胞性肿瘤的建议分类,包括极向反转性乳头状肾肿瘤、双相型鳞样腺泡状肾细胞癌、双相型透明砂粒体肾细胞癌、Warthin样乳头状肾细胞癌4类。这些建议分类均有特征性的基因改变,但因对其生物学行为所知较少,故暂未列入独立类型[9]。
其次,2022年版分类中未分类肾细胞癌重新命名为非特殊型肾细胞癌。此类肿瘤是指形态特征不能归入任何一种已知肾细胞癌亚型。这一改变说明肾细胞癌的分类又回归到早期的概念——缺乏特定形态特征的肾细胞癌不再区分亚型[3]。与之前分类不同的是,此类肿瘤既往包含高级别侵袭性肿瘤和低级别惰性肿瘤两大类,在此版中低级别惰性肿瘤由于多具有嗜酸性胞质,归入其他嗜酸性肿瘤。所以,2022年版中非特殊型肾细胞癌仅包括高级别高度侵袭性肾肿瘤的类型,如肉瘤样癌亚型等。相信随着分子病理学的进展,我们对于此类肿瘤的认识也会越深刻,其所占比重也会逐渐降低。
再次,以分子特征定义的癌作为一种独立分类亚型,对肾肿瘤分类也产生了不小的影响:将之前的MiT家族易位肾细胞癌分成TFE3易位性肾细胞癌以及TFEB改变性肾细胞癌两个独立类型;肾髓质癌更名为SMARCB1缺陷性肾髓质癌;延胡索酸水合酶胚系或体细胞突变或失活为特征的肾细胞癌重新命名为FH-RCC,这一分类包括之前的HLRCC。
此外,在2022年版中新增4类病理亚型。2022年版在嗜酸-嫌色细胞性肿瘤谱系中新增"其他嗜酸性肿瘤"这一病理类型。该肿瘤是指形态介于嗜酸细胞瘤和嫌色细胞癌之间,且不能归入诸如FH-RCC、琥珀酸脱氢酶缺陷性肾细胞癌(SDH-RCC)、嗜酸性实性及囊性肾细胞癌等已知嗜酸性胞质为特征的病理亚型,很好解决了之前因形态不典型引起的诊断分歧大的问题。目前认为此类肿瘤可能包含多个病理亚型,部分肿瘤存在mTOR通路基因突变,且多呈惰性临床经过。相信在后续的版本中,此肿瘤能分出更多的病理类型。其他新增的病理类型还包括ELOC(之前为TECB1)突变型肾细胞癌、ALK重排型肾细胞癌、嗜酸性实性及囊性肾细胞癌等。此4类肿瘤的出现彰显分子病理学在病理分型中的作用,更为全面地展现了肾肿瘤的特征。透明细胞乳头状肾细胞癌因累积数据显示预后良好,在新版分类中更名为透明细胞乳头状肾细胞肿瘤,归入交界性肿瘤范畴。
研究表明,肿瘤细胞存在与正常细胞不同的分子特征,包括染色体缺失或获得、微卫星不稳定性、基因组变异如拷贝数变化,以及基因突变如小片段(<50 bps)插入、缺失和大片段的结构变异[10]。在肾细胞癌中,基因突变是最为重要的分子特征,如位于3号染色体短臂的VHL基因突变在此版中列为透明细胞癌的期待诊断标准之一[11]。而嗜酸性实性和囊性肾细胞癌均可携带TSC/mTOR通路基因突变[12]。需要强调的是,现行的分类标准仍主要依据组织形态学特征,必要时应用分子检测技术辅助肾细胞癌的进一步分类。现以2022年版中新增病理亚型说明分子特征在肾细胞癌中的诊断作用。
Sato等[13]在2013年首次报道了ELOC突变型肾细胞癌。迄今为止,已有21例ELOC(TCEB1)突变型肾细胞癌被报道。此类肿瘤与上一版建议分类中的伴有血管平滑肌瘤样间质的肾细胞癌有一定相关性,临床以老年男性为多见,多因影像学检查偶然发现而就诊,经完整切除后患者可长期生存。
此类肿瘤均位于肾皮质,与周围正常肾组织边界清楚,直径2.0~3.5 cm,可伴有不同程度的囊性变。镜下以分支管状及乳头状结构、丰富的透明胞质、清晰的细胞边界以及间质纤维肌束为特征。因此,在缺乏免疫组织化学及分子检测条件下,此类肿瘤易诊断为透明细胞癌伴有突出的纤维肌性分隔。
ELOC(TCEB1)-RCC免疫表型多呈弥漫性CK7、CA9、CD10阳性,而分子特征表现为ELOC基因突变,为诊断的必要条件。Y79C/S/F/N或A100P是已经报道的ELOC点突变位点,且无VHL基因突变和3p缺失,也无PBRM1、SETD2或BAP1功能的改变,这一点明显不同于透明细胞癌,支持其为一种独立的病理类型。ELOC(TCEB1)突变导致的延长C蛋白缺失会影响VHL复合体的缺氧诱导因子(HIF)结合位点,从而阻止后者的泛素化和降解,导致肿瘤发生。因此,ELOC基因突变有可能成为未来此类肿瘤靶向治疗的靶基因之一。
Debelenko等[19]于2011年首次报道了ALK基因重排的RCC。该肿瘤最早作为建议分类类型进入2016年版分类,在2022年版中被列为正式分类。此类肿瘤患者年龄3~85岁,不同性别的发病无明显差异。伴有ALK-VCL易位的病例常具有镰状细胞性贫血,见于非裔美国人;而非ALK-VCL易位的病例则多见于东亚人群。临床经过呈高度异质性,既可带瘤或无病生存,也可因肿瘤死亡。这一肿瘤可能对ALK抑制剂敏感。
此类肿瘤通常体积较大,最大者长径可达14 cm,多位于肾髓质或贯穿皮髓质。肿瘤呈灰棕或灰白色,可见出血、囊性变。镜下表现具有多样性,包括乳头状结构伴有丰富的透明至轻度嗜酸性胞质,类似于乳头状肾细胞癌;或紧密排列的小腺泡、分支小管状,细胞大小较一致,类似于后肾腺瘤;或呈实性筛状生长方式,多角形、梭形细胞伴有丰富的嗜酸性胞质或横纹肌样特征,胞质空泡化,间质黏液样变及淋巴细胞浸润,类似于肾髓质癌。
ALK重排型肾细胞癌最重要的分子特征是ALK基因与伙伴基因融合,为必要诊断条件,而镰状细胞性贫血则作为期待诊断条件。ALK基因重排的融合伙伴有很多,其中比例较高的包括TPM3(30.77%)、EML4(26.92%)、VCL(15.38%)、STRN(15.38%)、HOOK1(3.8%)、PLEKHA7(3.8%)基因等。近来CLIP1、KIF5B和KIAA1217等更多的融合伙伴被发现。相信在未来,ALK抑制剂的靶向治疗将在此亚型肿瘤的临床治疗中起到重要作用。ALK重排性肾细胞癌免疫表型以ALK蛋白在肿瘤细胞胞质中弥散性表达为特征,同时保留琥珀酸脱氢酶复合体B亚基(SDHB)、FH表达。而ALK重排类型对于免疫表型有一定影响,不同的融合基因可能表达不同的免疫表型。
嗜酸性实性及囊性肾细胞癌多发生在女性,部分患者有结节性硬化病史。患者年龄跨度较大,为14~79岁,多为单发肿瘤,无侧别差异。临床多为惰性。此类肿瘤呈棕黄色外观,长径多<5 cm,呈囊实性或实性外观,无包膜,边界清楚。镜下以囊实性结构、嗜酸性胞质伴嗜碱点彩为特征。
嗜酸性实性及囊性肾细胞癌免疫表型以CK20散在或弥漫阳性为特征,而CK7呈阴性或局灶阳性表达;SDHB呈阳性表达,而CD117呈阴性表达。关于此肿瘤的分子特征研究较多,可见16p13-16q23、7p21-7q36、13q14和19p12拷贝数增加、Xp11.21及22q11拷贝数丢失,以及16p11.2-11.1、Xq11-13、Xq13-21、11p11、9q21-22和9q33位点杂合度缺失(33%)。上述区域的许多基因参与调控mTOR信号通路,这与目前公认的其他肾肿瘤存在明显差异。因此其上游信号TSC1/2突变与CK20免疫组织化学一起被列为此肿瘤的期待诊断标准。
2022年版WHO肾肿瘤病理分类标准中分子遗传学的作用凸显,分子特征成为定义肾细胞癌亚型的诊断依据之一。这一变化既体现了肾肿瘤形态学改变背后的分子基础,又显示了WHO分类正在尝试从传统的以组织形态为基础的分类体系转变为涵盖形态、免疫表型和基因特征的整合分类体系,并反映了相应肿瘤的临床生物学行为。此版分类要求病理科从流程管理的角度重视标本前处理、规范化取材,确保分子病理检测的准确性。而病理医师、临床医师则需对此版肾肿瘤分类中分子病理的内容深入学习和理解。相信在不远的将来,肾肿瘤的靶向治疗和免疫治疗分子筛选可能会成为临床治疗前的常规工作。当然,此版分类的缺陷在于,目前对于肾肿瘤分子病理学特征的认识仍停留在病理诊断水平,缺乏基因改变与肿瘤预后、治疗敏感性之间关系的数据。这也将成为临床医师和病理医师今后共同的重点工作方向之一。相信在今后的WHO分类中,我们将能获得分子病理学在肿瘤预后预测和治疗方案筛选方面的信息,更好地为临床诊疗服务。
感谢中国医学科学院肿瘤医院医务处田宛鑫医生、中国医学科学院肿瘤医院病理科赵祖璇医生对本文撰写所提供的帮助
所有作者均声明不存在利益冲突



























