
分析CCAAT/增强子结合蛋白α(CEBPA)基因突变急性髓系白血病(AML)患者临床特征及预后。
回顾分析208例初诊AML患者CEBPA基因突变发生率、临床特征、治疗效果及预后。
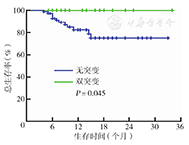
208患者中,CEBPA突变患者37例(17.8 %),其中29例为双突变,8例为单突变。117例正常核型患者中CEBPA突变28例(23.9 %)。CEBPA双突变患者具有以下临床特征:初诊时年龄小,大部分(82.8 %,24/29)患者为M1型与M2型,初诊时表现为外周血白细胞数高、血红蛋白水平高、血小板数低,白血病细胞高表达CD7、CD34及HLA-DR。CEBPA双突变患者总生存率优于无突变者(2年总生存率:100%比75.1 %,P=0.045)。
CEBPA双突变为AML预后良好标志之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(acute myeloid leukemia, AML)是一组起源于造血干细胞的恶性克隆性疾病,具有高度异质性。由基因突变导致的细胞增殖、分化和细胞凋亡途径的改变是AML的发病基础。CCAAT/增强子结合蛋白α(CCAAT/enhancer binding protein α ,CEBPA)在造血系统中只表达于髓系细胞,其基因定位于染色体19q13.1 ,cDNA全长2 385 bp,是维持造血系统粒系分化的重要转录因子,在调节细胞增殖与分化中发挥重要作用[1]。5 %~14%的AML患者发生CEBPA基因突变,常见于核型正常者及FAB分型中的M1与M2亚型[2,3]。CEBPA基因突变的AML患者往往表现为血红蛋白水平高、血小板数低、外周血白细胞数高的特点[4,5,6]。CEBPA包含两种主要的突变类型:(1)N-端的移码突变,它导致CEBPA P42蛋白被缩短,但是保留了对于野生型CEBPA P42蛋白具有负调控作用的CEBPA P30蛋白;(2)C-端的编码框内插入或者缺失数个碱基,破坏了与DNA结合相关的锌指结构域,从而影响CEBPA靶向基因如CSF3R的结合,并且降低这些基因的转录活性,最终导致髓系分化受阻[7]。CEBPA基因可发生双突变(同时发生N-端、C-端突变)或单突变。目前研究表明,只有CEBPA基因双突变患者才具有良好的预后,而单突变与无突变患者预后大致相当[8,9]。CEBPA突变患者趋向有更高的完全缓解(CR)率,总生存(OS)率及无复发生存(RFS)率均明显优于无突变者[10]。既往对我中心正常核型AML CEBPA基因突变患者临床特征及疗效进行了分析。本研究进一步回顾性分析我中心初治AML患者资料,评价CEBPA突变患者临床特征、近期疗效及预后。
回顾分析吉林大学第一医院肿瘤中心2011年8月至2014年8月初治AML患者208例,其中男106例,女102例,中位年龄47.5岁(7~ 80岁)。所有患者经细胞形态学、免疫学、细胞遗传学和分子生物学(MICM)确诊。诊断标准依据世界卫生组织2008年分型标准。按FAB分型:M1 6例(2.9%),M2 111例(53.4%),M4 49例(23.6 %),M5 36例(17.3 %),M6 6例(2.9%);不包括AML-M3患者。
收集患者年龄、性别、外周血白细胞、血红蛋白、血小板、骨髓原始细胞比例等临床资料。
诱导治疗:初诊患者经DA(柔红霉素45~ 60 mg/m2,第1天至第3天;阿糖胞苷100 mg/m2,第1天至第7天)、IA(去甲氧柔红霉素8~ 12 mg/m2,第1天至第3天;阿糖胞苷100 mg/m2,第1天至第7天)、地西他滨桥接CAG(地西他滨20 mg/m2,第1天至第5天;阿糖胞苷10 mg/m2,每12 h,第1天至第5天;阿柔比星20 mg,第1、3、5天,粒细胞集落刺激因子300 μg,第0天至白细胞数>2×109/L时)方案诱导治疗,治疗间歇期14 d、21~ 28 d行骨髓穿刺,评价疗效。缓解后治疗:(1)大剂量阿糖胞苷(2.0~ 2.5 g/m2,每12 h,第1、3、5天)巩固治疗3~ 4个疗程,DA、MA方案维持治疗3~ 4个疗程。(2)异基因或自体造血干细胞移植。随访:自疾病初诊时至患者死亡、失访或研究终止。
采用SPSS 17.0软件进行统计学分析。计数资料采用率表示,组间比较采用χ2检验或Fisher确切概率法。计量资料符合正态分布者以均数±标准差表示,非正态分布者用中位数表示,两组比较采用独立样本t检验或Mann-Whitney非参数检验,三组及以上比较采用方差分析或Kruskal-Willistest非参数检验。采用Kaplan-Meier法计算生存率,log秩和检验对生存曲线进行比较。P<0.05认为差异有统计学意义。
208例初诊患者中,CEBPA突变37例,发生率为17.8%,其中29例(13.9 %)为双突变,8例(3.9 %)为单突变。182例患者成功分析核型:117例正常核型中CEBPA突变28例(23.9%),其中单突变6例(5.1 %),双突变22例(18.8 %);65例异常核型中CEBPA突变2例(3.1 %),单突变与双突变各1例(1.5 %)。
NPM1和FLT3-ITD突变发生率分别为18.5 %(37/200)与14.0 %(28/200)。29例CEBPA双突变者中NPM1、FLT3-ITD突变发生率分别为6.9 %(2/29)与3.4 %(1/29);171例CEBPA无突变者中NPM1、FLT3-ITD突变发生率分别为20.5 %(35/171)与15.8 %(27/171)。
CEBPA双突变与无突变患者临床特征见表1。29例CEBPA双突变患者中,24例(82.8 %)为M1与M2型。CEBPA双突变患者与无突变患者相比,初诊时年龄小、外周血白细胞数高、血红蛋白水平高、血小板数低、正常核型多见、免疫表型CD7、CD34及HLA-DR表达高,差异均有统计学意义(均P< 0.05)。但是在性别、骨髓原始细胞比例、免疫表型CD15表达及伴有NPM1、FLT3-ITD基因突变方面,二者差异均无统计学意义(均P>0.05)。
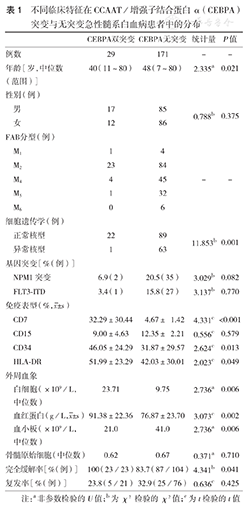
不同临床特征在CCAAT/增强子结合蛋白α(CEBPA)突变与无突变急性髓系白血病患者中的分布
不同临床特征在CCAAT/增强子结合蛋白α(CEBPA)突变与无突变急性髓系白血病患者中的分布
| CEBPA双突变 | CEBPA无突变 | 统计量 | P值 | ||
|---|---|---|---|---|---|
| 例数 | 29 | 171 | - | - | |
| 年龄[岁,中位数(范围)] | 40(11~80) | 48(7~80) | 2.335a | 0.021 | |
| 性别(例) | |||||
| 男 | 17 | 85 | 0.788b | 0.375 | |
| 女 | 12 | 86 | |||
| FAB分型(例) | |||||
| M1 | 1 | 4 | |||
| M2 | 23 | 84 | |||
| M4 | 4 | 45 | - | - | |
| M5 | 1 | 32 | |||
| M6 | 0 | 6 | |||
| 细胞遗传学(例) | |||||
| 正常核型 | 22 | 89 | 11.853b | 0.001 | |
| 异常核型 | 1 | 63 | |||
| 基因突变[%(例)] | |||||
| NPM1突变 | 6.9(2) | 20.5(35) | 3.029b | 0.082 | |
| FLT3-ITD | 3.4(1) | 15.8(27) | 3.137b | 0.770 | |
免疫表型(%, ±s) ±s) | |||||
| CD7 | 32.29±30.44 | 4.67± 1.42 | 4.331c | <0.001 | |
| CD15 | 9.00±4.63 | 12.35± 2.21 | 0.556c | 0.579 | |
| CD34 | 46.05±24.29 | 31.87±29.57 | 2.624c | 0.013 | |
| HLA-DR | 51.99±23.29 | 42.03±30.01 | 2.023c | 0.049 | |
| 外周血象 | |||||
| 白细胞(×109/L,中位数) | 23.71 | 9.75 | 2.736a | 0.006 | |
血红蛋白(g/L, ±s) ±s) | 91.38±22.36 | 76.87±23.70 | 3.073c | 0.002 | |
| 血小板(×109/L,中位数) | 21.0 | 41.0 | 2.736a | 0.006 | |
| 骨髓原始细胞(中位数) | 0.62 | 0.67 | 0.371a | 0.710 | |
| 完全缓解率[%(例)] | 100(23/23) | 83.7(87/104) | 4.341b | 0.041 | |
| 复发率[%(例)] | 23.8(5/21) | 32.9(25/76) | 0.636c | 0.425 | |
注:a非参数检验的U值;bχ2检验的χ2值;c为t检验的t值
160例患者接受诱导治疗,其中,DA方案74例(46.3%),IA方案65例(40.6 %),其他方案21例(13.1 %)。治疗后可评价病例127例,经过1~ 2个疗程诱导治疗,110例患者获CR(86.7 %)。其中,23例CEBPA双突变者均达CR, CR率为100 %,104例无突变者中87例达CR(83.7 %),双突变患者CR率优于无突变者(P=0.041)。
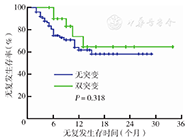
将至少接受1个大剂量阿糖胞苷巩固的患者纳入生存分析,共97例。大剂量阿糖胞苷85例;异基因移植11例,其中2例为CEBPA双突变复发患者,9例为无突变者;自体移植1例为CEBPA双突变者。随访时间2~ 34个月,中位随访时间10个月。97例CR患者中30例复发,复发率为30.9 %。CEBPA双突变者复发率为23.8 %(5/21),低于无突变者的32.9 %(25/76),但差异无统计学意义(P=0.425)。12例患者死亡,均为CEBPA无突变者。CEBPA双突变复发者无一例死亡,经再诱导治疗获得CR,其中2例行异基因移植。CEBPA双突变患者无复发生存率趋向优于无突变者,但差异无统计学意义(2年RFS率:64.6 %比58.2 %,P=0.318)(图1)。CEBPA双突变患者总生存率优于无突变者(2年OS率:100%比75.1 %,P=0.045)(图2)。


染色体核型是AML主要的预后判断指标,但50%以上AML患者初诊时染色体核型正常。基因突变已纳入新的预后分层体系,特别是FLT3-ITD、NPM1和CEBPA突变,已成为AML重要的预后参考指标。2013年美国国立综合癌症网(NCCN)已将CEBPA作为一个预后良好的遗传标志用于正常核型AML患者的预后分层[14]。
本研究中CEBPA突变率为17.8 %,略高于国外报道的6%~15 %[4, 15,16],CEBPA双突变发生率为13.9 %。正常核型患者CEBPA突变率为23.9 %,与国内报道一致(18.2 %~ 26 %)[17,18,19],高于国外报道的8 %~18 %[1, 11, 20,21]。
研究发现AML患者中CEBPA突变多发生于FAB分型的M1与M2型[11,12],本研究中82.8%的CEBPA双突变者为M1与M2,提示CEBPA对中间阶段粒细胞分化具有至关重要的作用。本研究发现CEBPA双突变患者初诊时年龄小于无突变者,与国外研究报道一致[12, 22]。Green等[12]报道NPM1、FLT3-ITD基因突变在CEBPA双突变者中的发生率(3%与12%)均低于无突变者(39%与26%),我们的研究同样发现这一趋向,但差异无统计学意义(P>0.05)。有文献报道CEBPA基因突变的AML患者往往具有血红蛋白水平高、血小板数低、外周血白细胞数高的特点[4,5,6],本研究同样发现,与无CEBPA突变患者相比,CEBPA双突变患者初诊时外周血白细胞数高、血红蛋白水平高、血小板数低。本研究及国内外研究结果均表明CEBPA双突变者与无突变者在骨髓原始细胞比例上无差异[22,23],但国内文献[19, ]报道CEBPA突变者骨髓原始细胞比例高于无突变者。另外本研究发现CEBPA双突变者白血病细胞CD7、CD34及HLA-DR表达水平均高于无突变患者,有研究报道CEBPA突变患者CD7、CD15、CD34及HLA⁃DR阳性率(≥20 %细胞表达作为阳性阈值)明显升高[16]。CD34在CEBPA突变患者中的表达存在争议,德国一项研究表明突变患者低表达CD34[11],而另一项研究结果却与此相反[20],但德国这两项研究纳入的均为正常核型患者。目前关于CEBPA突变患者免疫表型的研究尚不足,需更进一步研究。
本研究结果表明CEBPA双突变患者CR率优于无突变者,与国外报道一致[8, 17, 21]。Pastore等[9]研究报道显示CEBPA双突变者1年内复发率(33%)低于单突变者(63%),在本研究中双突变者与无突变者之间我们同样看到这一趋向,但差异无统计学意义(P>0.05),双突变者复发率低于国外报道,可能与我们的随访时间短有关。国外研究报道CEBPA双突变患者RFS优于无突变者[8,9, 12],Green等[12]研究报道双突变及无突变者RFS分别为45%与34 %,我们的研究同样发现这一趋向,但差异无统计学意义(P>0.05),可能与我们的样本数少及随访时间短有关。本研究及国外研究报道均表明CEBPA双突变患者OS均优于无突变者[8,9, 12],Pastore等[9]报道年龄>60岁者中,双突变及无突变者5年OS率分别为37%与11 %,10年OS率分别为20%与5%,年龄<60岁者中,双突变及无突变者5年及10年OS率分别为81%与5%。此外,具有CEBPA突变的AML患者的预后还与存在的其他基因突变有关。CEBPA单突变者与无突变者合并NPM1基因突变时,可获得与CEBPA双突变者相近的较好预后;相反,若存在FLT3-ITD突变,则可能会影响CEBPA双突变者的良好预后[9, 12, 16, 21, 24]。本组患者CEBPA单突变者及双突变同时伴有NPM1、FLT3-ITD突变者病例数较少,未进一步进行预后分层分析。
综上,本研究结果提示我国CEBPA突变率可能略高于国外,CEBPA双突变常见于正常核型,形态学上多表现为M1、M2型,初诊时更年轻、外周血白细胞数高、血红蛋白水平高、血小板数低,白血病细胞高表达CD7、CD34及HLA-DR。双突变患者CR及OS均优于无突变患者。



























