
研究成年人急性髓系白血病(AML)细胞免疫表型特征及其临床意义。
采用流式细胞术分析148例初诊AML患者白血病细胞的免疫表型,并评价其经过标准化疗方案治疗后的效果。
148例AML患者流式细胞术检测结果与FAB诊断相符者138例,符合率为93.24%。148例患者中,急性混合型白血病8例,AML 140例。140例AML患者中,最多见表达的抗原为CD38、CD13、CD33,其他表达由高到低依次为HLA-DR、CD64、CD34、CD11b、CD56、CD14。伴淋系抗原表达的AML患者占49.29 %,其中CD7、CD19为最常见表达淋系抗原。可评价治疗效果的92例AML患者中,CD7+患者的完全缓解率低于CD7-患者,两者差异有统计学意义(P<0.05);CD19+患者的完全缓解率高于CD19-患者,两者差异有统计学意义(P<0.05)。92例AML患者中,Ly+患者完全缓解率(46.81 %)低于Ly-患者(68.89 %),两者差异有统计学意义(P >0.05)。
白血病免疫表型的检测不仅可提高AML诊断的准确性,对于疾病的预后判断亦有一定的指导意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫分型是当今判断细胞来源、分化阶段的主要手段,和流式细胞术(FCM)联合运用后,提升了对肿瘤细胞鉴别的精确性、完整性,是临床上对白血病诊断、治疗、预后判断的重要手段。为分析急性髓系白血病(AML)免疫表型特征与疾病临床特点、疗效及预后的相关性,我们对148例AML确诊患者进行了免疫表型检测,并探讨了不同免疫表型特征AML患者的临床预后差异,现将结果报道如下。
148例初诊AML骨髓标本均取自我院血液内科自2007年1月至2011年10月住院患者。按FAB对于AML的诊断分型标准:AML 140例(M1 7例,M2 32例,M3 28例,M4 36例,M5 33例,M6 4例);通过对细胞形态、免疫组织化学染色和免疫表型特征的检测,有8例患者被诊断为急性混合细胞白血病(MAL)。所有患者中,男性86例,女性62例;年龄19~ 81岁,中位年龄42岁,所有患者均无严重心、肺、脑、肝、肾等重要脏器功能障碍及其他血液系统疾病等。
诱导缓解化疗方案:AML (M3除外)采用DA(柔红霉素、阿糖胞苷)或IA(去甲氧柔红霉素、阿糖胞苷)方案,M3采用全反式维甲酸或三氧化二砷联合化疗方案;MAL采用TOAP(表柔比星、阿糖胞苷、泼尼松、长春地辛)、DOLP(多柔比星、长春新碱、左旋门冬酰胺酶、地塞米松)方案。
采用美国BD公司生产的FACSCantoⅡ流式细胞仪(480 nm氩离子为激发光源),荧光抗体荧光素为美国BD公司的异硫氰酸荧光素(FITC)、红蛋白(PE)、多甲藻叶绿素蛋白(PerCP)。所检测髓系抗原有CD13、CD14、CD15、CD33、CD64;T淋巴细胞系抗原有CD3、CD2、CD4、CD7;B淋巴细胞系抗原有CD79a、CD10、CD19、CD20;其他有CD34、CD56、HLA-DR、CD11b等非特异系列抗原。
征得患者同意,抽取1~ 2 ml患者肝素抗凝骨髓液后,每个试管中分别加入50 μl肝素抗凝骨髓液、各20 μl三色直接标记的荧光抗体,于室温下避光培养20 min左右,经Q-Prep处理后,用磷酸盐缓冲液(PBS)洗涤2次,弃上清液,加入15 ml PBS后,即可上流式细胞仪待检。阳性结果判断标准:白血病细胞表面抗原表达≥20%。AML免疫学分型标准参照文献[1],急性双系列(或双表型)白血病的免疫诊断标准参照欧洲白血病免疫分类积分系统(EGIL)。免疫分型诊断AML,淋系抗原表达阳性,但又不符合MAL诊断标准者,称为表达淋系抗原的AML(LY+ AML),不伴淋系抗原表达者为LY- AML。
采用SPSS 17.0软件进行统计学处理,率的比较采用χ2检验,以P<0.05为差异具有统计学意义。
本组140例患者中,通过细胞形态学检查不能确诊者2例,使用FCM检测,依据其细胞胞膜或胞质抗原表达情况,诊断1例M1,1例M5。8例细胞形态学特征酷似AML的患者,通过白血病免疫表型检测后,确诊为MAL。故本研究中,有138例患者免疫学分型与FAB分类相符,符合率系93.24 %。
本组140例AML患者中,6个亚型中M4发病率最高,占25.71 %,其次为M5 23.57 %,M2 22.86 %,M3 20.00 %,M1 5.00 %,M6 2.86 %。各种髓系抗原表达从高到低依次是CD13(77.14 %)、CD33(75.00 %)、CD64(70.00 %)、CD11b(55.71 %)、CD56(22.86 %)、CD14(8.11 %)。干祖细胞胞膜抗原表达率:CD38 90.00 %、HLA-DR 75.00 %、CD34 59.29 %;69例(49.29 %)AML患者伴淋系抗原交叉表达,分别为CD7(30.71 %)、CD19(8.57 %)、CD4(6.43 %)、CD2(3.57 %)。各亚型AML均较高表达CD13、CD33、CD38;CD14、CD64在M4、M5亚型中的表达率高于其他亚型;CD11b在M5中表达最高;CD56可见于M1~M6各个亚型中,M3阳性率较高;CD34和HAL-DR在MAL和M1表达明显高于其他亚型AML;HLA-DR、CD34在M3患者中的表达率最低,而CD13、CD33表达率较高,可见CD2、CD56的表达(表1)。
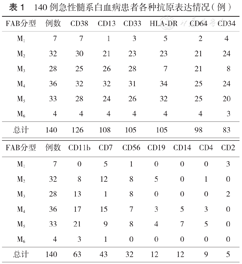
140例急性髓系白血病患者各种抗原表达情况(例)
140例急性髓系白血病患者各种抗原表达情况(例)
| FAB分型 | 例数 | CD38 | CD13 | CD33 | HLA-DR | CD64 | CD34 |
|---|---|---|---|---|---|---|---|
| M1 | 7 | 7 | 1 | 3 | 5 | 2 | 4 |
| M2 | 32 | 30 | 21 | 23 | 23 | 21 | 24 |
| M3 | 28 | 25 | 26 | 28 | 7 | 21 | 8 |
| M4 | 36 | 32 | 32 | 31 | 34 | 25 | 24 |
| M5 | 33 | 28 | 24 | 26 | 32 | 25 | 20 |
| M6 | 4 | 4 | 4 | 4 | 4 | 4 | 3 |
| 总计 | 140 | 126 | 108 | 105 | 105 | 98 | 83 |
| FAB分型 | 例数 | CD11b | CD7 | CD56 | CD19 | CD14 | CD4 | CD2 |
|---|---|---|---|---|---|---|---|---|
| M1 | 7 | 0 | 5 | 1 | 0 | 0 | 0 | 3 |
| M2 | 32 | 8 | 12 | 8 | 5 | 0 | 1 | 0 |
| M3 | 28 | 13 | 1 | 8 | 0 | 0 | 0 | 2 |
| M4 | 36 | 17 | 15 | 7 | 3 | 5 | 3 | 0 |
| M5 | 33 | 21 | 9 | 8 | 4 | 7 | 5 | 0 |
| M6 | 4 | 3 | 1 | 0 | 0 | 0 | 0 | 0 |
| 总计 | 140 | 63 | 43 | 32 | 12 | 12 | 9 | 5 |
本组148例中,检出8例MAL,占5.4 %,其中髓系、B系(M/B)混合7例,表达CD13、CD33、CD64、CD79a、CD19、CD34;B系、T系(M/T)混合1例,表达CD4、CD7、CD20、CD79a、CD19。
可观察疗效的92例AML患者中,总缓解率为56.84 %(54/95)。CD7+患者CR率(39.28 %)低于CD7-患者(65.63 %),CD19+患者CR率(91.67 %)高于CD19-患者(52.50 %),Ly+患者CR率(46.81 %)高于Ly-患者(68.89 %),差异均有统计学意义(表2)。
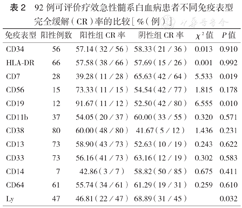
92例可评价疗效急性髓系白血病患者不同免疫表型完全缓解(CR)率的比较[%(例)]
92例可评价疗效急性髓系白血病患者不同免疫表型完全缓解(CR)率的比较[%(例)]
| 免疫表型 | 阳性例数 | 阳性组CR率 | 阴性组CR率 | χ2值 | P值 |
|---|---|---|---|---|---|
| CD34 | 56 | 57.14(32/56) | 58.33(21/36) | 0.013 | 0.910 |
| HLA-DR | 66 | 57.58(38/66) | 57.69(15/26) | 0.001 | 0.992 |
| CD7 | 28 | 39.28(11/28) | 65.63(42/64) | 5.533 | 0.019 |
| CD56 | 15 | 73.33(11/15) | 54.54(42/77) | 1.815 | 0.178 |
| CD19 | 12 | 91.67(11/12) | 52.50(42/80) | 6.555 | 0.010 |
| CD11b | 37 | 54.05(20/37) | 60.00(33/55) | 0.320 | 0.571 |
| CD38 | 80 | 60.00(48/80) | 41.67(5/12) | 1.436 | 0.231 |
| CD13 | 73 | 58.90(43/73) | 52.63(10/19) | 0.243 | 0.622 |
| CD33 | 73 | 56.16(41/73) | 63.16(12/19) | 0.302 | 0.583 |
| CD14 | 7 | 42.86(3/7) | 58.82(50/85) | 0.675 | 0.411 |
| CD64 | 61 | 55.74(34/61) | 61.29(19/31) | 0.259 | 0.610 |
| Ly | 47 | 46.81(22/47) | 68.89(31/45) | 0.032 |
AL是一组异质性恶性克隆性疾病,为造血干细胞或祖细胞突变引起的造血系统恶性肿瘤,确切的诊断分型是治疗、预后判断的重要前提。FAB分类以细胞形态学为主,是国际上较统一的诊断AL的原始分型方法,但并不完善,尤其对于未分化型白血病、混合型白血病、形态学不典型白血病的诊断具有局限性。处于不同分化阶段、系列的白血病细胞表达不同抗原,使用单克隆抗体可对其进行相关检测。近年来,随着单克隆抗体的不断发现,尤其与FCM联合应用以来,集合了单克隆抗体高度特异性和FCM高度灵敏性的优势,明显提升了AL诊断准确率,尤其是M0、M6、M7等。本组中通过细胞形态学检查不能确诊的2例患者,使用FCM检测,依据其细胞胞膜或胞质抗原表达情况,诊断1例M1,1例M5。8例细胞形态学特征酷似AML的患者,通过白血病免疫表型检测后,明确诊断为MAL。
在本研究中,应用FCM对AL细胞胞膜及胞质所表达抗原进行检测。FCM白血病免疫学分型是利用荧光素标记的单克隆抗体(McAb)对白血病细胞的胞膜及胞质抗原进行检测,以明确被检测白血病细胞所属细胞系列及其分化程度。目前国际上通用的是CD45/侧向角(SSC)双参数设门法。CD45为白细胞共表达抗原,表达量从高到低依次是淋巴细胞、单核细胞、成熟粒细胞、早期造血细胞,而红细胞(中、晚幼红细胞,成熟红细胞)不表达CD45. SSC反映细胞的颗粒性,其表达量从高到低依次是成熟粒细胞、单核细胞、淋巴细胞、原幼细胞、红细胞。该方法联合免疫荧光标记技术,可容易辨别出异常细胞群。
本组140例AML患者中,最常见表达的髓系抗原是CD33(77.14 %)和CD13(75.00 %),二者均为重要的髓系抗原,对于判断白血病细胞是否为髓系来源占很重要的地位,是鉴别ALL和AML的关键标志。其余抗原标记阳性率由高至低依次为CD64、CD11b、CD56、CD14。CD14、CD64均为单核细胞相关抗原,在M4、M5中高表达,有助于前二者与其他类型白血病的区别。CD56是NK细胞表面标记抗原,在正常髓系细胞不表达,但AL骨髓细胞发生恶性变,细胞表面抗原表达发生异常,其中一种为跨系抗原在髓系细胞表达,是AML一种特征性表型。CD56在AML中的表达率各家报道不一,多数报道在16 %~22%之间,可表达于各型AML,常见于M2、M3、M4、M5、M7。本组有32例CD56+ AML,其中M1 1例、M2 8例、M3 3例、M4 7例、M5 8例。在140例AML中,55.71%的AML患者CD11b+,与兰志建等[2]报道的相似,其报道的CD11b在ALL中的阳性率仅为11.18 %,两者差异有统计学意义。故认为CD11b表达与否可帮助鉴别髓系和淋系白血病。另外,CD11b亦较高表达于急性粒单、急性单核细胞白血病(M4、M5)患者,与其他髓系白血病(M1、M2、M3)表达的阳性率差异较大。因此,CD11b可能有助于M4、M5与M1、M2、M3的区分。
CD34和HLA-DR为非系列特异性抗原,是幼稚阶段细胞抗原标志,故有助于判断白血病细胞的分化发育阶段。多数情况下,原始细胞表达CD34、HLA-DR,而分化较成熟的AML分型,尤其是M3,往往较低表达甚至不表达CD34、HLA-DR,故有助于鉴别诊断。干/祖细胞相关抗原CD38、HLA-DR、CD34在本组140例AML患者中的表达率分别为90.00 %、75.00 %、59.29 %,而M3亚型HLA-DR、CD34表达阳性率分别为28.57%及25.00 %,高于多数文献报道结果,但未见HLA-DR、CD34均阳性M3患者,因此,如CD34和HLA-DR表达低下,尤其非双阳性患者应考虑M3的诊断。
本组数据显示,CD7、CD19、CD2、CD4等淋系抗原表达于AML中,尤其M2、M4、M5亚型较常见,与文献[3]报道一致。
有些学者认为,在AL中免疫表型特征与治疗反应具有良好相关性,但也有部分学者提出免疫表型的表达与预后无明显相关性。本组中,92例可观察疗效的AML患者,非淋系抗原CD33、CD13、CD56、CD14、CD11b、CD64等是否表达与缓解率无相关性,该结果与后者意见相符(表2)。因此,本研究认为,单一非淋系相关抗原的表达作为AML患者预后指标的评价仍有待探讨,综合分析白血病发病时是否高白、是否细胞遗传学异常以及是否伴随其他抗原异常交叉表达则更具判断意义。
AML患者常见表达CD38、CD34和HLA-DR等干细胞相关性抗原,其表达阳性率对评估白血病患者的疗效及预后有一定的指导意义。近年有报道CD34和HLA-DR表达越高,AML的CR率越低、CR时间越短。但该组资料显示不同亚型白血病中CD34、HLA-DR的表达与其CR率无相关性[4]。本研究可判断疗效的AML患者中,CD34、HLA-DR阳性组CR率虽然低于阴性组,但差异并无统计学意义,考虑和不同治疗方案的选择、病例数偏少、发病时白细胞计数高低不等等因素相关。而CD38在各亚型中均高表达。目前经过许多研究报道,已渐渐肯定CD38系慢性淋巴细胞白血病患者的独立危险因素[5],CD38的表达与否对于AML的预后判断无明确相关性。本研究结果与上述观点一致。
CD11b属于细胞黏附分子整合素,与细胞的黏附与迁移功能有关,其高表达与AML髓外浸润及预后有密切联系。有文献报道CD11b常表达于M5亚型白血病,本研究CD11b在各白血病亚型中的表达与文献报道一致,但CD11b+ AML与CD11b- AML患者CR率差异无统计学意义(P>0.05),可能与病例数偏少有关。
一般认为,淋系抗原表达阳性,但又不符合MAL诊断标准者,即为Ly+ AML。CD7是Ly+ AML中表达阳性率最高的淋系抗原,其对于Ly+ AML在临床特征、治疗效果及预后判断等因素中,各研究结果仍不完全一致[6]。多数学者认为Ly+ AML较Ly- AML对化疗反应差,预后不佳。有文献报道,多数CD7+ AML系M1、M5、M2、M4等细胞分化发育较差的亚型,往往预后亦较差。但也有研究结果提示抗原CD7与AML患者的疗效、预后等没有明确相关性[7]。本组AML患者最常见的淋系抗原表达是CD7,主要见于M1和M4亚型。CD7为T细胞的一个特征性标志,应用于T淋巴细胞白血病的诊断及分型。随着科学研究的不断深入,逐渐发现并不是只有T淋巴细胞特异性表达CD7,某些阶段的造血干细胞也可见该抗原的表达[8]。近来有研究报道,CD7+ AML细胞表达多能造血干细胞的免疫表型,具有类似的生物学特征,并认为这与其有别于其他患者的临床特征、生物学性质及疗效密切相关[9]。关于CD7+ AML的发生率,各家报道不一,多数学者认为在10 %~19%之间,也有报道为31.8%,分析其原因可能与各实验室的检测方法、单抗的选择以及不同人种和判断标准等的不同有关。本研究中CD7+的AML患者疗效较差,其CR率(39.28 %)明显低于CD7-患者(65.63 %),与文献结论相符。但总的来说,现对CD7抗原与AML临床特征、生物学特性、预后等的相关性仍没有定论。
国内学者认为AML伴有CD19抗原表达者预后良好。本组中,CD19+者CR率明显高于CD19-者,与大部分文献报道一致。本组资料显示,Ly+ AML患者CR率明显低于Ly-,因此对成年AML患者而言,伴淋系抗原表达高度提示预后不良的可能性,应针对患者特点制定有针对性的化疗方案。
MAL是一种少见的特殊类型白血病,Killick等[10]认为其可能来源于多能造血干细胞,其发生机制尚不清楚。目前对于MAL患者的大宗数据研究报道仍较少,且意见不一。本研究MAL的发生率仅5.4 %,经过治疗的3例MAL中仅1例取得缓解,与其他类型患者的CR率差异无统计学意义,有待大样本研究报道并进一步明确。
通过FCM对AML细胞免疫表型的分析,可大大提高诊断的准确性,对于某些特殊类型白血病的诊断有很大价值。单一非淋系相关抗原的表达与否对于AML患者预后判断的意义仍需进一步探讨。伴淋系相关抗原交叉表达的AML患者疗效较差、预后不良。总之,白血病免疫分型对于AML的诊断和治疗具有较大的临床指导意义。



























