
探讨小剂量(LD)-高三尖杉酯碱+阿糖胞苷(HA)方案诱导治疗急性髓系白血病(AML)(除外M3)的临床效果。
对52例接受LD-HA方案诱导治疗的AML患者资料进行回顾性分析,并依据分子生物学和细胞遗传学危险度分级,观察临床疗效、不良反应,随访长期生存,以同期49例伊达比星+阿糖胞苷(IA)方案治疗患者为对照。
1个疗程后,LD-HA组总有效(OR)率为71.2%(37/52)[完全缓解(CR)率50.0%(26/52),部分缓解(PR)率21.2%(11/52)],IA组OR率为53.1%(26/49)[CR率44.9% (22/49),PR率8.2%(4/49)],两组OR率差异无统计学意义(P= 0.068)。按危险度分层,LD-HA组高危组的OR率高于IA组[100%(11/11)比66.7%(12/18)],差异有统计学意义(P<0.05);LD-HA组和IA组的低危组和中危组OR率差异无统计学意义(P>0.05)。LD-HA组心脏毒性及骨髓抑制均较IA组轻,不适合标准方案的AML患者亦对其耐受良好。
LD-HA方案诱导治疗AML时,高危组OR率高,化疗相关不良反应发生率低,安全性较高。与标准方案相比,LD-HA对于高危AML患者可能更有效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,随着新药的应用,急性髓系白血病(AML)缓解率逐渐提高,但是一些高龄、合并基础疾病的患者不具备应用指南推荐的标准方案的条件。对于这类患者,我们应用低剂量(LD)-高三尖杉酯碱+阿糖胞苷(HA)方案诱导治疗,取得了良好的临床疗效。我们根据分子生物学和细胞遗传学指标将患者分层,应用LD-HA方案和标准伊达比星+阿糖胞苷(IA)方案诱导治疗,观察临床疗效、不良反应及生存情况,现报道如下。
回顾性分析101例2011年4月至2015年3月在我科住院初治的AML患者临床资料。LD-HA组共52例,其中男性28例,女性24例,平均年龄(50.23±2.26)岁。分型:M1 12例,M2 19例,M4 10例,M5 5例,M6 4例,不能分型2例;IA组49例,其中男性23例,女性26例,平均年龄(44.71±1.86)岁。分型:M0 1例,M1 11例,M2 21例,M4 6例,M5 7例,M6 2例,不能分型1例。两组患者均有3例前驱血液病病史。两组患者性别、年龄、亚型比例、初诊外周血血小板计数(Plt)、初诊骨髓中原始细胞比例差异均无统计学意义(均P>0.05),但是与IA组相比,LD-HA组患者的初诊外周血白细胞计数(WBC)较高,血红蛋白(Hb)较低,差异均有统计学意义(均P<0.05)(表1)。其中骨髓中WT1阳性70例,AML1-ETO阳性6例,CBFB-MYH11阳性6例,MLL-AF9阳性2例,CEBPα单突变阳性12例,NPM1突变阳性22例,FLT3-ITD突变阳性14例,FLT3-TKD突变阳性2例,c-kit突变阳性2例,DNMT3A突变阳性4例,JAK2 V617F突变阳性1例,复杂核型5例。所有患者危险度分层参照2015美国国立综合癌症网络(NCCN)指南[1],LD-HA组低危组11例,中危组26例,高危组15例。IA组低危组18例,中危组14例,高危组17例。在随访过程中,失访15例,其余患者有完整的随访资料。
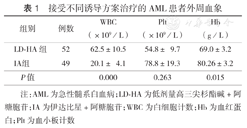
接受不同诱导方案治疗的AML患者外周血象
接受不同诱导方案治疗的AML患者外周血象
| 组别 | 例数 | WBC(×109/L) | Plt(×109/L) | Hb(g/L) |
|---|---|---|---|---|
| LD-HA组 | 52 | 62.5±10.5 | 54.8±9.7 | 69.0±3.2 |
| IA组 | 49 | 20.1±4.1 | 78.8±19.3 | 80.26±3.2 |
| P值 | 0.000 | 0.263 | 0.015 |
注:AML为急性髓系白血病;LD-HA为低剂量高三尖杉酯碱+阿糖胞苷;IA为伊达比星+阿糖胞苷;WBC为白细胞计数;Hb为血红蛋白;Plt为血小板计数
LD-HA方案:高三尖杉酯碱1.0~2.0 mg/d静脉滴注,第1天至第14天;阿糖胞苷20~30 mg/d, 1次/12 h,皮下注射,第1天至第14天。当患者WBC< 0.5×109/L时给予粒细胞集落刺激因子(G-CSF)。IA方案:伊达比星每天6~10 mg/m2,静脉滴注,第1天至第3天;阿糖胞苷100 mg/m2,静脉滴注,第1天至第7天。
初治患者如WBC较高、年龄较大、合并感染较重或者合并心脏疾病,初次诱导方案选择LD-HA方案。缓解后治疗:首次诱导未达完全缓解(CR)者,LD-HA组更换为标准方案(IA、TA或DA方案)再次诱导,IA组按照原方案再次诱导。缓解后治疗主要以IA、TA、HA、DA方案为主,巩固治疗约6~8个疗程,低危组患者包含2~3个疗程中剂量阿糖胞苷化疗,中、高危组患者包含3~4个疗程中剂量阿糖胞苷化疗,部分患者联合大剂量阿糖胞苷治疗。支持治疗:化疗期间给予保肝、保胃、碱化、水化等处理,化疗后Plt<30×109/L时输注血小板;Hb <60 g/L时输注红细胞;当WBC<0.5×10 9/L时,入住层流病房,皮下注射G-CSF,并预防性使用广谱抗生素、预防真菌感染等治疗。
疗效评估分为CR,部分缓解(PR),未缓解(NR),总有效(OR)以CR+PR计算。不良反应包括血液学毒性和非血液学毒性,血液学毒性包括出血症状、化疗过程中的红细胞和血小板输注量及中性粒细胞恢复至0.5×109/L时间,非血液学毒性包括新发感染、胃肠道反应、皮疹、肝功能异常、心脏毒性等。
数据应用SPSS 18.0软件处理。计数资料比较采用χ2检验;计量资料以 ±s表示,两组比较采用t检验;以P<0.05为差异有统计学意义。
±s表示,两组比较采用t检验;以P<0.05为差异有统计学意义。
治疗1个疗程后,待患者外周血象恢复后复查骨髓评定疗效,LD-HA组CR率50.0%(26/52),PR率21.2%(11/52),OR率71.2% (37/52),IA组CR率44.9%(22/49),PR率8.2%(4/49),OR率53.1% (26/49),两组OR率差异无统计学意义(P=0.068)。1个疗程未缓解患者中,LD-HA组有9例行标准方案2次诱导,4例达CR,IA组有17例行2次诱导,7例达CR,两组OR率差异无统计学意义(P>0.05)。LD-HA组患者主要为M1和M2,化疗1个疗程后,只有1例缓解,OR率明显低于其他分型,差异有统计学意义(P=0.025);IA组患者也以M1和M2为主,不同FAB分型之间OR率差异无统计学意义(χ2=6.599,P= 0.360);101例患者中不同FAB分型之间OR率差异无统计学意义(P>0.05)。LD-HA组和IA组3个月OS率分别为90.5%和90.9%,12个月OS率分别为57.1%和45.5%,差异均无统计学意义(均P> 0.05)。
低危组、中危组分层中,1个疗程诱导治疗结束后,LD-HA组与IA组间OR率差异均无统计学意义(P>0.05),高危分层中,1个疗程诱导治疗结束后,LD-HA组OR率较IA组高(P<0.05)(表2)。
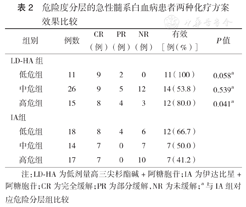
危险度分层的急性髓系白血病患者两种化疗方案效果比较
危险度分层的急性髓系白血病患者两种化疗方案效果比较
| 组别 | 例数 | CR(例) | PR(例) | NR(例) | 有效[例(%)] | P值 | |
|---|---|---|---|---|---|---|---|
| LD-HA组 | |||||||
| 低危组 | 11 | 9 | 2 | 0 | 11(100) | 0.058a | |
| 中危组 | 26 | 9 | 5 | 12 | 14(53.8) | 0.539a | |
| 高危组 | 15 | 8 | 4 | 3 | 12(80.0) | 0.041a | |
| IA组 | |||||||
| 低危组 | 18 | 8 | 4 | 6 | 12(66.7) | ||
| 中危组 | 14 | 7 | 0 | 7 | 7 (50.0) | ||
| 高危组 | 17 | 7 | 0 | 10 | 7(41.2) | ||
注:LD-HA为低剂量高三尖杉酯碱+阿糖胞苷;IA为伊达比星+阿糖胞苷;CR为完全缓解;PR为部分缓解,NR为未缓解;a与IA组对应危险分层组比较
WT1阳性70例,1个疗程后,CR 38例,PR 9例,OR率67.1% ;LD-HA组WT1阳性患者37例,CR 21例,PR 7例,IA组WT1阳性患者33例,CR 17例,PR 2例,两组OR率差异无统计学意义(P>0.05)。NPM1阳性22例,1个疗程后,CR 16例,PR 3例,OR率86.4% ;LD-HA组NPM1阳性9例,CR 6例,PR 2例,IA组NPM1阳性13例,CR 10例,PR 1例,两组OR率差异无统计学意义(P>0.05)。CEBPα阳性12例,1个疗程后,CR 5例,PR 4例,OR率75.0%;LD-HA组CEBPα阳性5例,CR 3例,PR 2例,IA组CEBPα阳性7例,CR 2例,PR 2例,两组OR率差异无统计学意义(P>0.05)。FLT3-ITD阳性14例,1个疗程后,6例CR, 3例PR, OR率64.3%;LD-HA组FLT3-ITD阳性8例,CR 3例,PR 3例,IA组FLT3-ITD阳性6例,CR 3例,两组OR率差异无统计学意义(P>0.05)。DNMT3A阳性4例,1个疗程后,CR 2例。c-kit阳性2例,1个疗程后,CR 1例,NR 1例。FLT3-TKD阳性2例,1个疗程后均达CR。全组中,NPM1、FLT3-ITD均阳性3例,NR 1例,CR 2例;CEBPα、FLT3-ITD均阳性1例,1个疗程后达PR;FLT3-ITD、DNMT3A均阳性1例,1个疗程后达NR; DNMT3A、NPM1均阳性1例,1个疗程后达CR; NPM1、FLT3-TKD均阳性1例,1个疗程后达CR; NPM1、FLT3-ITD及CEBPα均阳性2例,1例PR, 1例CR。
血液学毒性方面,LD-HA组化疗过程中新发感染、出血的发生率低于IA组(P<0.05),LD-HA组化疗后中性粒细胞恢复至0.5×109/L时间短于IA组(P< 0.05),两组化疗期间输注红细胞和血小板的量差异无统计学意义(P>0.05);非血液学毒性方面,LD-HA组心脏毒性(包括心电图异常和临床症状、体征)、肝脏毒性发生率低于IA组(P<0.05),两组胃肠道反应、皮疹发生率差异无统计学意义(P>0.05)(表3)。LD-HA组中8周内无死亡患者,IA组死亡5例(3例低危组,1例中危组,1例高危组),其中3例死于感染性休克,2例死于脑出血,IA组早期死亡率高于LD-HA组(P<0.05)(表3)。
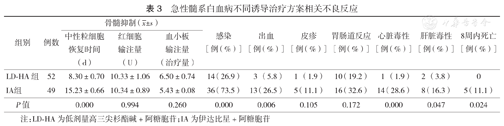
急性髓系白血病不同诱导治疗方案相关不良反应
急性髓系白血病不同诱导治疗方案相关不良反应
| 组别 | 例数 | 骨髓抑制( ±s) ±s) | 感染[例(%)] | 出血[例(%)] | 皮疹[例(%)] | 胃肠道反应[例(%)] | 心脏毒性[例(%)] | 肝脏毒性[例(%)] | 8周内死亡[例(%)] | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 中性粒细胞恢复时间(d) | 红细胞输注量(U) | 血小板输注量(治疗量) | |||||||||
| LD-HA组 | 52 | 8.30±0.70 | 10.33±1.06 | 6.50±0.74 | 14(26.9) | 3 (5.8) | 1 (1.9) | 10(19.2) | 1 (1.9) | 2 (3.8) | 0 |
| IA组 | 49 | 15.23±0.66 | 10.34±0.89 | 5.43±0.08 | 36(73.5) | 13(26.5) | 5(11.1) | 16(32.6) | 14(28.6) | 8(16.3) | 5(11.1) |
| P值 | 0.000 | 0.994 | 0.260 | 0.000 | 0.006 | 0.105 | 0.172 | 0.000 | 0.047 | 0.024 | |
注:LD-HA为低剂量高三尖杉酯碱+阿糖胞苷;IA为伊达比星+阿糖胞苷
低危组:LD-HA组新发感染的发生率低于IA组,中性粒细胞恢复至0.5× 109/L中位时间为(10.45±3.30)d,短于IA组的(14.94±5.30) d(P<0.05),化疗期间输注红细胞和血小板的量差异无统计学意义(P>0.05);胃肠道反应、皮疹、出血症状、肝功能异常、心脏毒性等的发生率差异无统计学意义(P> 0.05)。
中危组:LD-HA组化疗过程中出血发生率低于IA组,中性粒细胞恢复至0.5×109/L中位时间为(7.33±4.83)d,短于IA组的(16.17±4.06)d,差异均有统计学意义(P<0.05),化疗期间新发感染发生率、输注红细胞和血小板的量差异均无统计学意义(均P>0.05);LD-HA组心脏毒性发生率低于IA组(P= 0.003),胃肠道反应、皮疹、肝功能异常等的发生率差异均无统计学意义(均P>0.05)。
高危组:LD-HA组新发感染的发生率低于IA组,中性粒细胞恢复至0.5×109/L中位时间为(8.17±4.88)d,短于IA组的(14.73±4.88) d(P<0.05),化疗期间出血发生率、输注红细胞和血小板的量差异无统计学意义(P>0.05);胃肠道反应、皮疹、肝功能异常、心脏毒性等的发生率差异均无统计学意义(均P> 0.05)。
20世纪80年代我们在国内外率先报告了LD-HA方案治疗AML的疗效,并进一步对其作用机制进行了研究[2],高三尖杉酯碱具有促进白血病细胞凋亡、诱导白血病细胞分化、抑制肿瘤细胞增殖的作用[3,4],与蒽环类药物有类似的疗效,而且化疗相关的骨髓抑制和心脏毒性明显降低。已经证实蒽环类药物具有明显的心脏毒性[5,6],所以高三尖杉酯碱联合阿糖胞苷适用于高龄、高白细胞、基础疾病较多的患者。对于初诊时WBC较低的患者,化疗时可以联合G-CSF,不仅可以升高外周血WBC,而且可促使G0期细胞向G1期转变,增强高三尖杉酯碱和阿糖胞苷的抗白血病作用[7]。有研究报道,老年AML患者应用LD-HA方案联合G-CSF诱导治疗,获得了75%的OR率(CR率60.7%,PR率14.3%),并且发现中位OS时间与NPM1突变、FLT3-ITD突变、DNMT3A突变相关[8]。
本研究回顾性分析101例初治AML患者,按首次诱导方案的不同分组,并依据2015 NCCN指南进行危险度分级,分别观察不同危险度分级之间的临床疗效和化疗相关不良反应。结果发现LD-HA组和IA组OR率有差异,而LD-HA组化疗过程新发感染的发生率、心脏毒性、中性粒细胞恢复至0.5×109/L的中位时间均低于IA组,说明LD-HA方案较标准方案具有较高的缓解率、较低的不良反应。有研究报道,LD-HA联合G-CSF诱导治疗难治和复发AML,缓解率64.1%,与脂质体多柔比星和伊达比星相仿,粒细胞缺乏期(中性粒细胞<0.5×109/L)的中位持续时间为7 d(2~21 d),Plt<20×109/L的中位持续时间为11 d(0~27 d),58例(87%)发生2~4级感染,7例(10.4%)发生早期死亡[9],本研究结果与之类似。
由于部分首次未缓解患者并未进行再次诱导治疗,所以我们对首次诱导治疗疗效按不同危险度分层比较,发现LD-HA组中高危组的OR率高于IA组,而LD-HA组低危组的新发感染率、中危组的心脏毒性及出血症状发生率、高危组的新发感染率均低于IA组,且LD-HA的低、中、高危组的中性粒细胞恢复时间均短于IA组,提示LD-HA方案在高危组中疗效较好,且不良反应轻微。由于LD-HA组患者初诊时WBC较高、Hb较低,所以尽管LD-HA方案骨髓抑制作用轻微,但是输血量相比标准方案并无降低。对于高危组患者来说,使用LD-HA方案不仅缓解率高,而且化疗期间的感染发生率低、中性粒细胞恢复时间短,有利于降低感染相关死亡率,降低化疗风险,同时也可以减少住院时间,减少治疗费用。一项Ⅲ期临床试验入组326例老年高危AML患者,单用氯法拉滨组和氯法拉滨联合阿糖胞苷组分别获得了22.9% (CR率17.8%)和46.9%(CR率35.2%)的OR率,CR率和OR率均低于本研究LD-HA的高危组[10]。
综上,我们认为LD-HA方案治疗AML安全有效,特别是对于高危组AML患者,应用LD-HA诱导治疗,缓解率高,化疗相关不良反应低,更有利于后期的巩固化疗以及造血干细胞移植。
无



























