
探讨多发性骨髓瘤(MM)行PAD方案(硼替佐米、多柔比星、地塞米松)及VAD方案(长春新碱、多柔比星/多柔比星衍生物、地塞米松)联合沙利度胺(VAD样-T方案)治疗效果的差异。
回顾性分析54例接受VAD样-T方案及72例接受PAD方案治疗的MM患者的疗效,包括完全缓解(CR)率、非常好的部分缓解(VGPR)率、总有效率(ORR)、总生存(OS)、无进展生存(PFS)及不良反应发生情况。
PAD组CR率高于VAD样-T组,差异有统计学意义[31.5%(23/72)比9.3%(5/54),χ2=0.30,P=0.002],但是VGPR率及ORR两组相比差异无统计学意义[16.7%(12/72)比16.6%(9/54),P=0.180;82.2%(65/72)比81.5%(44/54),P=0.190]。PAD组中位PFS时间长于VAD样-T组[(38.2±2.2)个月比(28.0±7.6)个月,P=0.017];PAD组3年PFS率和5年OS率高于VAD样-T组,但差异均无统计学意义(均P>0.05)。PAD组末梢神经损害发生率高于VAD样-T组,差异有统计学意义[31.5%(23/72)比14.5%(8/54),P=0.03]。
虽然VAD样-T方案的CR率低于PAD方案,中位PFS时间短于PAD方案,但VGPR率、ORR、3年PFS率、5年OS率与PAD方案相当,且相对安全,末梢神经损害的发生率相对较低。对于国内无法使用硼替佐米及骨髓移植的初发MM患者,可选择VAD样-T作为一线诱导化疗方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(MM)为浆细胞恶性克隆性疾病,因骨髓中克隆性浆细胞异常增生,并分泌单克隆免疫球蛋白或其片段(M蛋白)而导致靶器官损害。MM常见临床表现为骨痛、贫血、肾功能不全和感染。其好发于老年人,约占血液系统恶性肿瘤的10%。传统MP、VAD化疗方案的有效率约35%,但完全缓解(CR)率较低,约2%[1],5年总生存(OS)率约30%[2]。近年来,随着新药(硼替佐米、来那度胺、沙利度胺)的使用及自体造血干细胞移植(ASCT)的开展,MM的疗效已明显改善。Meta分析显示,与传统治疗相比,接受新药治疗者的无进展生存(PFS)率、CR率明显提高,CR+接近完全缓解(nCR)率达38%,部分患者的中位PFS达56.2个月[3,4,5]。2015年中国MM诊治指南中初发MM适合骨髓移植患者的治疗方案主要为含硼替佐米、来那度胺的多药联合诱导化疗、包含ASCT的巩固治疗及维持治疗[6],但是目前国内有相当一部分患者因经济原因无法承受这些治疗的高昂费用,所以选择疗效相对较好、费用相对较低且含新药的化疗方案对他们显得尤为重要。上海瑞金医院MM工作组前期回顾性研究发现VAD样-T方案疗效较好,总有效率(ORR)达81.5%[7]。为进一步了解VAD样-T方案与PAD方案的疗效差异,本研究回顾性分析了126例初发MM行PAD及VAD样-T方案诱导化疗的效果及不良反应。
收集上海交通大学附属瑞金医院血液科2009年1月至2014年6月应用PAD方案及2002年8月至2008年8月应用VAD样-T方案诱导治疗的初发MM患者126例。PAD组72例,平均年龄51.6岁(35~67岁);女性27例,男性45例。IgG型40例,IgA型13例,IgD型3例,κ型6例,λ型10例。DS Ⅰ期0例,Ⅱ期7例,Ⅲ期65例;ISS Ⅰ期16例,Ⅱ期39例,Ⅲ期17例。VAD样-T组54例,平均年龄58.7岁(20~87岁);女性27例,男性27例。IgG型30例,IgA型18例,IgD型1例,κ型2例,λ型3例。DS Ⅰ期4例,Ⅱ期10例,Ⅲ期40例;ISS Ⅰ期8例,Ⅱ期25例,Ⅲ期21例。所有患者均符合MM诊断标准。VAD样-T组中4例DS Ⅰ期患者因反复肺部感染而接受治疗。两组患者性别、年龄、分型、DS分期、ISS分期等方面差异均无统计学意义(均P>0.05)。
PAD方案诱导治疗2~8个疗程,平均4.3个疗程。硼替佐米每天1.3 mg/m2,第1、4、8、11天静脉注射;多柔比星每天9 mg/m2,第1天至第4天静脉滴注;地塞米松40 mg,第1天至第4天静脉滴注,28 d为1个疗程。达最大疗效后有7例行ASCT(因无美法仑针剂,2008年以后我院未行MM的ASCT),其余患者均予维持治疗至疾病进展,方案包括硼替佐米1.3 mg/m2每3周1次+环磷酰胺0.75 g/m2每6周1次或沙利度胺100 mg/d维持或环磷酰胺0.75 g/m2每4~6周1次。
VAD样-T方案诱导治疗共4~8个疗程,平均5.62个疗程。长春新碱+蒽环类(多柔比星/脂质体多柔比星/米托蒽醌/吡柔比星)+地塞米松+沙利度胺,28 d为1个疗程。长春新碱0.5 mg/d,第1天至第4天静脉滴注;多柔比星每天9 mg/m2第1天至第4天静脉滴注,脂质体多柔比星每天13 mg/m2第1天至第3天静脉滴注,米托蒽醌2 mg第1天至第4天静脉滴注,吡柔比星每天10 mg/m2第1天至第4天静脉滴注;地塞米松40 mg,第1天至第4天静脉滴注;沙利度胺100 mg每晚睡前服用至疾病进展。维持治疗给予环磷酰胺0.75 g/m2每4~6周1次+沙利度胺100 mg/d至疾病进展。
患者治疗中出现并发症时均予对症支持治疗。
根据国际骨髓瘤工作组(IMWG)制定的疗效标准,分为CR、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。达到PR或以上为治疗有效,观察CR率、CR+VGPR率、ORR(CR+VGPR+PR)。PAD组随访时间为自治疗之日起至2014年12月31日;VAD样-T组随访时间为自治疗之日起至2008年8月31日(因2009年至2014年新发MM患者用VAD样-T方案化疗的病例数明显少于PAD方案,且两种治疗方案有交叉,遂采用历史对照研究)。
用SPSS 19.0软件对数据进行统计学分析,有效率及不良反应发生率的比较采用χ2检验,采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验。以P<0.05为差异有统计学意义。
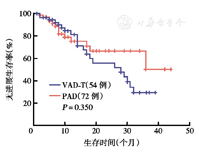
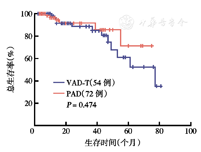
PAD组CR率高于VAD样-T组[31.5%(23/72)比9.3%(5/54)],差异有统计学意义(χ2=0.30,P=0.002)。PAD组和VAD样-T组的VGPR率及ORR分别为16.7%(12/72)比16.6%(9/54)及82.2%(65/72)比81.5%(44/54),两组差异均无统计学意义(P=0.180,P=0.190)。PAD组3年PFS率为49.9%,VAD样-T组为29.3%,两组差异无统计学意义(χ2=2.69,P=0.350)(图1)。PAD组中位PFS时间长于VAD样-T组[(38.2±2.2)个月比(28.0±7.6)个月],两组差异有统计学意义(χ2=5.71,P=0.017)。PAD组5年OS率为71.3%,VAD样-T组为53.6%,两组差异无统计学意义(χ2=2.37,P=0.474)(图2)。PAD组中位OS时间没有达到,VAD样-T组中位OS时间为49个月。


PAD组与VAD样-T组的白细胞减少、血小板减少、消化道反应(腹泻、便秘、恶心、呕吐)、疱疹病毒感染和肝损害的发生率差异均无统计学意义(均P>0.05)。但PAD组末梢神经损害(PN)的发生率高于VAD样-T组,差异有统计学意义(P=0.03)。PAD组无深静脉血栓(DVT)事件发生,VAD样-T组有1例患者发生DVT(表1)。
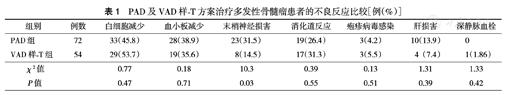
PAD及VAD样-T方案治疗多发性骨髓瘤患者的不良反应比较[例(%)]
PAD及VAD样-T方案治疗多发性骨髓瘤患者的不良反应比较[例(%)]
| 组别 | 例数 | 白细胞减少 | 血小板减少 | 末梢神经损害 | 消化道反应 | 疱疹病毒感染 | 肝损害 | 深静脉血栓 |
|---|---|---|---|---|---|---|---|---|
| PAD组 | 72 | 33(45.8) | 28(38.9) | 23(31.5) | 19(26.4) | 3(4.2) | 10(13.9) | 0 |
| VAD样-T组 | 54 | 29(53.7) | 19(35.6) | 8(14.5) | 17(31.3) | 3(5.5) | 4(7.4) | 1(1.86) |
| χ2值 | 0.77 | 0.18 | 10.3 | 0.39 | 0.13 | 1.31 | 1.33 | |
| P值 | 0.47 | 0.71 | 0.03 | 0.55 | 0.51 | 0.39 | 0.42 |
2016年美国国立综合癌症网络(NCCN)指南推荐,对于新诊断的适合骨髓移植的MM患者,Ⅰ类推荐化疗方案为包含硼替佐米、沙利度胺、来那度胺的新药联合化疗,Ⅱ类推荐包括VAD、DVD(脂质体多柔比星、长春新碱、地塞米松)、TD(沙利度胺+地塞米松)方案等。
Sonneveld等[8]比较了PAD、VAD方案诱导治疗初发MM、后续行ASCT巩固及分别予硼替佐米或沙利度胺维持治疗的效果,PAD组CR率、CR+nCR率均高于VAD组(分别为36%比24%、49%比34%),中位PFS时间长于VAD组(分别为35、28个月),但两组5年OS率差异无统计学意义(分别为61%、55%)。目前PAD可替代VAD作为初发MM的一线治疗方案,但是许多经济困难的初发MM患者难以负担硼替佐米的高昂费用,因此,有必要探索适合我国国情、有效及价廉的其他治疗方案。VAD样-T方案含新药且费用相对较低,比较适合我国初发MM患者中经济条件差者。所以我们对PAD和VAD样-T方案进行了比较,结果显示PAD组CR率高于VAD样-T组,差异有统计学意义(P<0.05),而VGPR率及ORR两组相比差异均无统计学意义(均P>0.05)。虽然PAD组PFS率、5年OS率高于VAD样-T组,但差异均无统计学意义(均P>0.05)。
血液学不良反应方面,PAD组与VAD样-T组的白细胞减少、血小板减少的发生率差异无统计学意义(P>0.05),其中PAD组血液学不良反应主要为Ⅰ~Ⅱ级骨髓抑制,表现为白细胞及血小板减少,有约10%的患者因Ⅲ级骨髓抑制而暂时停用硼替佐米。非血液学不良反应方面,PAD组与VAD样-T组的消化道反应(腹泻、便秘、恶心、呕吐)、疱疹病毒感染和肝损害的发生率差异无统计学意义(P>0.05),但PAD组的PN发生率高于VAD样-T组(P=0.03),且有13.4%的PN患者因严重手足疼痛而暂时停用硼替佐米,与国外报道相似[9]。有研究显示硼替佐米相关的PN发生率呈剂量依赖性,1.3 mg/m2时发生率为37%;1.0 mg/m2时发生率为22%,12%的患者需减少硼替佐米剂量,5%的患者可能中断硼替佐米治疗[9,10]。目前,硼替佐米导致PN的机制尚不清楚,可能与线粒体介导的背根神经节钙代谢紊乱及线粒体、内质网损伤有关[11,12]。PAD方案的高PN发生率致使本研究中部分患者不能坚持治疗而影响疗效。相比较而言,VAD样-T方案的PN及DVT发生率相对较低。
综上所述,对于国内无条件使用硼替佐米及骨髓移植的初发MM患者,可选择VAD样-T作为一线诱导化疗方案,虽然CR率低于PAD方案,但仍有较高的ORR、3年PFS率及5年OS率,且相对安全,PN的发生率相对较低。
无



























