
分析具有正常核型的急性髓系白血病(CN-AML)患者NPM1基因突变情况及其临床意义。
回顾性分析2008年1月至2015年6月年同济医院血液内科收治的190例初发CN-AML患者的临床资料。对比研究NPM1突变型与野生型CN-AML患者之间临床特征和治疗效果的差异。
190例CN-AML患者中44例(23.16%)出现NPM1基因突变。与野生组比较,突变组患者外周血白细胞计数高(60.0×109/L比75.7×109/L,P<0.05),骨髓中原始细胞比例高(63.87%比75.82%,P<0.05),初次化疗缓解(完全缓解+部分缓解)率高[56.91%(45/79)比70.09%(22/31),P<0.05]。
NPM1基因突变与CN-AML高肿瘤负荷以及高诱导化疗缓解率具有相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是一类具有遗传学异质性的疾病,40%~49%的成年人AML及25%的儿童AML为正常核型,预后分层时被归入中危组,但是其远期的预后情况却很难判断[1]。因为多种获得性基因的改变,如FLT3突变、NPM1突变、CEBPA突变、MLL突变、KIT突变以及BAALC、MN1及ERG1基因过表达等,导致该类患者预后具有显著异质性[2,3,4],如正常核型伴单一的NPM1、CEBPd突变已被美国国立综合癌症网络(NCCN)列为预后良好组,FLT3-ITD则被视为预后不良的标志[5]。NPM1基因突变是AML中最常见的一种基因突变,发生率为25%~35%,而在正常核型AML(CN-AML)患者中突变率更高。多项研究证实NPM1基因突变的CN-AML患者具有较高的骨髓原始细胞计数、较高的外周血白细胞和血小板计数,合并FLT3突变时更明显;在标准化疗后有明显较高的完全缓解(CR)率;是CR、无病生存(DFS)、总生存(OS)独立的较好预后因素[1,6,7,8]。为探讨伴有NPM1基因突变的CN-AML与伴有野生型NPM1的CN-AML患者之间临床特征是否存在较大的差异,本研究分析了190例CN-AML患者中NPM1突变的发生情况,并分析其相关临床特点和治疗效果。
选取2008年1月至2015年6月华中科技大学同济医学院附属同济医院血液内科住院的初诊AML患者,所有患者均经过骨髓细胞形态学、免疫表型、染色体和融合基因检查确诊。筛选出CN-AML患者190例进行临床回顾性分析,其中男性100例,女性90例,平均年龄43.6岁(15~74岁)。参照法、美、英协作组(FAB)标准及世界卫生组织(WHO)标准:M0 3例、M1 24例、M2 56例、M3 0例、M4 3例、M5 101例、M6 3例。分别筛选出NPM1突变组与野生组CN-AML患者进行比较研究。参照文献[9]标准判断疗效。初次化疗的缓解率以CR加部分缓解(PR)计算。
所有病例标本应用R显带技术进行核型分析。治疗前抽取患者骨髓5 ml,肝素抗凝,采用直接法及不加植物血凝素的短期培养法制备染色体标本,然后采取改良的热处理吉姆萨R显带技术分析20个以上分裂象细胞核型,核型按《人类细胞遗传学国际命名体制(ISCN2005)》进行描述。
所有患者在获得知情同意后抽取骨髓液5 ml,用于常规免疫表型和细胞遗传学分析,剩余骨髓液用淋巴细胞分离液分离出单个核细胞,采用传统酚-氯仿抽提法提取DNA,去离子水稀释DNA至50 μg/μl,-20 ℃保存备用,应用紫外分光光度仪测定样本的吸光度(A)值。
参照文献[10]设计合成NPM1基因的第12号外显子引物:正义链5'-TFAACTCTCTGGTGGTAGAAT GAA-3',反义链5'-CAAGACTATITllGCCATTCCTAAC-3',由上海英俊公司合成。聚合酶链反应(PCR)总体系25 μl,反应条件:95 ℃预变性5 min,94 ℃ 45 s,56 ℃ 45 s、72 ℃ 45 s(40个循环),72 ℃延伸10 min,4 ℃保存。PCR产物在2 g/L琼脂糖凝胶上进行电泳,EB染色后紫外灯下观察目的条带约为560 bp。用5'-AAAAGGACAGCCAGATATCAAC-3'测序引物对扩增产物进行直接测序,结果与正常序列比对,在测序引物后80 bp范围内出现重叠峰的标本为NPM1基因突变阳性标本。
直接观察指标采用描述性分析。定量资料用均数表示,两组间比较采用t检验;分类资料的比较采用χ2检验,样本量<40时采用Fisher确切概率法。检验水准定为α=0.05。
与野生组比较,突变组患者外周血白细胞计数平均值高(P<0.05),骨髓中原始细胞比例高(63.87%比75.82%,P<0.05);初次化疗缓解率高[56.91%(45/79)比70.09%(22/31),P<0.05](表1)。
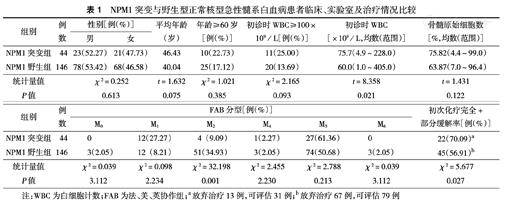
NPM1突变与野生型正常核型急性髓系白血病患者临床、实验室及治疗情况比较
NPM1突变与野生型正常核型急性髓系白血病患者临床、实验室及治疗情况比较
| 组别 | 例数 | 性别[例(%)] | 平均年龄(岁) | 年龄≥60岁[例(%)] | 初诊时WBC≥100×109/L[例(%)] | 初诊时WBC[×109/L,均数(范围)] | 骨髓原始细胞数[%,均数(范围)] | |
|---|---|---|---|---|---|---|---|---|
| 男 | 女 | |||||||
| NPM1突变组 | 44 | 23(52.27) | 21(47.73) | 46.43 | 10(22.73) | 11(25.00) | 75.7(4.9~228.0) | 75.82(4.4~99.0) |
| NPM1野生组 | 146 | 78(53.42) | 68(46.58) | 40.04 | 25(17.12) | 20(13.69) | 60.0(1.0~405.0) | 63.87(7.0~96.4) |
| 统计量值 | χ2=0.252 | t=1.632 | χ2=1.021 | χ2=2.165 | t=8.358 | t=1.431 | ||
| P值 | 0.613 | 0.075 | 0.385 | 0.093 | 0.021 | 0.122 | ||
| 组别 | 例数 | FAB分型[例(%)] | 初次化疗完全+部分缓解率[例(%)] | |||||
|---|---|---|---|---|---|---|---|---|
| M0 | M1 | M2 | M4 | M5 | M6 | |||
| NPM1突变组 | 44 | 0 | 12(27.27) | 4(9.09) | 1(2.27) | 27(61.36) | 0 | 22(70.09)a |
| NPM1野生组 | 146 | 3(2.05) | 12(8.21) | 51(34.93) | 3(2.05) | 74(50.68) | 3(2.05) | 45(56.91)b |
| 统计量值 | χ2=0.039 | χ2=0.098 | χ2=32.198 | χ2=2.455 | χ2=2.788 | χ2=0.039 | χ2=5.677 | |
| P值 | 3.112 | 2.234 | 0.001 | 2.230 | 0.213 | 3.112 | 0.027 | |
注:WBC为白细胞计数;FAB为法、美、英协作组;a放弃治疗13例,可评估31例;b放弃治疗67例,可评估79例
CN-AML患者过去被划分为预后中等组,然而研究发现这组患者的预后存在着相当大的差异,因此以核型为基础的AML分型并不能让人满意,需在分子水平进一步发现新的预后相关因素[1,11]。过去十余年里,许多强烈影响CN-AML患者预后的基因突变及基因表达相继被发现,如FLT3基因突变、NPM1基因突变等[3,12]。
NPM1基因定位于染色体5q35,含有12个外显子,其编码的核磷蛋白NPM主要定位于核仁区,参与调节中心体的复制、核糖体蛋白质组装、细胞核与细胞质之间的物质转运及调节p53通路等。NPM1基因突变后(最常见的为NPM1基因12号外显子4个碱基对的重复),导致该基因缺乏胞核定位信号而积聚在细胞质内,而突变的NPM1蛋白又可通过二聚体化使野生型NPM1蛋白分布异常,干扰正常核磷蛋白功能[6,7,13]。NPM1基因丢失或易位导致融合蛋白形成,促进血液系统肿瘤的发生,被认为是AML最常见的一种基因突变类型[6,7,12]。NPM1突变在所有成年人AML中的发生率约为30%,而在染色体正常的成年人AML中发生率为50%~60%,NPM1基因的过表达也参与了多种实体肿瘤的生成[14,15]。
本研究结果表明:(1)190例AML患者中发现NPM1突变44例(23.16%),其中正常核型检出率为50%~60%,低于国外文献报道,可能与样本量少有关,高于国内研究报道的正常核型检出率20%~30%[16,17],可能与检测的NPM1突变类型不同有关,因为文献报道的AML中NPM1突变一般为第12号外显子的移码突变。目前已发现50余种变异体,以6种变异体为主(突变A~F),最频繁的为突变A,占77%~80%,此外,突变B、D分别占10%、5%[18,19,20]。(2)NPM1突变的患者在临床上多表现为初诊时外周血白细胞计数高、骨髓及外周血中原始细胞比例较高。(3)在FAB分型中主要见于M1、M2及M5型患者,发生率分别为27.27%、9.09%和61.36%,不存在于M3型患者中,较少存在于M0、M4、M6及M7型患者中。国外研究报道NPM1突变在FAB-AML各亚型(M3除外)中均可出现,最常见于M4、M5a和M5b,发生率分别为77%、71%和90%,在M2中发生率为34%[21]。另有研究显示NPM1突变细胞低或无CD34的表达,多表达CD13、CD33、CD117、HLA-DR,提示NPM1突变细胞可能起源于共同的髓系前体细胞或是更早的不具备分化至淋系功能的祖细胞[18,22]。(4)本研究也证实单一NPM1突变阳性患者对诱导化疗反应敏感,CR率高,有研究报道其无事件生存、无复发生存、DFS和OS率亦明显增高,并且这些预后指标与化疗方案的选择无关[23,24,25]。(5)Alcalay等[26]的研究提示NPM1突变更多见于女性患者,本研究未见性别差异。
由于NPM1突变型AML的上述特征,WHO目前已将其列为一种独特的AML亚型。同时由于NPM1突变在AML中表达的稳定性及其随疾病进程表达量的变化,将其作为监测微小残留病(MRD)的指标也逐渐在临床应用[10]。NPM1基因突变类型及数量在细胞形态学、免疫学、细胞遗传学和分子生物学(MICM)分型中都有特殊的分布,并与白细胞计数、骨髓原始细胞数和预后均有相关性。对于染色体核型正常的患者,基因突变可作为判断预后的新分子标志,并且NPM1突变的靶向治疗已逐步走向临床,为治疗AML提供了新方法。
无



























