
比较氟马替尼与伊马替尼治疗初诊慢性粒细胞白血病(CML)的有效性和安全性。
采用多中心、随机、阳性药物平行对照的研究方法,对24例符合条件的初诊费城染色体阳性CML慢性期(Ph+ CML-CP)患者给予6个周期(24周)的氟马替尼400 mg/d、600 mg/d和伊马替尼治疗,分别在给药前及给药后2、4、6、8、10、12、16、20、24周进行血液学评价,给药前及给药后12、24周进行形态学、细胞遗传学和分子生物学评价。
在有效性方面,治疗6个周期,氟马替尼600 mg/d组的主要分子学缓解(MMR)率高于伊马替尼组,差异有统计学意义[44.44%(4/9)比14.29%(1/7),P=0.017]。治疗3个周期,氟马替尼600 mg/d组bcr-ablIS≤10%的患者比例高于伊马替尼组,差异有统计学意义(P=0.002);药代动力学/药效动力学分析也提示氟马替尼600 mg/d较400 mg/d更有可能使患者在早期获得分子学反应。在安全性方面,氟马替尼400 mg/d组、氟马替尼600 mg/d组和伊马替尼组Ⅲ~Ⅳ级不良事件的发生率差异无统计学意义(P>0.05)。氟马替尼组较常见皮肤毒性和胃肠道反应,常见的不良事件为腹泻,未发生心脏和心血管系统不良反应,水肿的发生率低于伊马替尼组。
氟马替尼可以安全有效地治疗初诊Ph+ CML-CP患者,600 mg/d是一个较为合适的临床起始剂量。氟马替尼和伊马替尼在临床上具有相似的安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性粒细胞白血病(CML)是迄今为止分子机制研究得最为透彻的恶性肿瘤之一。研究证实伊马替尼能够与靶标bcr-abl酪氨酸激酶结合并相互作用,抑制bcr-abl的磷酸化催化作用,抑制其活性,从而抑制癌细胞增殖,诱导其凋亡[1]。近来研究发现服用伊马替尼后许多CML患者产生了耐药性,bcr-abl发生了变异,导致酶的结构改变,伊马替尼不能与其结合[2,3,4,5]。氨基嘧啶类化合物甲磺酸氟马替尼是针对bcr-abl设计的伊马替尼的结构修饰药物。在临床前筛选过程中发现,甲磺酸氟马替尼的疗效优于甲磺酸伊马替尼。本试验旨在比较两药治疗初诊费城染色体阳性CML慢性期(Ph+ CML-CP)患者的有效性和安全性。
本试验为多中心、随机、阳性药物平行对照Ⅱ期临床试验,经国家食品药品监督管理局和各研究单位伦理委员会批准。符合条件的CML-CP患者随机按1∶1∶1分入试验组1(氟马替尼400 mg/d)、试验组2(氟马替尼600 mg/d)或对照组(伊马替尼),接受6个周期(24周)治疗。采用中心化随机分组方法,各研究中心竞争入组。本文总结了江苏省三所医院共24例患者的资料。
(1)年龄18~75岁的男性、女性患者;(2)美国东部肿瘤协作组(ECOG)体力状况评分0~2分;(3)细胞学确诊的Ph+CML-CP[慢性期的定义为:外周血和骨髓中原始细胞<0.15;外周血和骨髓中原始细胞+早幼粒细胞<0.30;外周血中嗜碱粒细胞<0.20;血小板计数≥100×109/L(或<100×109/L,但与既往接受的药物治疗有关);无髓外浸润(肝、脾大除外)[6];(4)随机分组前6个月内患者首次确诊为CML;(5)血生化检查:总胆红素<1.5×正常上限(ULN);丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)<2.5×ULN;肌酸酐<1.5×ULN;血清淀粉酶和脂肪酶≤1.5×ULN;碱性磷酸酶≤2.5×ULN(除非异常与肿瘤有关);钾、镁、磷和总钙量(用血清清蛋白校正)≥正常值下限,或在给药前校正至正常范围内;(6)签署书面知情同意书。
(1)已知存在T315I突变;(2)既往接受或正在接受抗CML的药物(不包括羟基脲、阿那格雷)或手术治疗(包括造血干细胞移植)或其他任何抗肿瘤治疗(羟基脲或阿那格雷末次治疗时间距治疗开始的时间间隔至少7 d,且研究者评价受试者已从上述治疗的不良反应中恢复方可开始用药);(3)随机分组前4周内(包括4周)参加过其他新药临床试验(作为受试者);(4)随机分组前4周内(包括4周)接受过大手术或经研究者评价未从类似治疗的不良反应中恢复;(5)心功能受损:无法控制的心绞痛;12个月内心肌梗死发作;超声心动图显示左心室射血分数(LVEF)<50%或低于地方机构规定的正常范围下限(以较高值为准);心电图无法测定QT间期;完全性左束支传导阻滞;使用心室同步起搏器;先天性长QT综合征或已知有长QT综合征家族史,QTc>450 ms(男性)或QTc>470 ms(女性);有临床显著意义的室性或房性快速型心律失常;心电图检查中心率始终低于50次/min;(6)患有活跃的、不可控制的精神疾病,如精神病、严重抑郁、躁狂抑郁症;(7)控制不佳的药物治疗:控制不佳的糖尿病、无法控制的高血压、活跃的不可控制的感染(持续发热和恶化的临床病症);(8)患有可能显著影响试验药物吸收的胃肠功能受损或胃肠疾病,如溃疡、不能控制的恶心、呕吐、腹泻、吸收障碍综合征、小肠切除术后;(9)有与癌症无关的显著先天性或获得性出血性疾病史;(10)既往有急性(入选试验前1年内)或慢性胰腺炎病史;(11)既往患有除CML外的恶性肿瘤;(12)患有与疾病无关的急、慢性不受控制的肝病或重度肾病;(13)过敏体质或已知对试验药物[原料药和(或)辅料]过敏或禁忌的患者;(14)目前正在服用CYP3A4强诱导剂或强抑制剂类药物或可能延长QT间期的药物(除外羟基脲和阿那格雷),又无法暂时终止该类药物的使用,亦不能使用其他药物代替者;(15)妊娠、哺乳、处于生育年龄而未采取有效避孕措施者[育龄夫妇必须采取有效避孕措施,育龄妇女必须于首次服用试验药物前7 d内行人绒毛膜促性腺激素(HCG)检测除外妊娠,绝经后妇女必须停经至少12个月,所有受试者在试验期间和停药后3个月内必须采取有效避孕措施];(16)研究者认为不宜参加本试验,如不愿或无能力遵守治疗方案,包括不能按时访视。
Ph+ CML-CP患者签署知情同意书后,分配筛选编号,接受筛选期各项检查,所有筛选合格的受试者随机按2∶1分入试验组或对照组。试验组1:甲磺酸氟马替尼,起始剂量为400 mg/d;试验组2:甲磺酸氟马替尼,起始剂量为600 mg/d;每日给药1次,空腹给药,28 d为1个周期。对照组:甲磺酸伊马替尼(商品名:格列卫),起始剂量400 mg/d,每日给药1次,早餐时与食物同服,28 d为1个周期。核心试验期为6个周期。对照组和试验组受试者在试验期间允许因不良反应而下调剂量或因疗效不佳而上调剂量。
疗效观察指标包括:(1)主要有效性指标:治疗6个周期后的主要分子学缓解(MMR)率。(2)次要有效性指标:①完全细胞遗传学缓解(CCyR)率(治疗3、6、9、12个周期后);②MMR率(治疗3、9、12个周期后);③bcr-abl转录子下降≥4 log10和≥4.5 log10的比率(治疗3、6、9、12个周期后)[所有标本送至广州金域医学检验中心血液病诊断中心,bcr-ablIS有效转换系数(CF)为0.7];④血液学缓解(HR)率(治疗1、2、3、4、5、6、9、12个周期后);⑤至缓解时间,即从随机分组开始的日期到治疗过程中首次获得某一特定缓解的时间[包括MMR、CCyR、主要细胞遗传学缓解(MCyR)和完全血液学缓解(CHR),分别计算]。
安全性观察指标包括研究期间不良事件的发生率,症状、体征、外周血象、血生化检测(ALT、AST、总胆红素、尿素氮、肌酐、血电解质、血糖等)、凝血功能检查、心电图、超声心动图检查及不良事件等。
疗效判定标准:CML疗效判断包括血液学、细胞遗传学和分子生物学三个不同方面。(1)CHR:血细胞计数完全正常,且白细胞计数<10×109/L,血小板计数<450×109/L,白细胞分类计数正常,无髓外白血病表现;(2)部分血液学缓解:除外周血白细胞分类计数可见幼稚细胞,血小板计数>450×109/L,但较治疗前下降50%,脾脏大但较治疗前缩小50%外,其余同CHR;(4)MCyR:Ph+细胞0~34%,包括CCyR(Ph+细胞0)、部分细胞遗传学缓解(PCyR)(Ph+细胞1%~34%);(5)少量细胞遗传学缓解:Ph+细胞35%~64%;(6)最小细胞遗传学缓解:Ph+细胞65%~94%;(7)细胞遗传学未缓解:Ph+细胞95%~100%;(8)MMR:bcr-abl mRNA水平减低≥3个对数级;(9)完全分子生物学缓解(CMR):反转录聚合酶链反应(RT-PCR)检测bcr-abl为阴性。
不良事件的判定参照美国国家癌症研究所通用不良事件术语标准(NCI CTCAE)3.0,分为0~Ⅴ级。
采用SAS 9.2统计软件分析数据。计数资料采用频数(构成比)进行描述,各组比较用Fisher确切概率法或非参数检验。所有假设检验采用双侧检验,以P≤0.05为差异有统计学意义。
本试验共随机入组150例新诊断的Ph+ CML-CP患者,其中江苏三所医院共24例患者,8例被随机分配接受氟马替尼400 mg/d治疗,9例被随机分配接受氟马替尼600 mg/d治疗,7例被随机分配接受伊马替尼400 mg/d治疗。其中男性15例,女性9例,中位年龄38岁,随机分组时距首次诊断的中位时间为48 d;Sokal评分:低危组13例,中危组8例,高危组3例;无伴随疾病19例,有伴随疾病5例;携带其他异常染色体(除Ph+外)1例。
治疗第6个周期末,氟马替尼600 mg/d组的MMR率与伊马替尼组比较,差异有统计学意义[44.44%(4/9)比14.29%(1/7),P=0.017]。
治疗第6个周期末,氟马替尼400 mg/d组和氟马替尼600 mg/d组的CCyR率均呈现出优于伊马替尼组的趋势,但三组之间的差异无统计学意义(P>0.05)。第6个周期末的细胞遗传学反应见表1。

氟马替尼与伊马替尼治疗初诊慢性粒细胞白血病第6个周期末的细胞遗传学反应[例(%)]
氟马替尼与伊马替尼治疗初诊慢性粒细胞白血病第6个周期末的细胞遗传学反应[例(%)]
| 组别 | 例数 | 完全细胞遗传学缓解 | 部分细胞遗传学缓解 | 少量细胞遗传学缓解 | 最小细胞遗传学缓解 | 细胞遗传学未缓解 |
|---|---|---|---|---|---|---|
| 氟马替尼400 mg/d组 | 8 | 5(62.50) | 1(12.50) | 0 | 2(25.00) | 0 |
| 氟马替尼600 mg/d组 | 9 | 6(66.67) | 1(11.11) | 2(22.22) | 0 | 0 |
| 伊马替尼组 | 7 | 4(57.14) | 1(14.29) | 1(14.29) | 0 | 1(14.29) |
治疗第1个周期末,氟马替尼400 mg/d、600 mg/d及伊马替尼组的bcr-ablIS平均值分别为64.53%、52.61%、62.12%;第2个周期末3组分别为2.12%、0.74%、5.81%;第3个周期末3组分别为0.23%、0.19%、0.90%。各组bcr-ablIS值呈下降趋势,且氟马替尼600 mg/d组下降趋势最明显。治疗第3个周期末,氟马替尼600 mg/d组bcr-ablIS≤10%的患者比例高于伊马替尼组,差异有统计学意义(P=0.002)(表2)。药代动力学/药效动力学分析也提示氟马替尼600 mg/d较400 mg/d更有可能使患者在早期获得分子学反应。
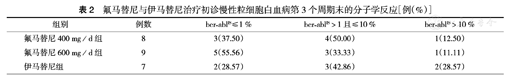
氟马替尼与伊马替尼治疗初诊慢性粒细胞白血病第3个周期末的分子学反应[例(%)]
氟马替尼与伊马替尼治疗初诊慢性粒细胞白血病第3个周期末的分子学反应[例(%)]
| 组别 | 例数 | bcr-ablIS≤1 % | bcr-ablIS >1且≤10 % | bcr-ablIS >10 % |
|---|---|---|---|---|
| 氟马替尼400 mg/d组 | 8 | 3(37.50) | 4(50.00) | 1(12.50) |
| 氟马替尼600 mg/d组 | 9 | 5(55.56) | 3(33.33) | 1(11.11) |
| 伊马替尼组 | 7 | 2(28.57) | 3(42.86) | 2(28.57) |
在核心试验期间,氟马替尼400 mg/d组、氟马替尼600 mg/d组和伊马替尼组的CHR率均为100%,差异无统计学意义(P>0.05)。
核心试验期间,三组的研究时间、治疗时间、持续暴露时间、停药时间、停药比例和剂量调整情况相近。各组中位剂量强度均与各组的起始剂量一致。氟马替尼较常见皮肤毒性和胃肠道反应(发生率≥5%),腹泻发生率≥10%,且呈剂量依赖性。氟马替尼400 mg/d组、氟马替尼600 mg/d组和伊马替尼组Ⅲ~Ⅳ级不良事件的发生率依次为75.00%(6/8)、77.78%(7/9)和85.71%(6/7)(P>0.05)。共发生2例严重不良事件(氟马替尼400 mg/d组),均以血小板减少为主的骨髓抑制而住院治疗;骨髓抑制在对症治疗后均获得缓解,且2例患者在缓解后均恢复试验。氟马替尼组未发生心脏和心血管系统不良事件,水肿的发生率低于伊马替尼组。
伊马替尼的靶向专一性使其治疗效率提高而毒副作用大大减小,其疗效优于现有的其他治疗CML的化疗法、干扰素法和骨髓移植法[1],而且可以口服给药,十分方便,目前使用已非常普遍。但近来发现服用伊马替尼后许多CML患者产生了耐药性[2]。目前伊马替尼作为一线药物治疗CML后发生bcr-abl突变的情况在临床上较为常见[6],而一些研究表明,伊马替尼的结构修饰物(如达沙替尼)可以更有效地治疗CML[7,8]。甲磺酸氟马替尼也是针对bcr-abl设计的伊马替尼结构修饰药物,能与变异的bcr-abl结合,从而导致白血病细胞凋亡[8]。既往的动物研究发现,甲磺酸氟马替尼可在细胞水平明显抑制p210 bcr-abl酪氨酸激酶活性;抑制bcr-abl阳性白血病细胞的增殖;抑制bcr-abl阳性白血病裸小鼠移植瘤的生长;消除体内bcr-abl阳性白血病细胞,导致肿瘤完全消退;提高荷瘤(K562)小鼠的存活率;延长荷瘤小鼠的存活时间;疗效明显优于甲磺酸伊马替尼[9,10]。
本临床试验对氟马替尼的有效性和安全性进行了评价。在有效性方面,治疗6个周期末,氟马替尼600 mg/d组的MMR率高于伊马替尼组。近年研究发现,对3个月的bcr-ablIS≤10%的患者给予酪氨酸激酶抑制剂(TKI)治疗,无进展生存(PFS)率和总生存(OS)率均高于bcr-ablIS>10%的患者,从而认为3个月bcr-ablIS能预测患者的长期生存情况[11,12]。在本试验中,治疗3个周期末,氟马替尼600 mg/d组bcr-ablIS≤10%的患者比例高于伊马替尼组,且差异有统计学意义(P<0.05);药代动力学/药效动力学分析也提示氟马替尼600 mg/d较400 mg/d更有可能使患者在早期获得分子学反应。故建议选择氟马替尼600 mg/d作为临床起始剂量。而在安全性方面,有研究报道伊马替尼常见的实验室异常包括血液学毒性(主要是血小板减少和中性粒细胞减少)、肝功能异常、低血磷和高血糖等[13]。本试验中伊马替尼组有恶心、呕吐、水肿、肌肉抽缩、皮肤过敏以及头痛或腹泻等药物不良反应,而氟马替尼组常见的不良事件为剂量依赖性腹泻,程度均为Ⅰ~Ⅱ级,通常无需暂停用药,多数可自行缓解,少数需对症治疗。氟马替尼组未发生心脏和心血管系统不良事件,水肿的发生率低于伊马替尼组。
综上所述,氟马替尼可以安全有效地治疗新诊断的Ph+ CML,600 mg/d是一个较为合适的临床起始剂量。后续随访数据将会继续提供关于氟马替尼一线治疗的缓解持续时间、治疗耐药情况、不良反应等信息;将开展新的研究评价氟马替尼治疗Ph+ CML-CP、CML加速期和急变期的安全性和有效性。
无



























