
探讨急性早幼粒细胞白血病(APL)患者中高白细胞的发生率、临床特征及早期疗效。
回顾性分析初诊APL患者248例,其中高白细胞患者70例,分析高白细胞的发生率、临床特征及诱导治疗的疗效。非高白细胞APL的诱导治疗以全反式维甲酸联合三氧化二砷为主,高白细胞APL的诱导治疗以全反式维甲酸+三氧化二砷+蒽环类化疗药物为主,同时给予对症支持治疗。
248例患者中,高白细胞的发生率为28.2 %(70/248),其中WBC为10×109/L~ 50×109/L 46例(18.5 %),WBC>50×109/L且≤100×109/L 14例(5.6%),WBC>100×109/L 10例(4.0 %)。高白细胞APL患者的临床特征为PML-RARα融合基因S型(P=0.004)及FLT3-ITD基因突变(P<0.01),原发性纤溶亢进更加严重;诱导治疗完全缓解率低于非高白细胞APL患者[88.9 %(48/54)比98.1 %(152/155),P=0.013],早期死亡率高于非高白细胞患者[11.1 %(6/54)比1.9 %(3/155),P=0.013]。高白细胞患者的早期死亡原因主要为脑出血。
高白细胞是APL不良预后因素,诱导治疗应重视凝血异常的纠正、联合化疗迅速降低白细胞,以及联合地塞米松预防诱导分化综合征,以期降低早期死亡率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性早幼粒细胞白血病(APL)是一种特殊类型的急性髓系白血病,具有特异的细胞遗传学特征,伴有15号和17号染色体易位形成PML-RARα融合基因。其以出血及全血细胞减少为主要临床表现,仅有20%~25%的患者在初诊时外周血白细胞计数(WBC)>10×109/L,而初诊时外周血WBC >50×10 9/L的患者则少于5%[1]。既往的研究表明,初诊时高白细胞的APL患者常为PML-RARα融合基因S型、FLT3-ITD基因突变及CD56表达[2,3]。近年来,全反式维甲酸(ATRA)及三氧化二砷(As2O3)的应用明显降低了APL患者的早期死亡率,可使患者获得90 %以上的完全缓解(CR)率,长期生存率达85%以上[4]。尽管如此,初诊时外周血白细胞数量高仍是患者早期死亡率高的重要原因及独立的预后不良因素。本研究对70例初诊高白细胞APL患者的临床资料进行回顾性分析,探讨初诊高白细胞APL的发生率、临床特征及诱导治疗的疗效。
收集2009年1月至2015年5月我科收治的初诊APL患者248例,所有患者均经细胞形态学、免疫学、细胞遗传学和分子生物学(MICM)确诊[5],其中男性150例,女性98例,中位年龄40.5岁(13~82岁)。初诊时外周血WBC>10×109/L为高白细胞患者。
治疗前行血常规、凝血常规、骨髓及细胞化学染色、免疫分型、细胞遗传学及PML-RARα融合基因、FLT3基因突变、肝功能、肾功能等检查。从治疗开始到获得CR期间,每1~ 2 d查血常规、凝血常规,定期复查电解质、肝功能、肾功能、外周血涂片及骨髓象。治疗前所查项目异常者择期复查。
非高白细胞APL的诱导治疗以ATRA联合As2O3为主;高白细胞APL患者给予羟基脲预处理,诱导治疗以ATRA + As2O3 +蒽环类化疗药物为主。支持治疗主要保证血小板计数在30×109/L~ 50×109/L,纤维蛋白原(FBG)在1.5 g/L以上。对于初诊高白细胞及发生诱导分化综合征的患者,适当给予糖皮质激素治疗。合并感染者给予经验性抗生素治疗。
APL的疗效判断标准参照文献[5]。
采用SPSS 17.0软件进行统计学分析。计量资料符合正态分布,总体方差齐,以均数±标准差( ±s)表示,两组间比较采用独立样本t检验,否则采用非参数检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用独立样本t检验,否则采用非参数检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
在248例初诊APL患者中,初诊时外周血WBC> 10×109/L的患者70例,占28.2 %。其中WBC 10× 109/L~ 50×109/L 46例(18.5 %)、WBC>50×109/L且≤ 100 × 109/L 14例(5.6 %),WBC>100 × 109/L 10例(4.0 %)。
本组初诊时高白细胞APL患者的年龄较轻,男性多见,FBG降低的水平高于非高白细胞患者。高白细胞的患者常伴有PML-RARα融合基因S型(46.2 %比26.3 % ,P=0.004)及FLT3-ITD基因突变(31.1%比6.0 %,P<0.01)(表1)。
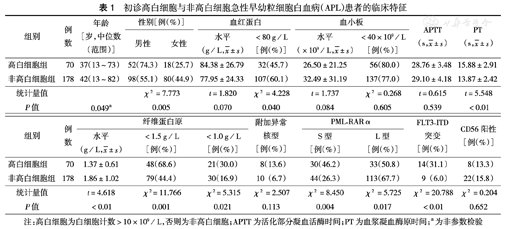
初诊高白细胞与非高白细胞急性早幼粒细胞白血病(APL)患者的临床特征
初诊高白细胞与非高白细胞急性早幼粒细胞白血病(APL)患者的临床特征
| 组别 | 例数 | 年龄[岁,中位数(范围)] | 性别[例(%)] | 血红蛋白 | 血小板 | APTT (s, ±s) ±s) | PT (s, ±s) ±s) | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | 水平(g/L, ±s) ±s) | <80 g/L [例(%)] | 水平(×109/L, ±s) ±s) | <40×109/L [例(%)] | |||||||
| 高白细胞组 | 70 | 37(13~73) | 52(74.3) | 18(25.7) | 84.38±26.79 | 32(45.7) | 26.50±21.25 | 56(80.0) | 28.76±3.48 | 15.88±2.91 | ||
| 非高白细胞组 | 178 | 42(13~82) | 98(55.1) | 80(44.9) | 77.95±24.33 | 107(60.1) | 32.49±31.19 | 137(77.0) | 29.10±4.18 | 13.87±2.42 | ||
| 统计量值 | χ2 =7.773 | t=1.820 | χ2 =4.228 | t=1.737 | χ2 =0.268 | t=0.615 | t=5.548 | |||||
| P值 | 0.049a | 0.005 | 0.070 | 0.040 | 0.084 | 0.605 | 0.539 | <0.01 | ||||
| 组别 | 例数 | 纤维蛋白原 | 附加异常核型[例(%)] | PML⁃RARα | FLT3⁃ITD突变[例(%)] | CD56阳性[例(%)] | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
水平(g/L, ±s) ±s) | <1.5 g/L [例(%)] | <1.0 g/L [例(%)] | S型[例(%)] | L型[例(%)] | |||||||
| 高白细胞组 | 70 | 1.37±0.61 | 48(68.6) | 21(30.0) | 8(13.6) | 30(46.2) | 33(50.8) | 14(31.1) | 8(13.3) | ||
| 非高白细胞组 | 178 | 1.86±1.02 | 79(44.4) | 30(16.9) | 10(6.7) | 44(26.3) | 113(67.7) | 9(6.0) | 22(15.8) | ||
| 统计量值 | t=4.618 | χ2=11.766 | χ2=5.315 | χ2 =2.507 | χ2 =8.450 | χ2 =5.725 | χ2 =20.788 | χ2 =0.204 | |||
| P值 | <0.01 | 0.001 | 0.021 | 0.113 | 0.004 | 0.017 | <0.01 | 0.652 | |||
注:高白细胞为白细胞计数>10×109/L,否则为非高白细胞;APTT为活化部分凝血活酶时间;PT为血浆凝血酶原时间;a为非参数检验
248例初诊APL患者中,39例放弃治疗,209例接受治疗,其中200例获得CR, CR率为95.7 %。初诊时高白细胞APL患者的CR率为88.9 %(48/54),低于非高白细胞患者的98.1 %(152/155),差异有统计学意义(P=0.013);达CR的时间分别为(25.73± 4.06)d和(26.57±4.85)d,差异无统计学意义(P= 0.279)。
在接受治疗的209例患者中,9例患者于诱导治疗过程中死亡,早期死亡率为4.3 %。进一步分析死亡原因,高白细胞APL患者中死亡6例,其中5例患者于7 d内死于脑出血,另1例患者死于晚期合并肺部感染,呼吸衰竭(表2)。初诊时高白细胞APL患者的早期死亡率为11.1 %(6/54),高于非高白细胞患者的1.9 %(3/155),差异有统计学意义(P=0.013)。
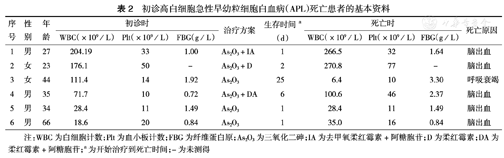
初诊高白细胞急性早幼粒细胞白血病(APL)死亡患者的基本资料
初诊高白细胞急性早幼粒细胞白血病(APL)死亡患者的基本资料
| 序号 | 性别 | 年龄 | 初诊时 | 治疗方案 | 生存时间a (d) | 死亡时 | 死亡原因 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| WBC(×109/L) | Plt(×109/L) | FBG(g/L) | WBC(×109/L) | Plt(×109/L) | FBG(g/L) | ||||||
| 1 | 男 | 27 | 204.19 | 33 | 1.00 | As2O3+IA | 1 | 266.5 | 32 | 1.64 | 脑出血 |
| 2 | 女 | 23 | 176.1 | 50 | - | As2O3+D | 2 | 270.8 | 77 | - | 脑出血 |
| 3 | 女 | 44 | 111.4 | 14 | 1.92 | As2O3 | 25 | 6.4 | 10 | 3.30 | 呼吸衰竭 |
| 4 | 男 | 35 | 71.7 | 10 | 0.72 | As2O3+DA | 6 | 100.6 | 46 | 2.37 | 脑出血 |
| 5 | 男 | 34 | 28.4 | 11 | 1.49 | As2O3 | 1 | 28.4 | 11 | 1.49 | 脑出血 |
| 6 | 男 | 66 | 18.6 | 20 | 0.84 | As2O3 | 1 | 35.0 | 16 | 0.84 | 脑出血 |
注:WBC为白细胞计数;Plt为血小板计数;FBG为纤维蛋白原;As2O3为三氧化二砷;IA为去甲氧柔红霉素+阿糖胞苷;D为柔红霉素;DA为柔红霉素+阿糖胞苷;a为开始治疗到死亡时间;-为未测得
本研究中初诊高白细胞APL占28.2 %,略高于既往报道的20%~25%[1]。同时,分布在WBC 10×109/L~ 50×109/L、WBC>50×109/L且≤100×109/L、WBC>100×109/L的患者分别占18.5 %、5.6%及4.0 %,与Kelaidi等[1]报道的22.6 %、6.1%及1.4 %相比,本研究中WBC>100×109/L的患者比例略高,国内尚鲜见此方面的报道。
本研究中初诊高白细胞APL患者的年龄较轻,FBG水平降低更明显,与既往的报道一致[1]。既往的研究显示,初诊高白细胞的APL患者FLT3-ITD基因突变阳性率高[2,6,7],且为PML-RARα融合基因S型[1],本研究得出的结论与此一致。此外,本研究发现248例患者中仅有1例患者于就诊时表现为弥散性血管内凝血(DIC),其他患者的活化部分凝血活酶时间(APTT)均在正常范围内,血浆凝血酶原时间(PT)延长>5 s者共计18例,FBG<2 g/L者共计170例,即多数患者仅有FBG的降低,而无APTT、PT的明显延长,提示APL所致的凝血功能紊乱主要与原发性纤溶亢进有关。这一结果也与国外的报道一致[8],而国内尚鲜见此方面的报道。本研究结果还显示高白细胞患者的FBG水平较非高白细胞患者低(P<0.01),FBG<1.0 g/L的患者更多,提示初诊白细胞越高,越易发生原发性纤溶亢进。
目前,高白细胞APL患者的早期死亡率可达10%~20 %[9],如考虑到未进入临床试验的患者,该数据可高达17%~29%[4]。早期死亡的主要原因包括致命性出血、诱导分化综合征及感染性休克,其中以出血最为常见。但若能获得CR,亦可长期生存。因此,如何降低高白细胞APL患者诱导治疗早期死亡率,是改善APL预后的关键。在大型临床试验APL 93[1]、LPA99[10]、APL2000[1]及LPA2005[10]中,高白细胞APL患者的早期死亡率分别为12.2 %、19 %、7.4%及17%。几项大型临床试验早期死亡率不同,考虑可能与初始诱导治疗方案的不同及相关的支持治疗有关。在LPA99及LPA2005试验中,高白细胞APL患者的诱导方案为ATRA联合蒽环类化疗药,而APL93及APL2000试验则在此基础上加用了标准剂量的阿糖胞苷。APL2000试验相较APL93,针对高白细胞患者采用了地塞米松(10 mg,每12 h 1次,至少3 d)预防诱导分化综合征,使早期死于诱导分化综合征的患者由APL93试验中的8例降至2例,从而降低了患者的早期死亡率。可见,对于高白细胞APL患者,可给予糖皮质激素防止诱导分化综合征的发生,从而降低患者早期死亡率。本研究中,高白细胞APL患者的早期死亡率为11.1 %,这一结果与APL93试验及国内的报道(10.9 %)[11]相近,低于LPA99及LPA2005试验,高于APL2000试验。分析早期死亡率较APL2000试验高的原因主要在于初诊时外周血WBC>50 × 109/L的患者。在APL2000中,所有高白细胞APL患者均采用ATRA+ DA方案化疗,且化疗开始于治疗第1天。而本研究WBC>50×109/L的患者中,15例在诱导治疗中加入化疗,其中单用蒽环类化疗药8例,联合标准剂量阿糖胞苷7例,加入化疗药的时间为(2.7±1.9)d。上述结果提示,针对初诊时外周血WBC>50×109/L的患者,应尽早开始蒽环类药物联合标准剂量阿糖胞苷的化疗。此外,临床试验将就诊时即为危重的患者排除在外,可能是本研究较APL2000试验早期死亡率高的另一原因。
在高白细胞APL患者中,5例患者于7 d内死于脑出血,其中1例入院时即表现为DIC,余4例FBG均<1.5 g/L,包括2例血小板计数<20×109/L。5例患者中3例于24 h内死亡。该5例患者从起病到就诊的中位时间为7 d,除1例因关节疼痛入院外,其余4例在入院时即有不同程度的出血倾向。上述结果提示,针对高白细胞APL患者,致命性出血的原因包括纤溶亢进、DIC及血小板减少,其中以原发性纤溶亢进为主要原因,及早就诊、及时输注机采血小板与FBG是降低早期致命性出血风险的关键。
综上所述,脑出血仍是APL患者早期死亡的首要原因,就诊时外周血WBC越高,其早期死亡风险越大,及时诊治尤为关键。对于高白细胞APL患者,特别是初诊时外周血WBC>50×109/L的患者,初次诱导治疗阶段在应用ATRA或As2O3的基础上,应尽早开始蒽环类药物联合标准剂量阿糖胞苷的化疗,同时应用激素防止分化综合征的发生,并及时辅以输注机采血小板、FBG等支持治疗,可能是降低患者早期死亡率的关键。
无



























