
分析老年急性淋巴细胞白血病(ALL)患者同非老年成年ALL患者临床特征及分子遗传学等方面的差异,进一步探讨老年ALL患者不良预后因子。
将收治的279例ALL患者分为老年组(60~79岁)及非老年组(14~59岁),分析两组患者的临床特征、实验室指标及相关基因IKZF1、PAX5、NOTCH1、PHF6、SH2B3、LEF1、JAK1的分子遗传学异常,并分析这些指标与临床预后的关系。
老年组男性患者比例低于非老年组[42.9%(21/49)比61.7%(142/230),P=0.015)。老年组B-ALL发生率、费城染色体阳性(Ph+)率及髓系标记CD33阳性率均明显高于非老年组[87.8%(43/49)比70.4%(162/230),P=0.009;47.8%(22/49)比27.4%(58/230),P=0.007;56.8%(21/49)比39.0%(64/230),P=0.049]。老年组ALL患者的淋巴结肿大发生率、总完全缓解(CR)率低于非老年组[20.0%(9/49)比38.9%(81/230),P=0.016;68.3%(28/41)比91.3%(178/195),P<0.001]。老年组ALL患者3、6、12、24个月总生存(OS)率均低于非老年组(64.6%比84.4%,P=0.001;50.0%比73.8%,P=0.001;29.2%比52.4%,P=0.003;6.2%比26.2%,P=0.003)。两组患者的PAX5、NOTCH1、PHF6、SH2B3、LEF1、JAK1基因突变率差异均无统计学意义(均P>0.05)。
老年ALL患者临床及实验室指标同非老年成年ALL患者存在差异,老年组预后更差,需要个体化治疗,以改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性淋巴细胞白血病(ALL)可发生于任何年龄阶段,是儿童白血病中最常见的一种。虽然目前儿童ALL的预后明显改善,但成年人ALL预后仍较差[1],而老年患者预后则更差。老年ALL具有不同于儿童及年轻成年人ALL的特点,其发病率在60岁达到另一个高峰[2]。本研究旨在分析老年ALL患者同非老年成年ALL患者在临床特征、实验室指标、基因分子遗传学异常等方面的差异,探讨这些指标对临床预后的影响,揭示老年ALL患者预后相对较差的可能原因,指导老年人ALL的个体化治疗。
2005年1月至2016年12月就诊于江苏省人民医院血液科的279例成年ALL患者,所有患者均经细胞形态学、免疫表型、细胞遗传学和分子生物学确诊和分型(世界卫生组织诊断标准2008)。其中老年(≥ 60岁)ALL 49例,中位年龄66岁(60~79岁),男性21例,女性28例;B-ALL 43例,T-ALL 5例,混合细胞白血病(mixed lineage leukemia,MLL)1例。非老年(<60岁)230例,中位年龄33岁(14~59岁),男性142例,女性88例;B-ALL 162例,T-ALL 64例,MLL 4例。患者治疗方案参见文献[3]。所有患者均签署知情同意书。
无菌条件下采集ALL患者的骨髓标本2 ml,收集于EDTAK2抗凝管中。DNA提取纯化采用旋转法,试剂盒为美国Qiagen公司QIAamp DNA Blood Mini Kit。染色体核型描述依据《人类细胞遗传学国际命名体制(ISCN)2005》。荧光原位杂交(FISH)探针采用美国Vysis公司的bcr-abl双色双融合DNA探针,bcr、abl探针均用Spectrum Green标记。具体方法及费城染色体阳性(Ph+)细胞的确定标准见文献[4]。所用直标单克隆抗体和破膜剂购自美国BD公司,多参数流式细胞仪(FACS Calibur型)购自美国BD公司。凝胶成像系统购自美国Bio Rad公司。
检测以下基因外显子(exon)的突变情况:LEF1 (exon2~3)[5]、PAX5(exon2~10)[6]、NOTCH1 (exon26~28、34)[7]、PHF6(exon2~10)[8]、JAK1 (exon13、14、16~19)[9]、CRLF2(exon1~6)[10]、SH2B3(exon1~7)[11]以及IKZF1基因exon3-6缺失产物Ikaros6(IK6)的发生情况[12]。聚合酶链反应(PCR)产物经1.5%琼脂糖凝胶电泳鉴定条带后由北京六合华大基因科技股份有限公司上海分公司及伯津生物技术(上海)有限公司直接测序或克隆后测序。
采用SPSS 20.0统计学软件。计数资料采用χ2检验或Fisher确切概率法进行组间比较;计量资料属非正态分布,以中位数(范围)表示,采用非参数Mann-Whitney检验进行差异分析;生存分析采用Kaplan-Meier法,生存率比较用Log-rank检验;危险因素分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
279例成年ALL患者中,老年组患者男性比例低于非老年组,B-ALL比例、Ph+率均高于非老年组,差异均有统计学意义(均P<0.05)(表1)。将ALL患者分为三个年龄组,其中<35岁、35~59岁、≥60岁年龄组Ph+率分别为18.4%(19/103)、35.8%(39/109)和47.8%(22/46)(P=0.001)。80例成年Ph+ ALL患者中,经FISH技术得到的Ph+的检出率为97.1%(68/70),常规遗传学技术检出率为64.4% (47/73)。在同时利用两种技术检测的62例患者中,有20例(32.2%)经常规遗传学技术未能检出Ph染色体,而FISH技术检测为Ph+ALL。老年组髓系标记CD33阳性率高于非老年组(P=0.049);非老年组淋巴结肿大发生率较高(P=0.016);初诊时白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(Plt)及骨髓原始细胞计数、乳酸脱氢酶(LDH)水平、复杂核型发生率、髓系标记CD13及干细胞表达标记CD34阳性率在两组间差异均无统计学意义(P>0.05)(表1)。
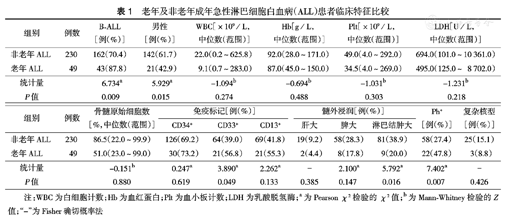
老年及非老年成年急性淋巴细胞白血病(ALL)患者临床特征比较
老年及非老年成年急性淋巴细胞白血病(ALL)患者临床特征比较
| 组别 | 例数 | B-ALL [例(%)] | 男性[例(%)] | WBC[×109/L,中位数(范围)] | Hb[g/L,中位数(范围)] | Plt[×109/L,中位数(范围)] | LDH[U/L,中位数(范围)] |
|---|---|---|---|---|---|---|---|
| 非老年ALL | 230 | 162(70.4) | 142(61.7) | 22.0(0.2~625.8) | 92.0(28.0~171.0) | 49.0(4.0~292.0) | 694.0(101.0~10 361.0) |
| 老年ALL | 49 | 43(87.8) | 21(42.9) | 9.1(0.7~283.0) | 87.0(45.0~150.0) | 34.5(4.0~269.0) | 495.0(125.0~8 702.0) |
| 统计量 | 6.734a | 5.929a | -1.094b | -0.694b | -1.031b | -1.231b | |
| P值 | 0.009 | 0.015 | 0.274 | 0.488 | 0.303 | 0.218 |
| 组别 | 例数 | 骨髓原始细胞数[%,中位数(范围)] | 免疫标记[例(%)] | 髓外浸润[例(%)] | Ph+ [例(%)] | 复杂核型[例(%)] | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| CD34+ | CD33+ | CD13+ | 肝大 | 脾大 | 淋巴结肿大 | |||||
| 非老年ALL | 230 | 86.5(22.0~99.9) | 126(69.2) | 64(39.0) | 69(41.8) | 19(9.2) | 58(28.3) | 81(38.9) | 58(27.4) | 25(15.1) |
| 老年ALL | 49 | 51.0(23.0~99.0) | 30(73.2) | 21(56.8) | 21(55.3) | 2(4.4) | 8(17.8) | 9(20.0) | 22(47.8) | 3(8.8) |
| 统计量 | -0.151b | 0.247a | 3.890a | 2.262a | - | 2.100a | 5.792a | 7.402a | - | |
| P值 | 0.880 | 0.619 | 0.049 | 0.133 | 0.385 | 0.147 | 0.016 | 0.007 | 0.426 | |
注:WBC为白细胞计数;Hb为血红蛋白;Plt为血小板计数;LDH为乳酸脱氢酶;a为Pearson χ2检验的χ2值;b为Mann-Whitney检验的Z值;"-"为Fisher确切概率法
纳入本研究分析的相关基因突变均为错义突变,包含国际上已经报道及未报道的突变,某些基因突变可见于不同ALL患者。T-ALL、B-ALL中均检测到的突变基因包括LEF1、CRLF2、SH2B3。PAX5突变及IK6仅出现在B-ALL中,JAK1、NOTCH1和PHF6突变仅于T-ALL及MLL中发现。在老年组及非老年组间这些基因遗传学异常发生率差异无统计学意义(P>0.05)(表2)。
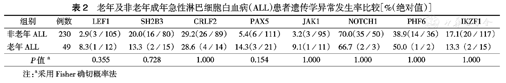
老年及非老年成年急性淋巴细胞白血病(ALL)患者遗传学异常发生率比较[%(绝对值)]
老年及非老年成年急性淋巴细胞白血病(ALL)患者遗传学异常发生率比较[%(绝对值)]
| 组别 | 例数 | LEF1 | SH2B3 | CRLF2 | PAX5 | JAK1 | NOTCH1 | PHF6 | IKZF1 |
|---|---|---|---|---|---|---|---|---|---|
| 非老年ALL | 230 | 2.9(3/105) | 20.0(16/80) | 29.2(26/89) | 5.4(6/111) | 3.2(3/95) | 70.0(35/50) | 38.9(14/36) | 17.1(20/117) |
| 老年ALL | 49 | 8.3(1/12) | 13.3(2/15) | 28.6(4/14) | 14.3(3/21) | 9.1(1/11) | 66.7(2/3) | 50.0(1/2) | 13.3(2/15) |
| P值a | 0.355 | 0.728 | 1.000 | 0.154 | 1.000 | 1.000 | 1.000 | 1.000 |
注:a采用Fisher确切概率法
IKZF1基因exon3~6的缺失产物IK6发生率在成年Ph-ALL患者中低于Ph+ALL患者[8.0%(7/87)比34.9%(15/43),P<0.001],在17例同时检测IK6及Ph的老年ALL患者中,7例Ph-患者均未检测到IK6,10例Ph+患者中2例IK6+,此2例老年患者初诊时WBC均高(211.7×109/L和140.0×109/L),其总生存(OS)时间分别为2、8个月。PAX5突变仅存在于B-ALL患者中。本组B-ALL中,老年组的PAX5突变率高于非老年组,但差异无统计学意义[14.3%(3/21)比6.7%(6/90),P=0.367)。老年组有3例PAX5突变,其中1例PAX5突变合并CRLF2及SH2B3突变(表3),该患者首次诱导化疗未达完全缓解(CR),经多种化疗方案治疗后仍未达到CR,OS时间为13个月。
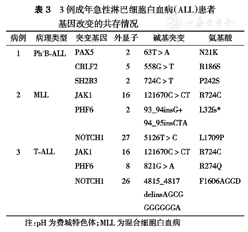
3例成年急性淋巴细胞白血病(ALL)患者基因改变的共存情况
3例成年急性淋巴细胞白血病(ALL)患者基因改变的共存情况
| 病例 | 病理类型 | 突变基因 | 外显子 | 碱基突变 | 氨基酸 |
|---|---|---|---|---|---|
| 1 | Ph-B-ALL | PAX5 | 2 | 63T>A | N21K |
| CRLF2 | 5 | 558G>T | R186S | ||
| SH2B3 | 2 | 724C>T | P242S | ||
| 2 | MLL | JAK1 | 16 | 121670C>CT | R724C |
| PHF6 | 2 | 93_94insG+ 94_95insCTA | L32fs* | ||
| NOTCH1 | 27 | 5126T>C | L1709P | ||
| 3 | T-ALL | JAK1 | 16 | 121670C>CT | R724C |
| PHF6 | 8 | 821G>A | R274Q | ||
| NOTCH1 | 26 | 4815_4817 delinsAGCG GGGGGGA | F1606AGG D |
注:pH为费城特色体;MLL为混合细胞白血病
NOTCH1、PHF6、JAK1是成年人T-ALL重要的遗传学异常发生的基因。本组患者中NOTCH1突变率69.8%(37/53),PHF6突变率39.5%(15/38),JAK1突变率3.8%(4/105)。存在NOTCH1突变的37例患者中有12例(32.4%)同时伴有PHF6突变,4例(10.8%)同时伴有JAK1突变;2例(5.4%)患者同时存在3种基因突变(表3),病例2、3采用标准方案治疗后均未达CR,OS时间分别为5、12个月。
老年组总CR率低于非老年组(P<0.05)。老年组3、6、12、24个月OS率均低于非老年组(均P< 0.05)(表4)。老年患者中位OS时间较短(13个月比18个月,P=0.016)(图1A)。两组患者的无事件生存(EFS)时间及无复发生存(RFS)时间差异无统计学意义(10个月比10个月,P=0.394;13个月比15个月,P=0.586)(图1B、图1C)。分析80例成年Ph+ALL患者治疗情况,其中48例治疗过程中加用酪氨酸激酶抑制剂(TKI)治疗,加用TKI的患者中位OS时间更长,差异有统计学意义(31个月比16个月,P=0.002)(图2A)。但老年Ph+ALL患者加用TKI治疗的16例患者OS未见明显延长(13.5个月比20.0个月,P=0.366)(图2B)。
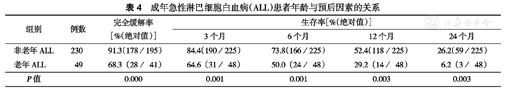
成年急性淋巴细胞白血病(ALL)患者年龄与预后因素的关系
成年急性淋巴细胞白血病(ALL)患者年龄与预后因素的关系
| 组别 | 例数 | 完全缓解率[%(绝对值)] | 生存率[%(绝对值)] | |||
|---|---|---|---|---|---|---|
| 3个月 | 6个月 | 12个月 | 24个月 | |||
| 非老年ALL | 230 | 91.3(178/195) | 84.4(190/225) | 73.8(166/225) | 52.4(118/225) | 26.2(59/225) |
| 老年ALL | 49 | 68.3(28/41) | 64.6(31/48) | 50.0(24/48) | 29.2(14/48) | 6.2(3/48) |
| P值 | 0.000 | 0.001 | 0.001 | 0.003 | 0.003 | |
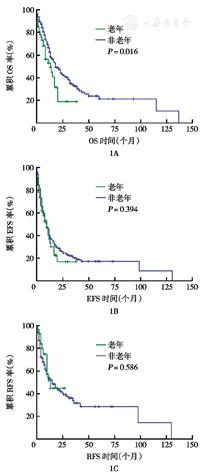

1A:总生存(OS)曲线;1B:无事件生存(EFS)曲线;1C:无复发生存(RFS)曲线;老年为≥60岁;非老年为<60岁
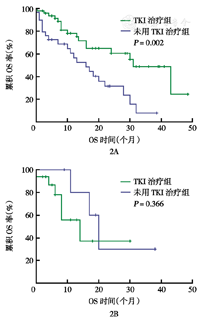

2A:成年Ph+ALL患者;2B:老年Ph+ALL患者;OS:总生存;Ph+:费城染色体阳性
对279例成年ALL患者进行单因素分析,发现初诊时LDH、Plt、CD34阳性率、年龄≥60岁以及首次诱导治疗后CR是影响预后的因素,进一步行多因素Cox回归分析显示,初诊时Plt≥100×109/L和首次诱导治疗后CR是有利的独立预后因素(表5)。
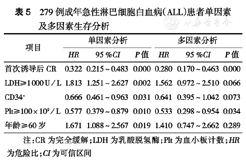
279例成年急性淋巴细胞白血病(ALL)患者单因素及多因素生存分析
279例成年急性淋巴细胞白血病(ALL)患者单因素及多因素生存分析
| 项目 | 单因素分析 | 多因素分析 | ||||
|---|---|---|---|---|---|---|
| HR | 95 %CI | P值 | HR | 95 %CI | P值 | |
| 首次诱导后CR | 0.322 | 0.215~0.483 | 0.000 | 0.280 | 0.170~0.463 | 0.000 |
| LDH≥1 000 U/L | 1.813 | 1.251~2.627 | 0.002 | 1.562 | 0.972~2.510 | 0.066 |
| CD34+ | 0.666 | 0.461~0.963 | 0.031 | 0.641 | 0.395~1.042 | 0.073 |
| Plt≥100×109/L | 0.577 | 0.379~0.879 | 0.010 | 0.533 | 0.298~0.954 | 0.034 |
| 年龄≥60岁 | 1.671 | 1.088~2.567 | 0.019 | 1.410 | 0.747~2.662 | 0.289 |
注:CR为完全缓解;LDH为乳酸脱氢酶;Plt为血小板计数;HR为危险比;CI为可信区间
ALL多发于儿童,在2~5岁为发病高峰[13],成年人在60岁有一发病高峰[2]。同儿童ALL相比,成年人ALL预后较差,而不论以55岁还是60岁为界划分老年ALL患者,老年ALL患者预后均更差[14,15,16]。
本研究老年组男性所占比例低于非老年组。Sive等[14]未发现性别分布在不同年龄组间存在差异。Shin等[17]发现老年组ALL中男性比例高于女性。美国一项关于老年B-ALL的OS与预后关系的回顾性研究中老年组男性患者多于女性[15]。Sive等[14]亦发现淋巴结肿大在老年组发生率低于非老年组,同本研究的结果相近,不同的是Sive等[14]同时发现肝大及脾大在老年组的发生率明显低于非老年组,而本研究未得出类似结论。
Ph染色体是9号染色体和22号染色体易位所致,几乎出现于所有的慢性粒细胞白血病中,ALL中也可出现,但几乎全部出现于B-ALL中[4],同本研究观察到的结果一致。Ph+是目前公认的预后不良因素[14,18]。Ph+率随年龄增长而增加,在老年ALL人群中发生率较高。国外报道60岁以上ALL患者Ph+率大于50%[19]。本研究中的老年患者Ph+率同国外报道相近。此外,Ph+ALL检出率在不同方法间有差异,FISH技术对Ph染色体的检出率优于常规遗传学技术,需加强对FISH技术的重视及应用,以作出精准诊断,利于精准治疗。
Ph染色体是ALL中频繁出现的再现性细胞遗传学异常,且常常伴有IK6等其他遗传学改变。Lin等[20]发现IK6在Ph+ALL的发生率近50%,与不良预后相关。我们既往研究发现IK6发生率在成年Ph-ALL患者中显著低于Ph+ALL患者[12]。49例老年患者中仅检测出2例IK6突变,均为Ph+ALL患者,两者的预后均不佳。PAX5是唯一在造血组织表达的PAX家族成员,本组患者中检测到的9例PAX5突变均为点突变,均发生于Ph-B-ALL。NOTCH1是T-ALL较为常见的突变[7,21,22],本组患者中NOTCH1突变率为69.8%,且发现部分伴有PHF6和JAK1突变,可能与T-ALL患者的不良预后相关。本中心既往研究发现两种基因突变共存组相较非突变共存组的患者EFS明显缩短[22]。本研究中2例患者同时存在NOTCH1、PHF6和JAK1三种基因突变,预后差。鉴于本研究为回顾性研究,相关基因突变的检测未能在全部患者中完成,有待进行前瞻性研究,进一步明确相关遗传学改变在老年与非老年ALL患者间的差异。
与非老年ALL相比,老年ALL患者的整体预后较差[13,14,15,23]。除以上不良预后因素外,不同化疗方案亦会带来不同的治疗效果。有研究认为年轻成年ALL患者采用儿童化疗方案可取得较好的疗效[24],但对于老年患者如何选择合适的治疗方案仍是治疗难点。
对于Ph+ALL患者,TKI联合传统化疗药物已取得较好疗效[19,25,26,27]。本研究中Ph+ALL接受TKI治疗的患者获得了更长的OS,然而本研究未显示老年Ph+ALL患者加用TKI可使OS延长,有待更大样本的长期随访。
值得注意的是,近年发现Ph-ALL中有一类Ph样ALL(Ph-like ALL),其预后差,应将其从Ph-ALL中筛选出来。Ph-样ALL与本组研究中涉及的IKZF1、CRLF2、PAX5等基因的遗传学和分子生物学异常相关,早期筛选出该类高危亚型有助于指导临床应用TKI及其他新型靶向药物治疗[28]。
总之,老年ALL患者具有独特的临床及实验室检查特征,探讨这些特征对临床预后的影响有助于揭示老年ALL患者预后较差的可能原因,指导临床老年ALL的个体化治疗,改善患者生存情况。
无



























