
观察DA-EPOCH-R方案治疗B细胞非霍奇金淋巴瘤(NHL)的效果及安全性。
采用DA-EPOCH-R方案治疗43例B细胞NHL患者,观察近期疗效、不良反应,进行随访,分析生存情况。
43例NHL患者共接受203个疗程化疗,中位化疗6个(2~8个)疗程。32例(74.4 %)化疗2~4个疗程后达完全缓解(CR)。年龄≤60岁与>60岁、Ⅰ~Ⅱ期与Ⅲ~Ⅳ期、生发中心来源(GCB)型与非GCB型、双表型与非双表型患者CR率差异均无统计学意义(均P>0.05)。中位随访40个月(9~62个月),1、3年总生存率分别为97.6 %、92.8 %。不良反应为血液学不良反应,化疗结束后的随访期内未见严重不良反应,未出现继发性第二肿瘤。
DA-EPOCH-R方案治疗B细胞NHL CR率较高,Ⅲ、Ⅳ期患者的疗效与Ⅰ、Ⅱ期相近,老年患者耐受性良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤(NHL)中最常见类型,CHOP方案治疗DLBCL的最大问题是国际预后指数(IPI)>2分的年轻患者不能从中获益。R-CHOP方案使B细胞NHL的完全缓解(CR)率及长期生存率得到提高,但对于高危DLBCL患者、年轻高危NHL患者疗效仍不理想。研究发现长春新碱、依托泊苷和多柔比星等低浓度、长时间作用后,对肿瘤细胞的杀伤作用更强,1993年根据此理论由Wilson等[1]最早报道了EPOCH方案,并由Gutierrez等[2]于2000年发表其8年随访结果,表明无论低危还是高危患者,均可从EPOCH方案中获益,Gutierrez等[3]进一步于2001年报道了抗CD20单抗联合调整剂量的EPOCH方案(DA-EPOCH-R)的效果。多项研究表明,DA-EPOCH-R方案的应用能显著提高B细胞NHL患者的CR率及长期生存率。我们对采用DA-EPOCH-R方案治疗的43例B细胞NHL患者进行分析,评估该方案的有效性及安全性。
回顾性分析2011年1月至2016年6月于山东大学附属济南市中心医院血液内科就诊并确诊的102例B细胞NHL患者资料,其中43例应用DA-EPOCH-R方案治疗。43例患者中位年龄54岁(25~79岁),其中男性24例,女性19例;DLBCL 27例,套细胞淋巴瘤(MCL)5例,滤泡型淋巴瘤11例。年龄≤60岁26例,>60岁17例。Ann Arbor分期Ⅰ~Ⅱ期10例,Ⅲ~Ⅳ期33例。乳酸脱氢酶(LDH)正常15例,升高28例。IPI评分0~2分12例,3~5分31例。27例DLBCL患者中,生发中心B细胞样(GCB)型15例,非GCB(non-GCB)型12例。所有27例DLBCL患者均应用免疫组织化学检测CD10、bcl-6、MUM-1、myc、bcl-2,cut-off值为myc 40 %、bcl-2 50 %,myc及bcl-2免疫表型阳性的双表达型淋巴瘤(double expression lymphoma,DEL)患者7例。
患者采用DA-EPOCH-R方案治疗,具体方法为:利妥昔单抗每天375 mg/m2第1天;依托泊苷每天50 mg/m2、多柔比星每天10 mg/m2、长春地辛每天0.75 mg/m2,持续静脉滴注第2天至第5天;环磷酰胺每天750 mg/m2,第6天。泼尼松每天60 mg/m2,分2次口服,第2天至第6天;每21 d为1个疗程,每个疗程化疗前要求外周血中性粒细胞绝对数(ANC)>1.0×109/L,血小板计数>100×109/L。化疗结束后每周2次监测外周血象,每周1~2次检测血生化。若ANC<1.0×109/L,则给予重组人粒细胞集落刺激因子升高白细胞;粒细胞缺乏7 d以上时,则给予抗感染药物预防感染。重度贫血[血红蛋白(Hb)<60 g/L]时输注去白细胞悬浮红细胞,老年患者Hb<80 g/L时,可考虑输注红细胞;血小板计数<20×109/L时,输注血小板预防出血。剂量调整:化疗后若未出现中性粒细胞缺乏(ANC<0.5×109/L),下一个疗程将依托泊苷、多柔比星及环磷酰胺剂量增加20 %;若中性粒细胞缺乏短于7 d,下一个疗程维持原剂量;若中性粒细胞缺乏超过10 d,则下一个疗程将环磷酰胺剂量减低20 %;长春地辛则根据是否出现神经毒性而调整剂量,若出现2级或3级运动神经损伤,剂量降低25 %~50 %,出现3级感觉神经损伤,剂量降低50 %。
根据国际工作组(IWG)疗效评定标准,将疾病的治疗效果分为CR、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),有效率以CR+PR计算。不良反应方面,主要观察与化疗药物相关的反应,包括发热、寒战、支气管痉挛等;血液学毒性:在每个疗程后开始监测外周血细胞计数、生化指标等变化,直到外周血细胞开始自主上升;非血液学毒性:主要观察患者的感染性事件,心脏毒性,肝、肾毒性。根据世界卫生组织(WHO)标准分析不良反应。
随访从2011年7月1日至2016年6月30日,采用电话随访和患者定期返院复查两种方式,观察患者的复发及死亡情况。
应用SPSS 18.0软件进行统计学分析,采用χ2检验进行CR率及不良反应发生率的比较,采用Kaplan-Meier法进行生存分析,用Log-rank法比较生存率的差异,以P<0.05为差异有统计学意义。
43例患者均可评价疗效,共进行203个疗程,中位化疗6个(2~8个)疗程。2~4个疗程后评估疗效,32例(74.4 %)达CR,5例(11.6 %)PR,总有效率为86.0 %(37/43)。27例DLBCL患者中,CR 21例(77.8 %);7例双表达型DLBCL患者中,化疗后5例获得CR,1例获得PR,总有效率85.7 %(6/7);20例无myc与bcl-2表达的DLBCL患者中,16例(80.0 %)获得CR,1例(5.0 %)获得PR,总有效率为85.0 %(17/20)。年龄≤60岁[76.9 %(20/26)比70.6 %(12/17),χ2=0.012,P=0.914]、Ⅰ~Ⅱ期[80.0 %(8/10)比72.7 %(24/33),χ2=0.002,P=0.962]、IPI评分0~2分[75.0 %(9/12)比74.2 %(23/31),χ2=0.112,P=0.743]、GCB型DLBCL患者[86.7 %(13/15)比66.7 %(8/12),χ2=0.603,P=0.438]及非双表达型DLBCL患者[71.4 %(5/7)比80.0 %(16/20),χ2=0.003,P>0.05]CR率均较对应患者高,但差异均无统计学意义。
所有入组患者均可进行不良反应评估。化疗期间主要的不良反应为血液学相关毒性反应,其中较为严重的为中性粒细胞减少,203个疗程中共124个(61.1 %)疗程发生粒细胞减少,持续2~13 d,Ⅲ~Ⅳ度中性粒细胞减少发生率为30.0 %(61个疗程),一般发生在化疗结束7~14 d。其他不良反应,如消化道反应(恶心、呕吐等)、呼吸道症状(如咳嗽、咳痰及肺部感染)少见或轻微,未出现严重心脏、肝脏及肾脏毒性(表1)。化疗结束后,左心室射血分数降低率0~5 %,无化疗相关死亡。1例患者末次化疗结束后第2年复发,颅内浸润死亡;1例因疾病进展,死于噬血细胞综合征。化疗结束后的随访期内未见严重不良反应发生,且截至随访结束,未出现继发性第二肿瘤,提示DA-EPOCH-R方案的安全性较好。
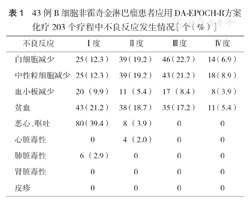
43例B细胞非霍奇金淋巴瘤患者应用DA-EPOCH-R方案化疗203个疗程中不良反应发生情况[个(%)]
43例B细胞非霍奇金淋巴瘤患者应用DA-EPOCH-R方案化疗203个疗程中不良反应发生情况[个(%)]
| 不良反应 | Ⅰ度 | Ⅱ度 | Ⅲ度 | Ⅳ度 |
|---|---|---|---|---|
| 白细胞减少 | 25(12.3) | 39(19.2) | 46(22.7) | 14(6.9) |
| 中性粒细胞减少 | 25(12.3) | 39(19.2) | 43(21.2) | 18(8.9) |
| 血小板减少 | 20(9.9) | 11(5.4) | 17(8.4) | 8(3.9) |
| 贫血 | 43(21.2) | 38(18.7) | 35(17.2) | 11(5.4) |
| 恶心、呕吐 | 80(39.4) | 8(3.9) | 0 | 0 |
| 心脏毒性 | 0 | 4(2.0) | 0 | 0 |
| 肺脏毒性 | 6(2.9) | 0 | 0 | 0 |
| 肾脏毒性 | 0 | 0 | 0 | 0 |
| 皮疹 | 0 | 0 | 0 | 0 |
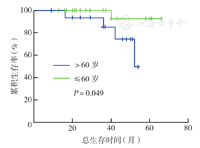
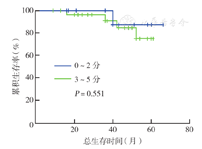
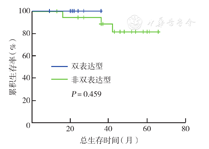
43例患者中位随访40个月(9~62个月)。截至最终随访时间,37例(86.0 %)生存,其中24例DLBCL,4例MCL,10例滤泡型淋巴瘤;1、3年总生存率分别为97.6 %、92.8 %。27例DLBCL患者中位随访37个月(9~62个月),1、3、5年总生存率分别为100.0 %、94.4 %、85.7 %。双表达型DLBCL患者中位随访22个月(9~36个月),1年总生存率为100.0 %,仍需长期随访。采用Kaplan-Meier法分析显示,年龄≤60岁患者总生存优于>60岁患者,差异有统计学意义(P=0.049)(图1),IPI评分低危+低中危(0~2分)患者总生存率高于中高危+高危(0~5分)患者,但差异无统计学意义(P=0.551)(图2),DLBCL双表达型与非双表达型患者总生存率差异无统计学意义(P=0.459)(图3)。



DLBCL发病率占NHL 40 %~50 %[4,5]。R-CHOP方案一直被认为是治疗DLBCL的标准一线方案[6],但仍有40 %左右的患者不能获得长期生存。2002年Wilson等[7]采用DA-EPOCH方案治疗50例初治大B细胞淋巴瘤,结果显示CR率为92 %,中位随访62个月,无进展生存(PFS)率和总生存率分别为70 %和73 %。单用DA-EPOCH方案治疗大B细胞淋巴瘤CR后25 %患者复发,且2/3的患者在缓解后的第一年内复发[7]。进一步研究发现,DA-EPOCH-R方案治疗大B细胞淋巴瘤能显著提高患者的长期生存率。Wilson等[8]采用DA-EPOCH-R方案治疗38例初治及复发难治的大B细胞淋巴瘤患者,初治23例中17例(85 %)获得CR,随访12个月,其PFS率和总生存率分别为85 %和79 %,CR后无复发病例;复发难治的15例中14例可评价疗效,9例获得CR。本组43例患者均为初治B细胞NHL,其中DLBCL 27例,21例达CR,CR率为77.8 %,比Wilson等[7,8]所报道的CR率低,可能与本组病例较少有关。
双打击淋巴瘤(DHL)存在myc基因易位,myc基因重排者不能从R-CHOP方案中获益[9,10,11]。myc和bcl-2同时表达能导致不良预后[12]。美国MD Anderson癌症中心报道了129例DHL患者,比较了R-CHOP、R-EPOCH及R-HyperCVAD/MA方案治疗后CR率及随访结果,发现R-EPOCH方案组患者CR率与R-HyperCVAD相当,均为68 %,均高于R-CHOP方案(40 %),应用R-EPOCH的患者2年PFS率最高,为67 %[13]。本组未行基因检测,通过免疫表型检测,7例为双表达型DLBCL,其中5例获得CR,初步结果提示DA-EPOCH-R方案对DEL有较好的疗效。
对于老年淋巴瘤患者,受心脏功能的影响,通常采用减低剂量的CHOP方案,但剂量减低后患者的CR率和总生存受到影响,而持续每日静脉滴注小剂量多柔比星对心脏功能影响较小。对于左心室功能不全或减低的患者,国外权威指南推荐应用DA-EPOCH-R方案。本组病例中,17例>60岁的患者应用该方案治疗后,CR率为64.7 %,并且无心脏不良事件的发生,各疗程结束后评估心脏功能,左心室射血分数减低小于5 %。
本组病例中,27例DLBCL患者1、3、5年总生存率分别为100.0 %、94.4 %、85.7 %,7例双表达型DLBCL患者1年总生存率为100.0 %,仍需进一步随访。应用本方案过程中,未出现化疗相关死亡,并且至随访截止日期,未出现继发第二肿瘤病例,提示本方案的安全性及耐受性较好。
本研究显示,DA-EPOCH-R方案是NHL的一个有效且安全的化疗方案,其对中高危、高危患者及老年患者均疗效显著,CR率高,安全性好,对DEL患者CR率亦较高,远期疗效需进一步随访观察。
无



























