
提高对Castleman病合并滤泡树突细胞肉瘤伴闭塞性细支气管炎的诊疗水平。
回顾性分析1例Castleman病合并滤泡树突细胞肉瘤伴闭塞性细支气管炎患者的临床资料,并复习相关文献。
该例患者为中年女性,因全身皮疹、口腔溃疡2周入院,诊断为Castleman病合并滤泡树突细胞肉瘤,经手术切除、联合化疗后病情一度改善,最终因伴闭塞性细支气管炎而死亡。
Castleman病合并滤泡树突细胞肉瘤伴闭塞性细支气管炎临床罕见,预后极差。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Castleman病(CD)是一类非肿瘤性淋巴组织增生性疾病,临床上分为局灶型CD(UCD)和多中心型CD(MCD)。滤泡树突细胞肉瘤(FDCS)是来源于树突细胞的一类非霍奇金淋巴瘤,可由CD转化而来。CD合并FDCS同时伴发副肿瘤天疱疮(PNP)和闭塞性细支气管炎(OB)临床罕见,预后极差。我们报道1例MCD合并FDCS伴PNP相关性OB患者,并复习相关文献。
患者,女性,45岁,因全身皮疹、口腔溃疡2周入院,主要表现为全身多处皮肤暗红色斑丘疹、瘙痒,口腔多发溃疡,伴乏力,无发热、盗汗及消瘦。查体:口唇黏膜溃疡,其上见血痂覆盖,扁桃体不大,肝肋缘下2 cm,脾肋缘下1 cm。血常规示:白细胞计数(WBC)8.68×109/L,血红蛋白(Hb)144 g/L,血小板计数(Plt)312×109/L。血生化示:白蛋白25.7 g/L,乳酸脱氢酶254 U/L,β2微球蛋白、球蛋白、肝肾功能及电解质等正常;红细胞沉降率27 mm/1 h;血清蛋白电泳及免疫固定电泳未发现异常条带。术前传染病筛查和EB病毒DNA均阴性。左前臂病变皮肤活组织检查:表皮基底细胞广泛液化变性,真皮乳头组织疏松,密集淋巴细胞、组织细胞浸润,提示PNP。全腹CT示:左侧腹膜后包块,双侧腋窝及腹膜后淋巴结肿大(图1A)。腹部B型超声示:左中下腹探及低回声团块,考虑肿物为肾上腺来源。收入泌尿外科行腹部包块切除术,肉眼观察肿物呈结节状,大小7.8 cm×5.5 cm×9.2 cm,薄膜完整,切面灰白色,质地中等;显微镜下可见淋巴组织增生,淋巴滤泡形成,其中小血管增生,血管壁增厚伴透明变性(图1B)。滤泡间见大量梭形细胞,呈束状、席纹状排列;细胞边界不清,呈合体状;胞质较丰富,呈嗜酸性;核呈卵圆形或圆形;核质呈颗粒状,嗜碱性(图1C)。免疫组织化学示:淋巴细胞CD3+、梭形细胞CD21+、CD23+、vimentin+、CD68+、SAM+、S-100+、bcl-2+、CK-、CD117-、desmin-,Ki-67阳性率10%~15%。符合CD合并FDCS。遂转入血液科,采用CHOP方案化疗,皮疹消退,口腔黏膜溃疡愈合。第4个周期化疗结束后,患者突发憋闷、气促,伴发热,无咳嗽、咳痰。查体:体温波动于37.8~38.9 ℃,左肺呼吸音降低,偶可闻及少许哮鸣音。血气分析:pH值7.41,PO2 68 mmHg(1 mmHg=0.133 kPa),PCO2 33 mmHg(吸氧4 L/min时),提示低氧血症,降钙素原及C反应蛋白正常,多次G试验及血培养阴性。肺功能检测示:重度阻塞性通气障碍(FEV1% pre:45%,FEV1/FVC:38%),弥散功能正常,支气管扩张试验阴性。胸部CT示:左肺密度不均匀,呈马赛克样分布,肺中叶支气管扩张(图1D)。经呼吸科及重症监护室(ICU)会诊后诊断为OB,予以大剂量糖皮质激素、吸入激素、扩张支气管等治疗后,呼吸困难进行性加重,治疗46 d后因呼吸衰竭死亡。
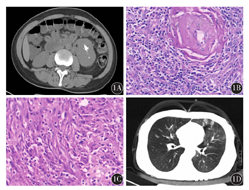

1A:腹部CT示腹膜后见低密度包块,边界清楚,其中见辐射状钙化影;1B:腹膜后肿物淋巴组织增生,其中见透明样变小血管 HE ×200;1C:腹膜后肿物滤泡间呈束状或席纹状分布的梭形细胞 HE ×200;1D:胸部CT示左肺见不均匀斑片状低密度影,呈马赛克样分布,并见支气管扩张
CD又名血管滤泡性淋巴结增生、巨大淋巴结病,组织学分型为透明血管型CD(HVCD)、浆细胞型及混合型。CD临床罕见,误诊率高,美国大数据显示CD的发病率为21/100万~25/100万[1],因此其发病机制尚不明了。许多学者认为其可能与人类免疫缺陷病毒(HIV)、人疱疹病毒8(HHV8)或EB病毒感染所致体内细胞因子及血管内皮因子调节异常有关。
在少数病例中,HVCD被认为是FDCS的诱因,是肿瘤进展的表现[2]。2015年美国国立综合癌症网络(NCCN)发布的非霍奇金淋巴瘤指南首次包括了CD,认为CD的诊断依赖组织病理学及免疫表型,免疫分型表达非特异性淋巴细胞系抗原如κ/λ、CD3、CD19、CD20[3]。FDCS具有滤泡树突细胞组织形态,特异性免疫表型为CD21、CD23及CD35[4]。本病例有典型透明血管型CD组织学表现,背景淋巴细胞表达CD3,同时滤泡间梭形细胞的形态学及免疫分型同滤泡树突细胞,故符合CD合并FDCS的病理特点。HVCD的影像学表现有一定的特征性,常表现为肿块内可见钙化灶,新近的研究表明,18F-FDG PET-CT不仅能够发现病变的大小变化,而且其糖代谢变化对于评价临床疗效与治疗选择(尤其是MCD)至关重要[5]。
HVCD好发于青年人,多表现为UCD,占CD的90%。UCD预后良好,手术切除后10年无病生存率为95%[6]。本例患者尽管属于HVCD,但临床类型为MCD,预后差,生存期短。MCD的治疗尚未达成共识,前瞻性队列研究亦受到发病率低以及疾病进展迅速的限制,我们仅检索到一项白细胞介素6(IL-6)拮抗剂(siltuximab)治疗MCD的双盲随机试验,结果显示经siltuximab治疗的MCD患者病情明显改善[7]。González等[8]总结认为MCD的治疗应依据病因、病情(如HIV、HHV8感染)选择适当的治疗方案。FDCS的治疗目前主要采用化疗联合放疗,新型治疗方法仍在探索中,如表皮因子受体抑制剂及BRAF V600E抑制剂等,可能成为靶向治疗药物[9,10]。
PNP是多种肿瘤的首发表现。Dong等[11]对114例CD患者临床特征进行分析,合并PNP者达32.5%,提出PNP是CD预后不良因素。作为CD并发症,OB则常发生于疾病终末期。Lee等[12]回顾性分析了关于伴发PNP及OB的文献,发现CD为最常见的原发肿瘤(占71.2%)。OB因病理活组织检查困难,目前主要通过临床诊断。针对OB的治疗大多以糖皮质激素及免疫抑制剂为主,也有文献报道大环内酯类药物有助于改善预后[13]。本例患者以PNP为首发表现,手术切除肿瘤并联合化疗后病情曾好转,但伴发OB也符合临床诊断标准,最终因OB所致呼吸衰竭死亡。因此,CD患者的治疗应依据发病机制、不同亚型以及并发症,制定个体化治疗方案。
无



























