
探讨18F-FDG PET-CT在弥漫大B细胞淋巴瘤(DLBCL)预后判断中的价值。
回顾性分析2009年6月至2015年5月130例初诊DLBCL患者的临床资料及治疗前18F-FDG PET-CT检查结果。
130例DLBCL患者18F-FDG PET-CT检查的最大标准摄取值(SUVmax)、病灶代谢体积(MTV)及病灶糖酵解总量(TLG)的中位数分别为19.93、34.45 cm3、459.92。单因素分析结果显示:美国东部肿瘤协作组(ECOG)评分、Ann Arbor分期、β2微球蛋白水平、乳酸脱氢酶水平、肿瘤直径、骨髓侵犯、改良国际预后指数(NCCN-IPI)评分、MTV、TLG均是患者无进展生存(PFS)率及总生存(OS)率的影响因素(均P<0.05);年龄是患者PFS率的影响因素(P<0.05)。由于MTV与TLG高度相关,多因素分析时,二者中仅纳入TLG,结果显示:ECOG评分、Ann Arbor分期、NCCN-IPI评分及TLG是影响患者PFS率的独立因素(均P<0.05);NCCN-IPI评分及TLG是影响患者OS率的独立因素(均P<0.05)。根据NCCN-IPI评分和TLG将患者分为低危组、中危组和高危组。低、中、高危组患者3年PFS率分别为66.0%、36.8%、26.1%,3年OS率分别为70.0%、49.1%、39.1%,差异均有统计学意义(均P<0.05)。
18F-FDG PET-CT所测得的TLG是影响DLBCL患者PFS及OS的独立预后因素,对DLBCL患者预后判断具有一定的参考价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是淋巴瘤最常见的病理类型,约占成年人非霍奇金淋巴瘤的1/3;DLBCL具有较高的异质性,约40%的患者经过一线化疗后出现复发或进展,预后较差[1]。国际预后指数(IPI)一直是DLBCL患者在接受CHOP方案(环磷酰胺+多柔比星+长春新碱+泼尼松)化疗后判断预后的指标,但是近年来随着利妥昔单抗+CHOP(R-CHOP)化疗方案的广泛应用,DLBCL患者的生存期显著延长,而IPI的预后价值则显著降低。2014年,Zhou等[2]利用美国国家综合癌症网络(NCCN)构建了一个关于利妥昔单抗治疗的预后模型,即改良国际预后指数(NCCN-IPI)。研究表明NCCN-IPI较IPI具有更好的预后价值,但是NCCN-IPI计算较为复杂且影响因素较多,因此,如何寻找简便、有效的预后评价指标,以便制订个体化治疗方案是目前研究的热点。18F-FDG PET-CT作为一种新型的分子影像技术,已成为淋巴瘤分期、疗效判断及预后评价的重要手段。多项研究表明18F-FDG PET-CT所测得的病灶代谢体积(MTV)及病灶糖酵解总量(TLG)等能预测多种恶性肿瘤的预后[3,4,5],但是MTV、TLG在淋巴瘤预后判断中的价值文献报道少见且存在一定争议。本研究回顾性分析130例初治DLBCL患者的18F-FDG PET-CT结果及临床资料,旨在探讨治疗前18F-FDG PET-CT对预后的判断价值。
收集2009年6月至2015年5月在我院行18F-FDG PET-CT检查的有完整临床资料的初诊DLBCL患者130例。入组标准:(1)年龄≥18岁;(2)病理确诊的初诊DLBCL;(3)PET-CT检查前未接受任何肿瘤相关治疗;(4)化疗方案为R-CHOP类方案;(5)化疗前PET-CT检查显示病灶为18F-FDG高摄取;(6)有完整的病历资料及随访结果;(7)既往无其他恶性肿瘤病史。排除标准:(1)淋巴瘤病灶已切除,PET-CT检查全身无阳性病灶;(2)伴有活动性感染或不可控制的慢性感染;(3)PET-CT检查前已行干扰素或白细胞介素治疗;(4)伴有严重的心脑血管疾病,如难治性心功能不全等。回顾性统计分析临床实验室指标与预后的关系,包括年龄、性别、病理亚型、乳酸脱氢酶(LDH)、β2微球蛋白(β2-MG)、美国东部肿瘤协作组(ECOG)评分、Ann Arbor分期、有无B症状、NCCN-IPI评分及PET-CT结果。
采用德国Siemens Biograph 16 HR PET-CT扫描仪,18F-FDG放化纯度>95%。所有患者检查前至少禁食6 h,测空腹血糖并控制血糖≤7.0 mmol/L;按患者体质量经静脉注射18F-FDG(3.70~5.55)MBq/kg后安静休息60 min左右,排空膀胱后行PET-CT扫描。先行CT扫描,再行PET数据采集:采用3D模式采集6~7个床位,每个床位2~3 min;应用CT数据进行衰减校正,迭代法重建获得图像。
通过麦迪克斯工作站,采用肿瘤代谢评估软件对PET和CT数据进行处理。参照文献[6]方法,采用固定阈值法,以最大标准摄取值(SUVmax)为2.5作为阈值,由软件自动进行容积分割,得出原发灶的SUVmax、平均标准摄取值(SUVmean)、MTV,并计算TLG。
TLG=MTV×SUVmean
随访方式包括门诊及电话随访,随访终点为2016年12月1日,中位随访时间43个月(19~90个月)。无进展生存(PFS)时间为疾病确诊(获得病理结果)至首次出现疾病进展、复发、任何原因导致的死亡或随访截止的时间。总生存(OS)时间为疾病确诊(获得病理结果)至任何原因导致的死亡或随访截止的时间。
应用SPSS 17.0统计软件分析数据。计量资料符合偏态分布,以中位数(范围)表示;以PFS时间作为阳性事件,采用受试者工作特征(ROC)曲线获得SUVmax、MTV及TLG的最佳界值点,并计算曲线下面积(AUC);如果AUC值较小,则以中位数为界值点。生存分析采用Kaplan-Meier法,进行Log-rank检验。多因素分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
截至随访结束,130例患者中40例复发或进展,22例患者死亡,中位PFS时间为33.1个月(2.5~87.7个月),1、3年PFS率分别为83.8%(109/130)、46.2%(60/130);中位OS时间为37.8个月(6.6~87.7个月),1、3年OS率分别为96.9%(126/130)、55.4%(72/130)。
130例患者中位SUVmax、MTV、TLG分别为19.93(4.27~45.63)、34.45 cm3(1.22~2 773.70 cm3)、459.92(10.08~21 103.64)。以PFS作为阳性事件,由于SUVmax的AUC值较小,以其中位数19.93作为界值点;MTV的界值点为55.68 cm3(敏感度80.0%,特异度72.2%;TLG的界值点为452.92(敏感度85.0%,特异度66.7%)(表1)。
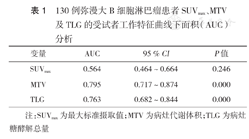
130例弥漫大B细胞淋巴瘤患者SUVmax、MTV及TLG的受试者工作特征曲线下面积(AUC)分析
130例弥漫大B细胞淋巴瘤患者SUVmax、MTV及TLG的受试者工作特征曲线下面积(AUC)分析
| 变量 | AUC | 95 % CI | P值 |
|---|---|---|---|
| SUVmax | 0.564 | 0.464~0.664 | 0.246 |
| MTV | 0.795 | 0.717~0.874 | 0.000 |
| TLG | 0.763 | 0.682~0.844 | 0.000 |
注:SUVmax为最大标准摄取值;MTV为病灶代谢体积;TLG为病灶糖酵解总量
单因素分析结果显示:ECOG评分、Ann Arbor分期、β2-MG水平、LDH水平、肿瘤直径、骨髓侵犯、NCCN-IPI评分、MTV、TLG均是患者PFS率及OS率的影响因素(均P<0.05);年龄是患者PFS率的影响因素(P<0.05)。而SUVmax与患者的PFS及OS均无关(均P>0.05)(表2)。
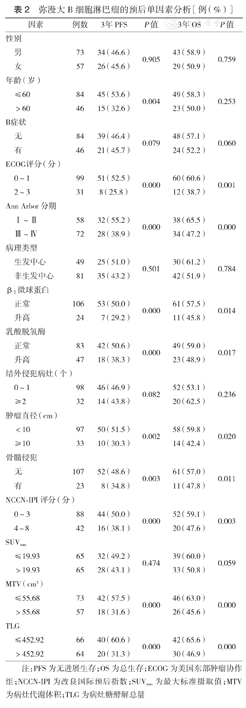
弥漫大B细胞淋巴瘤的预后单因素分析[例(%)]
弥漫大B细胞淋巴瘤的预后单因素分析[例(%)]
| 因素 | 例数 | 3年PFS | P值 | 3年OS | P值 | |
|---|---|---|---|---|---|---|
| 性别 | ||||||
| 男 | 73 | 34(46.6) | 0.905 | 43(58.9) | 0.759 | |
| 女 | 57 | 26(45.6) | 29(50.9) | |||
| 年龄(岁) | ||||||
| ≤60 | 84 | 45(53.6) | 0.004 | 49(58.3) | 0.253 | |
| >60 | 46 | 15(32.6) | 23(50.0) | |||
| B症状 | ||||||
| 无 | 84 | 39(46.4) | 0.079 | 48(57.1) | 0.060 | |
| 有 | 46 | 21(45.7) | 24(52.2) | |||
| ECOG评分(分) | ||||||
| 0~1 | 99 | 51(52.5) | 0.000 | 60(60.6) | 0.001 | |
| 2~3 | 31 | 8(25.8) | 12(38.7) | |||
| Ann Arbor分期 | ||||||
| Ⅰ~Ⅱ | 58 | 32(55.2) | 0.000 | 38(65.5) | 0.000 | |
| Ⅲ~Ⅳ | 72 | 28(38.9) | 34(47.2) | |||
| 病理类型 | ||||||
| 生发中心 | 49 | 25(51.0) | 0.501 | 30(61.2) | 0.784 | |
| 非生发中心 | 81 | 35(43.2) | 42(51.9) | |||
| β2微球蛋白 | ||||||
| 正常 | 106 | 53(50.0) | 0.000 | 61(57.5) | 0.014 | |
| 升高 | 24 | 7(29.2) | 11(45.8) | |||
| 乳酸脱氢酶 | ||||||
| 正常 | 83 | 42(50.6) | 0.000 | 49(59.0) | 0.017 | |
| 升高 | 47 | 18(38.3) | 23(48.9) | |||
| 结外侵犯病灶(个) | ||||||
| 0~1 | 98 | 46(46.9) | 0.082 | 52(53.1) | 0.236 | |
| ≥2 | 32 | 14(43.8) | 20(62.5) | |||
| 肿瘤直径(cm) | ||||||
| <10 | 97 | 50(51.5) | 0.002 | 58(59.8) | 0.020 | |
| ≥10 | 33 | 10(30.3) | 14(42.4) | |||
| 骨髓侵犯 | ||||||
| 无 | 107 | 52(48.6) | 0.003 | 61(57.0) | 0.011 | |
| 有 | 23 | 8(34.8) | 11(47.8) | |||
| NCCN⁃IPI评分(分) | ||||||
| 0~3 | 88 | 44(50.0) | 0.000 | 52(59.1) | 0.003 | |
| 4~8 | 42 | 16(38.1) | 20(47.6) | |||
| SUVmax | ||||||
| ≤19.93 | 65 | 32(49.2) | 0.474 | 39(60.0) | 0.059 | |
| >19.93 | 65 | 28(43.1) | 33(50.8) | |||
| MTV(cm3) | ||||||
| ≤55.68 | 73 | 42(57.5) | 0.000 | 46(63.0) | 0.000 | |
| >55.68 | 57 | 18(31.6) | 26(45.6) | |||
| TLG | ||||||
| ≤452.92 | 66 | 40(60.6) | 0.000 | 42(65.6) | 0.000 | |
| >452.92 | 64 | 20(31.3) | 30(46.9) | |||
注:PFS为无进展生存;OS为总生存;ECOG为美国东部肿瘤协作组;NCCN-IPI为改良国际预后指数;SUVmax为最大标准摄取值;MTV为病灶代谢体积;TLG为病灶糖酵解总量
由于MTV与TLG高度相关,故多因素分析时,二者中仅纳入TLG,结果显示:ECOG评分、Ann Arbor分期、NCCN-IPI评分及TLG是患者PFS率的独立影响因素(均P<0.05)(表3),而NCCN-IPI评分及TLG还是患者OS率的独立影响因素(均P<0.05)(表4)。
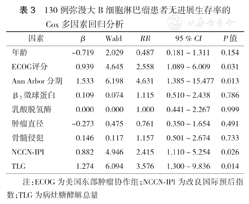
130例弥漫大B细胞淋巴瘤患者无进展生存率的Cox多因素回归分析
130例弥漫大B细胞淋巴瘤患者无进展生存率的Cox多因素回归分析
| 因素 | β | Wald | RR | 95 % CI | P值 |
|---|---|---|---|---|---|
| 年龄 | -0.719 | 2.029 | 0.487 | 0.181~1.311 | 0.154 |
| ECOG评分 | 0.939 | 4.645 | 2.558 | 1.089~6.009 | 0.031 |
| Ann Arbor分期 | 1.533 | 6.198 | 4.631 | 1.385~15.477 | 0.013 |
| β2微球蛋白 | 0.109 | 0.074 | 1.115 | 0.510~2.438 | 0.786 |
| 乳酸脱氢酶 | 0.000 | 0.000 | 1.000 | 0.441~2.267 | 0.999 |
| 肿瘤直径 | -0.273 | 0.475 | 0.761 | 0.350~1.654 | 0.491 |
| 骨髓侵犯 | 0.146 | 0.117 | 1.157 | 0.501~2.674 | 0.733 |
| NCCN⁃IPI | 0.882 | 4.946 | 2.415 | 1.110~5.254 | 0.026 |
| TLG | 1.274 | 6.094 | 3.576 | 1.300~9.836 | 0.014 |
注:ECOG为美国东部肿瘤协作组;NCCN-IPI为改良国际预后指数;TLG为病灶糖酵解总量
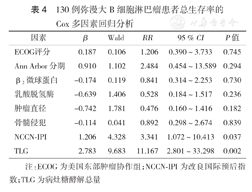
130例弥漫大B细胞淋巴瘤患者总生存率的Cox多因素回归分析
130例弥漫大B细胞淋巴瘤患者总生存率的Cox多因素回归分析
| 因素 | β | Wald | RR | 95 % CI | P值 |
|---|---|---|---|---|---|
| ECOG评分 | 0.187 | 0.106 | 1.206 | 0.390~3.733 | 0.745 |
| Ann Arbor分期 | 0.910 | 1.102 | 2.484 | 0.454~13.589 | 0.294 |
| β2微球蛋白 | -0.174 | 0.119 | 0.841 | 0.314~2.253 | 0.730 |
| 乳酸脱氢酶 | -0.639 | 1.406 | 0.528 | 0.184~1.517 | 0.236 |
| 肿瘤直径 | -0.742 | 1.781 | 0.476 | 0.160~1.416 | 0.182 |
| 骨髓侵犯 | -0.114 | 0.041 | 0.892 | 0.298~2.674 | 0.839 |
| NCCN⁃IPI | 1.206 | 4.328 | 3.341 | 1.072~10.413 | 0.037 |
| TLG | 2.783 | 9.683 | 11.167 | 2.801~33.298 | 0.002 |
注:ECOG为美国东部肿瘤协作组;NCCN-IPI为改良国际预后指数;TLG为病灶糖酵解总量
根据NCCN-IPI和TLG将患者分为三组:(1)低危组为TLG≤452.92且NCCN-IPI≤3分;(2)中危组为TLG≤452.92且NCCN-IPI>3分或TLG>452.92且NCCN-IPI≤3分;(3)高危组为TLG>452.92且NCCN-IPI>3分。低、中、高危组的3年PFS率分别为66.0%(33/50)、36.8%(21/57)、26.1%(6/23),差异有统计学意义(P<0.05);3年OS率分别为70.0%(35/50)、49.1%(28/57)、39.1%(9/23),差异有统计学意义(P<0.05)。
PET-CT是集解剖形态显像和功能代谢显像于一身的新型影像技术,广泛应用于多种肿瘤的诊断、分期、疗效评价及预后判断中[7,8]。18F-FDG PET-CT利用正电子核素18F标记葡萄糖代谢底物或类似物,在不影响机体正常代谢的情况下参与细胞代谢过程,可从分子水平反映肿瘤组织与正常组织的葡萄糖代谢差异。SUVmax作为PET-CT最常用的代谢参数,是一种基于肿瘤代谢程度的半定量参数,仅反映18F-FDG摄取最高部分肿瘤组织的代谢活性,在DLBCL的预后判断中存在一定的争议。应志涛等[9]的研究中,分别设定10、15、20为SUVmax的界值点,低SUVmax与高SUVmax患者间完全缓解率、有效率、2年PFS率及OS率差异均无统计学意义(均P>0.05)。由于SUVmax受多种因素的影响(如患者血糖水平、病灶的血流量、显像剂的注射剂量及仪器的衰减校正等),一些新的反映肿瘤负荷的PET代谢参数如MTV和TLG已广泛应用于临床。MTV是图像上SUV处于某给定范围的全部像素的体积,是一种基于肿瘤体积大小的PET代谢参数;TLG是MTV和SUVmean的乘积,既考虑了肿瘤的代谢体积,又兼顾了肿瘤葡萄糖代谢水平,更接近于肿瘤负荷和PET成像原理,理论上TLG具有更好的预后预测价值。
目前,MTV、TLG在DLBCL预后中的价值还存在一定的争议。Gallicchio等[10]回顾性分析52例DLBCL治疗前18F-FDG PET-CT资料,结果表明SUVmax与患者的预后相关,而MTV、TLG与患者的预后无关。Adams等[11]的研究中共纳入73例DLBCL患者,分别比较了SUVmax、MTV、TLG及NCCN-IPI的预后价值,结果表明,仅NCCN-IPI与患者的预后相关,而SUVmax、MTV、TLG均与患者的预后无关。而在Zhou等[12]的研究中,纳入91例DLBCL患者,单因素分析结果显示,MTV、TLG、NCCN-IPI与患者的预后相关,SUVmax与患者的预后无关;多因素分析结果显示仅有TLG是影响患者预后的独立危险因素。本研究单因素分析结果显示SUVmax与患者的预后无关,MTV、TLG均与患者的PFS及OS相关,由于MTV、TLG高度相关,多因素分析时二者中仅纳入TLG,结果表明TLG是影响患者PFS及OS的独立危险因素。本研究结果与上述文献不完全一致,分析认为:(1)测量MTV、TLG时采用不同的阈值可能会影响PET-CT的判断价值,Gallicchio等[10]及Adams等[11]的研究中,分别采用SUVmax的42%、40%作为阈值来测量MTV,本研究采用SUVmax 2.5作为阈值,因此,不同的阈值是否会影响PET-CT的预后判断价值,有待进一步研究。(2)预后分析时采用不同的界值点可能会导致结果的不一致,Adams等[11]的研究中以MTV及TLG的中位数作为界值点,而本研究是通过ROC曲线分析获得界值点。(3)各研究中患者资料的差异(如临床分期、ECOG评分、治疗方法等)也可导致结果不一致。我们在后续研究中将努力控制上述偏倚因素,进一步证实MTV、TLG在DLBCL中的预后价值。
本研究根据NCCN-IPI和TLG将患者分为低危组、中危组和高危组,三组患者的3年PFS率、OS率差异均有统计学意义(均P<0.05),低危组的PFS率及OS率高于高危组;进一步表明可将基线PET-CT结果和NCCN-IPI结合来判断患者的预后。近年来有研究将基线PET-CT结果的MTV、TLG与化疗早期(化疗2个周期)PET-CT结果中的多维尔评分(DS)进行结合,来预测患者的预后,结果显示,基线MTV<400 cm3时,无论DS如何,5年PFS率均>90%;基线MTV≥400 cm3时,DS 1~3分,5年PFS率为58.5%;基线MTV≥400 cm3时,DS 4~5分,5年PFS率为29.7%;提示将基线PET-CT结果中的MTV与化疗早期PET-CT结果中的DS进行结合,能够更好地预测患者的预后[13]。
综上所述,TLG是影响DLBCL患者PFS及OS的独立预后因素,TLG值越大,患者预后越差。18F-FDG PET-CT对DLBCL患者预后判断具有一定的参考价值。
无































