
评价Hyper-CVAD化疗方案治疗侵袭性T细胞淋巴瘤的效果和安全性。
对2009年9月至2010年12月在北京协和医院接受Hyper-CVAD方案诱导化疗的34例初诊侵袭性T细胞淋巴瘤患者的疗效和不良反应等资料进行回顾性分析,并进行生存分析。
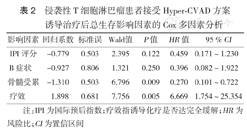
34例患者接受Hyper-CVAD方案诱导化疗后,28例(82.4%)有治疗反应,其中10例(29.4%)获得完全缓解(CR);11例接受造血干细胞移植(包括1例同胞全合异基因造血干细胞移植)。中位随访时间16个月(1~82个月),1、3年总生存(OS)率分别为70.2%、41.1%;1、3年无进展生存(PFS)率分别为49.3%、31.6%。化疗不良反应主要为骨髓抑制,18例(52.9%)发生Ⅳ级骨髓抑制;3例因严重感染死亡。Cox多因素分析显示,化疗能否达到CR是PFS的独立影响因素(HR=6.118,95% CI 1.327~28.206,P=0.020);骨髓是否受累(HR=0.270,95% CI 0.101~0.722,P=0.009)和化疗能否达到CR(HR=6.669,95% CI 1.754~25.354,P=0.005)是OS的独立影响因素。
Hyper-CVAD方案诱导化疗治疗侵袭性T细胞淋巴瘤的反应率高,但有效持续时间短,远期疗效不佳,同时骨髓抑制严重,感染发生率高。缓解后行自体造血干细胞移植可能提高侵袭性T细胞淋巴瘤的疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
T细胞淋巴瘤为一组异质性明显的淋巴增生性肿瘤。在西方国家,T细胞淋巴瘤占所有非霍奇金淋巴瘤(NHL)的5%~10%[1],而亚洲国家的发病率更高,占NHL的15%~20%。长期以来,T细胞淋巴瘤的治疗主要以传统CHOP方案为基础,除ALK阳性间变性大细胞淋巴瘤(ALK+ ALCL)外,CHOP方案治疗其他类型T细胞淋巴瘤疗效不佳。有报道CHOP、CHOP样方案治疗外周T细胞淋巴瘤(PTCL)的完全缓解(CR)率<50%,5年生存率约30%[2]。目前对于T细胞淋巴瘤尚无标准治疗方案。Hyper-CVAD强化疗方案在国内外已被广泛应用于急性淋巴母细胞白血病、淋巴母细胞淋巴瘤及套细胞淋巴瘤等血液系统恶性肿瘤,但其对于T细胞淋巴瘤的疗效仍有争议。本研究评价了Hyper-CVAD强化疗方案治疗初诊侵袭性T细胞淋巴瘤的疗效和安全性,并对预后影响因素进行探讨。
2009年9月至2010年12月北京协和医院共有34例初诊T细胞淋巴瘤患者接受Hyper-CVAD方案治疗。所有患者均经病理组织学检查确诊,并按照2008年世界卫生组织(WHO)分型标准进行分型。男性25例,女性9例,中位年龄39岁(14~87岁);32例(94.1%)为Ⅲ~Ⅳ期;28例(82.4%)诊断时有B症状;15例(44.1%)有1个以上结外器官或组织侵犯;10例(29.4%)出现骨髓侵犯;11例(32.4%)国际预后指数(IPI)评分属高危、高中危组(3~5分)。病理学分型:PTCL非特指型(PTCL-NOS)12例,血管免疫母细胞性T细胞淋巴瘤(AITL)5例,T淋巴母细胞淋巴瘤(T-LBL)4例,肝脾γδT细胞淋巴瘤(HSTCL)4例,NK/T细胞淋巴瘤(NKTCL)5例,ALK+ ALCL 1例,ALK- ALCL 1例,其他类型2例。
34例患者均接受Hyper-CVAD A方案诱导治疗。完成2个周期治疗后行CT或PET-CT检查评估疗效。未缓解、疾病进展(PD)或复发患者换用二线化疗方案(ESHAP或GDP)。缓解者继续原方案化疗,每2个周期进行评价疗效。达到部分缓解(PR)或CR的移植候选者进行干细胞动员采集,再予GDP或MINE方案巩固2个疗程后行自体造血干细胞移植。
Hyper-CVAD A方案:环磷酰胺300 mg/m2,每12 h一次,持续静脉滴注2 h以上,第1天至第3天;长春新碱2 mg,静脉注射,第4、11天;表柔比星80 mg/m2,静脉滴注,第4天;地塞米松30~40 mg,口服或静脉注射,第1天至第4天,第11天至第14天。21 d为1个周期。化疗后如外周血白细胞计数<2.0×109/L或中性粒细胞计数<1.0×109/L,给予粒细胞集落刺激因子(G-CSF)至白细胞计数恢复至正常水平。未预防性使用抗生素。
按照NHL国际疗效判断标准评价疗效,分为CR、不确定的完全缓解(CRu)、PR、疾病稳定(SD)和PD。按照美国国家癌症研究所(NCI)常见不良事件评价标准3.0版(CTCAE 3.0)标准对不良反应进行评价并分级。
所有患者治疗结束后定期门诊结合电话随访。总生存(OS)时间为从诊断之日至死亡或末次随访的时间。无进展生存(PFS)时间为从患者开始进行治疗之日到肿瘤进展、复发或死亡或末次随访的时间。
应用SPSS 21.0软件对数据进行统计学分析,生存分析采用Kaplan-Meier法,生存影响因素的单因素分析采用Log-rank检验,多因素分析采用Cox回归模型。以P≤0.05为差异具有统计学意义。
所有患者均接受Hyper-CVAD A方案一线诱导化疗,中位治疗周期数为2个周期(1~6个周期),共完成A方案108个周期。32例患者可评价疗效,其中CR 10例(29.4%),包括PTCL-NOS 4例,AITL 1例,T-LBL 2例,HSTCL 1例,NKTCL 1例,ALK+ ALCL 1例;PR 18例(52.9%),包括PTCL-NOS 5例,AITL 4例,T-LBL 2例,HSTCL 1例,NKTCL 3例,ALK- ALCL 1例,其他类型2例。总有效率为82.4%(28/34)。
在诱导化疗获得缓解的患者中,10例(7例CR,2例PR,1例复发后再次诱导获CR)接受了高剂量化疗联合自体外周血干细胞移植(HDT/AHSCT),其中3例在移植后3~7个月复发,其余患者截至末次随访均处于CR状态;1例髓外复发的T-LBL患者进行同胞全合异基因造血干细胞移植,移植后8个月死于原发病进展。
在接受巩固化疗的16例患者中,13例(81.3%)发生PD,9例接受解救治疗,其中4例有治疗反应(2例PR,2例CR)。
全部患者均可评价不良反应。最常见的不良反应为骨髓抑制。19例(55.9%)发生Ⅲ~Ⅳ级粒细胞减少,其中Ⅳ级粒细胞减少18例(52.9%)。22例(64.7%)患者发生粒细胞减少性发热,其中17例发生粒细胞缺乏所致感染,常见的感染部位为呼吸系统,包括3例感染性休克,1例败血症。诱导化疗中,3例患者因感染死亡。非血液学不良反应主要为消化道反应,多为Ⅰ~Ⅱ级;未见Ⅳ级非血液学不良反应。7例(CR 2例,PR 5例)患者因严重化疗不良反应更换其他化疗方案。
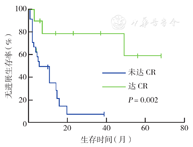
随访截至2015年12月,中位随访时间为16个月(1~82个月)。34例患者中,21例死亡,其中3例死于化疗后严重感染(2例未行病情评估,1例化疗2个疗程仅达PR),14例死于原发病进展,2例死于并发症,2例死因未明;10例尚在门诊随诊(8例无瘤生存,2例带瘤生存);3例失访。诱导化疗获得缓解的患者中位随访时间为18个月。所有患者中位OS时间为17个月,1、3年OS率分别为70.2%、41.1%;中位PFS时间为11个月,1、3年PFS率分别为49.3%、31.6%(图1)。


1A:总生存曲线;1B:无进展生存曲线
单因素分析显示,中高危、高危(IPI>2分)者中位PFS时间短于中低危、低危(IPI≤2分)者(5个月比15个月,χ2=4.047,P=0.044)(图2);诱导化疗未达CR者中位PFS时间短于达CR者(5个月比未达到,χ2=9.963,P=0.002)(图3);而患者年龄、病理类型、临床分期、B症状、1个以上结外部位受累、骨髓受累、美国东部肿瘤协作组(ECOG)评分及血清乳酸脱氢酶(LDH)水平升高不影响PFS。Cox多因素分析显示,仅诱导化疗是否达CR是PFS的独立影响因素(HR=6.118,95% CI 1.327~28.206,P=0.020)(表1)。

侵袭性T细胞淋巴瘤患者接受Hyper-CVAD方案诱导治疗后无进展生存影响因素的Cox多因素分析结果
侵袭性T细胞淋巴瘤患者接受Hyper-CVAD方案诱导治疗后无进展生存影响因素的Cox多因素分析结果
| 影响因素 | 回归系数 | 标准误 | Wald值 | P值 | HR值 | 95 % CI |
|---|---|---|---|---|---|---|
| IPI评分 | 0.339 | 0.483 | 0.492 | 0.483 | 1.404 | 0.544~3.619 |
| B症状 | 0.903 | 0.776 | 1.352 | 0.245 | 2.466 | 0.538~11.296 |
| 疗效 | 1.811 | 0.780 | 5.395 | 0.020 | 6.118 | 1.327~28.206 |
注:IPI为国际预后指数;疗效指诱导化疗是否达完全缓解;HR为风险比;CI为置信区间



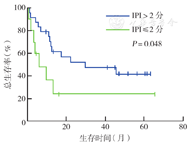
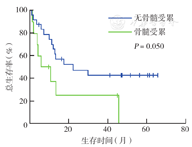
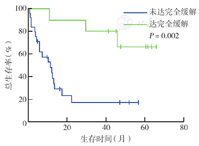
单因素分析显示,中高危、高危(IPI>2分)者中位OS时间短于中低危、低危(IPI≤2分)者(12个月比37个月,χ2=3.901,P=0.048)(图4);骨髓受累者中位OS时间短于骨髓未受累者(7个月比28个月,χ2=3.855,P=0.050)(图5);诱导化疗达CR者中位OS时间优于未达CR者(未达到比14个月,χ2=9.242,P=0.002)(图6)。Cox多因素分析显示,骨髓是否受累(HR=0.270,95% CI 0.101~0.722,P=0.009)和诱导化疗能否达CR(HR=6.669,95% CI 1.754~25.354,P=0.005)是OS的独立影响因素(表2)。
侵袭性T细胞淋巴瘤患者接受Hyper-CVAD方案诱导治疗后总生存影响因素的Cox多因素分析
侵袭性T细胞淋巴瘤患者接受Hyper-CVAD方案诱导治疗后总生存影响因素的Cox多因素分析
| 影响因素 | 回归系数 | 标准误 | Wald值 | P值 | HR值 | 95 % CI |
|---|---|---|---|---|---|---|
| IPI评分 | -0.779 | 0.503 | 2.395 | 0.122 | 0.459 | 0.171~1.230 |
| B症状 | -0.927 | 0.806 | 1.321 | 0.250 | 0.396 | 0.082~1.922 |
| 骨髓受累 | -1.310 | 0.503 | 6.796 | 0.009 | 0.270 | 0.101~0.722 |
| 疗效 | 1.898 | 0.681 | 7.756 | 0.005 | 6.669 | 1.754~25.354 |
注:IPI为国际预后指数;疗效指诱导化疗是否达完全缓解;HR为风险比;CI为置信区间



目前认为传统的CHOP或CHOP样方案对于侵袭性T细胞淋巴瘤疗效不佳,最主要的问题为CR后有效维持时间短,且易复发,长期无病生存率仅10%~30%。近年来不同研究中心都在尝试使用不同的药物组合或新药提高T细胞淋巴瘤的疗效。Hyper-CVAD方案由美国MD Anderson癌症中心1986年首先使用,在成年人急性淋巴细胞白血病、套细胞淋巴瘤等中具有良好的疗效。但该方案在侵袭性T细胞淋巴瘤中的治疗作用目前尚未获得一致的结论。Escalón等[3]报道在135例初治PTCL患者中,37%的患者接受常规CHOP或CHOP样方案化疗,而48%患者接受Hyper-CVAD等强化治疗,CHOP方案组3年OS率为62%,强化治疗组为56%,两组差异无统计学意义。研究者指出,强化治疗与CHOP方案疗效差异不大可能与选择偏倚(进展期患者及预后差的患者常选择强化治疗)、强化治疗相关的早期死亡(由治疗相关不良反应导致)及研究中采用多种强化治疗等原因有关。王瑾等[4]报道80例初治PTCL患者分别采用Hyper-CVAD/MA方案(HM组)与CHOP或CHOP样方案(CC组),结果发现HM组与CC组患者的总有效率(78.3%比54.4%)、中位PFS时间(24个月比12个月)及1年PFS率(82.6%比45.6%)差异均有统计学意义;两组患者的复发率相似,3年OS率差异无统计学意义。Abramson等[5]在一项多中心回顾性研究中发现,Hyper-CVAD/MA方案可能在反应率和3年PFS率上均优于CHOP或CHOP样方案。Hyper-CVAD方案治疗者总反应率和3年PFS率分别为85%、53%,CHOP或CHOP样方案者则为69%、32%,但3年OS率差异无统计学意义。上述研究显示Hyper-CVAD方案或许可以提高反应率,延长PFS时间,但是并不能改善T细胞淋巴瘤患者的OS;同时不良反应重,Ⅳ级骨髓抑制发生率极高,约1/3的患者需要调整剂量才能完成B方案。
在本研究中,我们为了减少Hyper-CVAD方案的骨髓抑制,尝试仅使用A方案治疗。本组患者的总反应率为82.3%,但CR率仅29.4%(10例),3年OS率、PFS率分别为41.1%、31.6%。CR率低于其他文献报道的原因可能是:(1)与本组患者绝大多数(94.1%)为Ⅲ~Ⅳ期有关。施薇等[6]报道早期患者(Ⅰ~Ⅱ期)的CR率高于晚期患者(Ⅲ~Ⅳ期),晚期患者CR率仅23.5%,与本研究中的CR率相当。(2)本研究仅采用Hyper-CVAD方案中的A方案,影响了疗效。(3)患者对于本方案的耐受性欠佳,仅12例(35.3%)患者接受≥4个疗程的治疗,疗程不足同样可能影响疗效。
目前大多数研究认为HDT/AHSCT可能改善已获得缓解T细胞淋巴瘤患者的预后,延长PFS和OS时间[7]。NLG-T-01研究发现,使用CHOEP方案诱导治疗后获得CR或PR的患者进行HDT/AHSCT,接受移植组5年OS率和PFS率分别为51%和44%[8]。复发难治PTCL患者接受HDT/AHSCT也可能延长其无病生存时间。Nademanee等[9]报道55例复发或诱导失败的T细胞淋巴瘤患者接受AHSCT,5年PFS率仍达32%。在本研究中,10例接受HDT/AHSCT,除3例患者在移植后短期复发外,其余7例患者截至末次随访日均处于CR,生存情况优于非移植组。本组由于病例少,尚不能说明HDT/AHSCT在T细胞淋巴瘤治疗中的作用。
Hyper-CVAD方案引起的Ⅳ级骨髓抑制发生率高达100%,粒细胞减少导致的感染发生率接近1/3,B方案尤其明显[10,11]。为减轻骨髓抑制,本研究中仅采用Hyper-CVAD方案中的A方案,但严重骨髓抑制的发生率仍高达50%以上。本组18例发生Ⅳ级粒细胞减少,22例发生粒细胞减少性发热,其中17例发生感染,3例出现感染性休克,1例败血症。本研究中有3例患者因粒细胞缺乏导致的严重感染而死亡,6例患者因严重骨髓抑制更换方案。与传统CHOP样方案相比,本方案的骨髓抑制发生率高,程度更为严重,从而限制了其在临床上的应用。国外研究多采用预防性G-CSF治疗,建议在治疗第10天开始使用G-CSF[12];而本研究中仅在出现Ⅲ级及以上粒细胞减少时给予G-CSF治疗,同时本组患者均未给予预防性抗生素治疗,均可能是导致本研究中感染率高于其他报道的主要原因,提示在后续的研究中Hyper-CVAD方案支持治疗强度仍需进一步加强[13]。
综上所述,Hyper-CVAD方案虽然可作为侵袭性T细胞淋巴瘤的诱导方案,反应率较高,但其远期疗效仍需自体造血干细胞移植进一步巩固,同时因其骨髓抑制较重,临床应用受到一定的限制,需要加强支持治疗的力度(包括预防性G-CSF以及抗生素治疗)。对于侵袭性T细胞淋巴瘤的最佳方案仍需进一步研究。
无



























