
探讨儿童急性淋巴细胞白血病(ALL)化疗后合并结核性脑膜炎(TBM)的临床特点及诊治。
回顾性分析福建医科大学附属协和医院2014年9月收治的1例ALL维持化疗中合并肺结核及TBM患儿的临床资料,并复习相关文献。
患儿,男性,11岁,确诊ALL 27个月,维持化疗中,出现中性粒细胞缺乏伴发热,予抗感染、抗真菌及甲泼尼龙治疗后,体温一度正常;1个月后再次发热,伴咳嗽、头痛,予抗感染、抗真菌治疗无好转,头痛加剧,并出现颈项强直,肺部CT示上肺及下肺背段炎症,脑脊液结核TB-DNA、结核分枝杆菌培养均阳性,确诊继发性肺结核、结核性脑膜炎,予规则抗结核治疗1.5年,病情治愈。
儿童ALL合并TBM的早期诊断是难点,及时、长疗程抗结核治疗,适当兼顾白血病化疗,仍可取得较好的抗结核病疗效,且不影响白血病预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
感染是儿童急性淋巴细胞白血病(ALL)治疗过程中最常见的并发症,细菌、真菌是最常见的病原体,而结核分枝杆菌感染则较为少见[1]。由于糖皮质激素及化疗药物的应用造成免疫功能低下,并干扰或掩盖结核病的症状和体征,导致其发病隐匿及临床症状不典型,常被延误诊治,因此结核感染易呈暴发性经过,尤其是结核杆菌通过血行播散导致结核性脑膜炎(TBM)时,多病情危重,甚至短期内死亡。目前,国内对于儿童ALL化疗后合并TBM的报道较少,我们总结1例ALL在维持化疗中合并TBM患儿的临床资料,并复习相关文献。
患儿,男性,11岁,以确诊白血病27个月,反复发热1个月,头痛5 d为主诉于2014年9月25日入住我院。入院前27个月因确诊为ALL(B细胞型,中危型)。诱导化疗期间有侵袭性肺曲霉病病史(图1A)。入院前1个月出现发热,伴有畏冷、寒战,无咳嗽,无气促。血常规示:白细胞计数(WBC)5.29×109/L,中性粒细胞绝对值(ANC)4.62×109/L,血红蛋白(Hb)115 g/L,血小板计数(Plt)198×109/L,C反应蛋白(CRP)79.47 mg/L;降钙素原(PCT)0.17 ng/ml;γ-干扰素释放试验技术(IGRA)、结核感染T细胞检测(T-SPOT)、抗结核抗体、真菌葡聚糖、半乳甘露聚糖试验、EB病毒(EBV)-DNA、巨细胞病毒(CMV)-DNA、肺炎支原体抗体均阴性;肺部CT示双肺可见散在淡薄片状影,透亮度明显减低(图1B);考虑肺部感染(细菌、真菌混合感染可能性大,卡氏肺孢子虫不能排除),予亚胺培南西司他丁+万古霉素+复方磺胺甲噁唑抗感染及卡伯芬净抗真菌2周,甲泼尼龙(2 mg/kg×7 d)抗感染治疗,体温恢复正常,复查肺部CT较前稍有吸收。入院前5 d再次发热,伴有咳嗽、头痛、呕吐;头颅+肺部CT检查示:双肺炎症,纵隔可见肿大伴钙化淋巴结(图1C),左上颌窦窦腔内可见丝状密度影;予头孢哌酮舒巴坦+阿奇霉素抗感染,卡伯芬净抗真菌,更昔洛韦抗病毒,症状无改善。既往无肺结核病史及接触史,有按时进行预防接种。体格检查:体温36.5 ℃,脉搏90次/min,呼吸21次/min,血压102/68 mmHg(1 mmHg=0.133 kPa),体质量38 kg,神志清楚,营养中等,呼吸平稳。右上臂可见卡疤,全身浅表淋巴结未触及肿大,双侧鼻窦区无明显压痛,颈软,心肺腹部查体无阳性体征,双侧巴氏征、克氏征阴性。
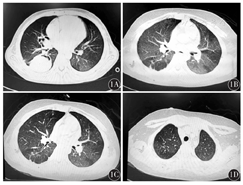

入院后骨髓常规示:粒系增生减低,吞噬细胞0.01;IGRA 102.3 pg/ml(参考值<14 pg/ml);肺部CT示:双上肺可见散在斑片影,较前增多(图1D);治疗上改为美罗培南+万古霉素抗感染,两性霉素B脂质体抗真菌,停更昔洛韦,仍反复高热,头痛加剧,并出现呕吐、颈项强直,行腰部穿刺检查。脑脊液常规示:有核细胞计数745×106/L,单个核细胞百分比9%,多个核细胞百分比91%,红细胞少许/HP;脑脊液生化检查示:葡萄糖0.95 mmol/L,氯110.0 mmol/L,脑脊液蛋白3 582 mg/L,腺苷脱氨酶(ADA)16.0 U/L;脑脊液结核杆菌TB-DNA:104拷贝/ml;脑脊液结核分枝杆菌培养阳性,对链霉素、异烟肼、利福平、乙胺丁醇均敏感。颅脑磁共振成像(MRI)未见明显异常。考虑继发性肺结核合并TBM,但细菌、真菌感染亦不能排除,予加用异烟肼+利福平+吡嗪酰胺(HRZ)抗结核,继续美罗培南(40 mg/kg,1次/8 h)抗感染,伏立康唑抗真菌,甲泼尼龙(每天0.5 mg/kg)抗感染,呋塞米、甘露醇脱水降颅压等治疗1周后,症状缓解,复查脑脊液,WBC逐渐下降至正常,脑脊液结核杆菌TB-DNA阴性,多次复查肺部CT及颅脑MRI提示炎症逐渐吸收,继续HRZ抗结核治疗3个月后再次开始白血病维持化疗,同步以HRZ抗结核维持1年2个月。随访至截稿前,患儿白血病已停药2年仍处于持续完全缓解,抗结核化疗停药1.5年未出现复发。
结核病是一个全球性的健康问题,每年因结核死亡约180万人[2]。由于T细胞减少及功能下降、中性粒细胞缺乏单核/巨噬细胞功能障碍及化疗药物免疫抑制,成年白血病患者结核的患病率为健康人群的9倍(1.7%~8.3%);而白血病儿童结核的患病率地区差异较大,在结核高发的非洲,白血病儿童结核患病率达9.1%,为健康儿童的22.4倍;在非结核高发地区结核约占白血病感染病因的1.5%[3,4,5]。
儿童更易患TBM等重症结核病,而TBM是结核病中最严重的类型,估计每年新发TBM约10万例,若治疗不及时,病死率可高达30%~50%,而50%的幸存者有神经系统后遗症[2,6]。脑脊液中找到结核分枝杆菌为诊断TBM的金标准,在缺乏微生物学确诊依据的情况下,应基于临床表现、脑脊液与TBM相符合的影像学,结合阳性结核菌素试验与结核病接触的流行病学证据等来建立TBM的临床诊断[2,7]。但在疾病早期临床表现多不典型,传统检查方法存在很大局限性,误诊率、漏诊率高[8]。此时,应用新诊断方法或可提高诊断正确率:(1)IGRA:脑脊液标本IGRA检查对TBM的阳性预测值、阴性预测值分别为93.33%、87.5%[9,10];(2)T-SPOT:在活动性结核病的中国普通人群中灵敏度、特异度分别为88%、89%,而在恶性血液病及造血干细胞移植患者中有利于早期发现潜伏期结核感染患者[9,11];(3)利福平耐药实时荧光定量核算扩增技术(Xpert MTB/RIF):对怀疑TBM的患儿世界卫生组织(WHO)强烈推荐脑脊液标本优先运用Xpert MTB/RIF作为快速诊断方法[12];(4)荧光定量聚合酶链反应(PCR)检测脑脊液TB-DNA:与培养法对比,灵敏度、特异度、符合率为100.0%、96.7%、99.3%,具有准确、简便、快速的特点,而且对疗效监测和预后评估比培养法更具优势[13]。从该患儿诊断过程可以看出,在疾病早期,且可能由于糖皮质激素应用、中性粒细胞缺乏等因素影响,结核病诊断困难。因此注意观察治疗效应,重复进行血液学、影像学、体液培养等相关检查非常必要。
结合文献复习,对于儿童白血病合并TBM的治疗提出如下建议:(1)提高警惕,对可疑患者重复进行必要检查,仔细甄别随访影像学演变,早期确诊及早期治疗是改善预后的关键[2];(2)兼顾抗结核治疗及白血病化疗,儿童结核病的治疗原则遵循"早期、适量、联合、规律、全程",完成强化期及巩固期阶段治疗,WHO强调儿童结核病应每日用药,不推荐强化期的间歇治疗,一般人群推荐方案为2HRZE/10HR,在成年白血病合并结核病患者的研究中,采用三联或四联一线抗结核治疗,有效率可达80%以上,且不受化疗影响,因此建议在结核病病情稳定后,尽快恢复白血病化疗[4]。但对于ALL儿童,由于强烈的联合化疗,尤其是化疗后骨髓抑制期出现持续中性粒细胞缺乏,可能严重影响免疫功能,在应用化疗药物期间停抗结核药物,结核复发风险大,抗结核疗程目前并无统一推荐;因此如果未完成白血病化疗总疗程,建议适当延长巩固期,或者可根据实际情况,强烈化疗后中性粒细胞缺乏伴发热期间必要时予经验性抗结核治疗。
总之,儿童ALL化疗后发热给予常规抗感染、抗真菌治疗效果不佳时,需考虑合并TBM可能,及时进行筛查,早期、规则且长疗程抗结核治疗兼顾白血病化疗,可取得较好预后。
无



























