
比较硼替佐米联合环磷酰胺、地塞米松(VCD)方案与硼替佐米联合地塞米松(VD)方案治疗初诊多发性骨髓瘤(NDMM)患者的临床疗效及安全性。
回顾性分析2013年1月至2016年1月山西医科大学附属山西大医院诊治的73例NDMM患者临床资料,根据化疗方案分为VCD组(41例)和VD组(32例),评价两组患者的疗效及不良反应。
VCD与VD组总有效率分别为80.5%(33/41)和78.1%(25/32),差异无统计学意义(χ2=0.061,P=0.804);完全缓解率分别为36.6%(15/41)和15.6%(5/32),差异有统计学意义(χ2=3.970,P=0.046);中位无进展生存(PFS)时间分别为27、24个月,中位总生存(OS)时间分别为35、33个月,两组PFS率和OS率比较差异均无统计学意义(均P>0.05)。不良反应多为1~2级,周围神经病变及血小板减少症最为常见,3级不良反应以周围神经炎最多见,两组不良反应的发生率比较差异无统计学意义(P>0.05)。
VCD与VD方案均可以作为NDMM患者较好的诱导治疗方案;VCD较VD方案有更高的完全缓解率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(MM)对多种细胞毒性药物敏感,但疗效短暂,患者生存期短。近年来随着硼替佐米、来那度胺、沙利度胺等新药的出现及造血干细胞移植的广泛开展,MM患者的疗效和生存得到了极大的改善[1,2]。现已证明,含新药的三药联合方案显著优于传统化疗方案[3]。2011年美国国立综合癌症网络(NCCN)指南中,将VCD方案(硼替佐米+环磷酰胺+地塞米松)作为适合移植MM患者的一类推荐方案,2013年国内指南[4]将VCD方案作为该类患者的推荐治疗方案。为进一步了解VCD与VD(硼替佐米+地塞米松)方案在初诊MM(NDMM)患者中疗效及安全性的差异,我们进行了单中心回顾性研究,现报道如下。
以2013年1月至2016年1月在我院行VCD方案和VD方案治疗的73例NDMM患者为研究对象,患者的诊断、分期以及疗效判断均参照文献[5]的标准。根据治疗方案的不同,分为VCD组(41例)与VD组(32例)。对两组患者的主要临床特征进行统计分析,两组患者性别、年龄、临床特征(分型、分期等)及是否接受自体外周血造血干细胞移植(APBSCT)等方面差异均无统计学意义(均P>0.05)(表1)。
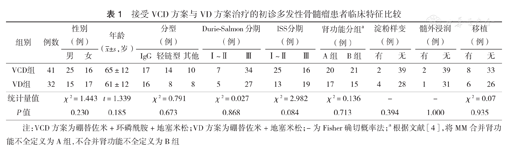
接受VCD方案与VD方案治疗的初诊多发性骨髓瘤患者临床特征比较
接受VCD方案与VD方案治疗的初诊多发性骨髓瘤患者临床特征比较
| 组别 | 例数 | 性别(例) | 年龄( ±s,岁) ±s,岁) | 分型(例) | Durie-Salmon分期(例) | ISS分期(例) | 肾功能分组a(例) | 淀粉样变(例) | 髓外浸润(例) | 移植(例) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | IgG | 轻链型 | 其他 | I~Ⅱ | Ⅲ | I~Ⅱ | Ⅲ | A组 | B组 | 有 | 无 | 有 | 无 | 有 | 无 | |||
| VCD组 | 41 | 25 | 16 | 65±12 | 17 | 14 | 10 | 7 | 34 | 25 | 16 | 20 | 21 | 2 | 39 | 2 | 39 | 8 | 33 |
| VD组 | 32 | 15 | 17 | 61±12 | 16 | 8 | 8 | 5 | 27 | 13 | 19 | 17 | 15 | 4 | 28 | 1 | 31 | 6 | 26 |
| 统计量值 | χ2=1.443 | t=1.339 | χ2=0.791 | χ2=0.027 | χ2=2.982 | χ2=0.136 | - | - | χ2=0.07 | ||||||||||
| P值 | 0.230 | 0.185 | 0.673 | 0.868 | 0.084 | 0.713 | 0.394 | 1.000 | 0.935 | ||||||||||
注:VCD方案为硼替佐米+环磷酰胺+地塞米松;VD方案为硼替佐米+地塞米松;-为Fisher确切概率法;a根据文献[4],将MM合并肾功能不全定义为A组,不合并肾功能不全定义为B组
采用CD138+磁珠分选骨髓瘤细胞,MM探针组合分析。检测位点包括1q21扩增、RB1缺失、13q14.3、p53缺失(17p-)、IGH重排。若检测到IGH重排时进一步检测t(4;14)、t(11;14)及t(14;16)。73例患者中有39例进行了完整的免疫荧光原位杂交(FISH)检测。其中VCD组22例:阴性4例,1q21扩增8例,RB1缺失5例,p53缺失4例,13q14.3阳性5例,IGH重排6例,5例患者同时存在多项核型异常;进一步检测t(11;14)4例,t(4;14)1例,t(14;16)1例。VD组17例:阴性2例,1q21扩增9例,RB1缺失3例,13q14.3阳性5例,p53缺失4例,IGH重排4例,6例患者同时存在多项核型异常;进一步检测t(11;14)1例,t(4;14)1例,t(14;16)2例。依据国际骨髓瘤工作组(IMWG)对MM的危险分层,将细胞遗传学异常的患者分为高危组和非高危组,若同时存在多项核型异常时,以预后差的为主。VCD组高危14例,非高危4例;VD组高危12例,非高危3例。
VCD方案:硼替佐米1.3 mg/m2,第1、4、8、11天;环磷酰胺300 mg/m2,第1、8、15天;地塞米松20 mg,第1、2天,第4、5天,第8、9天,第11、12天;VD方案:硼替佐米1.3 mg/m2,第1、4、8、11天;地塞米松20 mg,第1、2天,第4、5天,第8、9天,第11、12天。21 d为1个疗程;硼替佐米采用皮下注射方式给药。所有患者至少完成4个疗程的治疗,化疗过程中均予常规预防性抗病毒治疗。后续治疗中VCD组8例、VD组6例接受APBSCT。若治疗过程中出现4级血小板减少或粒细胞减少、重度感染及难以耐受的不良反应时,推迟甚至停止化疗,直到恢复至正常或接近正常后再次开始治疗。
疗效评估参照2015年中国MM诊治指南修订版[2]标准进行评估。分为严格意义的完全缓解(sCR)、完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、微小缓解(MR)、疾病稳定(SD)和疾病进展(PD);总有效率以PR及以上(PR+VGPR+CR+sCR)计算;缓解率以VGPR及以上(VGPR+CR+sCR)计算;CR率以CR+sCR计算。无进展生存(PFS)时间定义为患者开始治疗至疾病进展或复发的时间;总生存(OS)时间定义为疾病确诊至死亡或失访的时间。
按照美国国立癌症研究院常见不良反应事件评价标准(NCI-CTCAE)4.0标准[6]评估血液学不良反应及非血液学不良反应。
随访时间截至2016年12月31日,随访截止时间点分为疾病进展、复发和死亡,随访形式为住院随访、门诊随访及电话随访。
应用SPSS 20.0统计学软件进行统计学分析。计数资料比较采用χ2检验和Fisher确切概率法。计量资料符合正态分布,用均数±标准差( ±s)表示,两组间比较采用两样本t检验。生存分析使用Kaplan-Meier生存曲线,比较采用Log-rank检验。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用两样本t检验。生存分析使用Kaplan-Meier生存曲线,比较采用Log-rank检验。P<0.05为差异有统计学意义。
经VCD与VD方案分别治疗4个疗程后,两组方案的总有效率、缓解率差异均无统计学意义(均P>0.05),但CR率差异有统计学意义(P=0.046)(表2)。
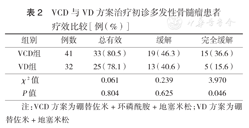
VCD与VD方案治疗初诊多发性骨髓瘤患者疗效比较[例(%)]
VCD与VD方案治疗初诊多发性骨髓瘤患者疗效比较[例(%)]
| 组别 | 例数 | 总有效 | 缓解 | 完全缓解 |
|---|---|---|---|---|
| VCD组 | 41 | 33(80.5) | 19(46.3) | 15(36.6) |
| VD组 | 32 | 25(78.1) | 13(40.6) | 5(15.6) |
| χ2值 | 0.061 | 0.239 | 3.970 | |
| P值 | 0.804 | 0.625 | 0.046 |
注:VCD方案为硼替佐米+环磷酰胺+地塞米松;VD方案为硼替佐米+地塞米松
26例细胞遗传学高危患者分别接受4个疗程VCD与VD方案治疗后,总有效率、缓解率差异均无统计学意义(P>0.05),VCD组高危患者CR率为14.3%,而VD组高危患者均未达CR,两组CR率差异有统计学意义(P<0.05)(表3)。
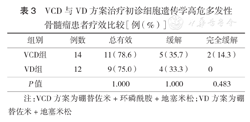
VCD与VD方案治疗初诊细胞遗传学高危多发性骨髓瘤患者疗效比较[例(%)]
VCD与VD方案治疗初诊细胞遗传学高危多发性骨髓瘤患者疗效比较[例(%)]
| 组别 | 例数 | 总有效 | 缓解 | 完全缓解 |
|---|---|---|---|---|
| VCD组 | 14 | 11(78.6) | 5(35.7) | 2(14.3) |
| VD组 | 12 | 9(75.0) | 4(33.3) | 0 |
| P值 | 1.000 | 1.000 | 0.483 |
注:VCD方案为硼替佐米+环磷酰胺+地塞米松;VD方案为硼替佐米+地塞米松
两组最常见的不良反应均为周围神经炎[41%(17/41)比38%(12/32)]和血小板减少[37%(15/41)比34%(11/32)]。大多数不良反应均为1~2级,两组差异均无统计学意义(均P>0.05)。3级不良反应最常见为周围神经病变,VCD组发生率高于VD组[20%(8/41)比13%(4/32)],3级中性粒细胞减少症只发生于VCD组[2%(1/41)比0],3级血小板减少症[13%(4/32)比10%(4/41)]、严重呼吸道感染[6%(2/32)比5%(2/41)]均在VD组发生率高,两组间比较差异均无统计学意义(P>0.05)(表4)。上述不良反应经对症治疗及调整剂量均能改善或好转,未见4级不良反应和因药物不良反应而导致死亡的患者。
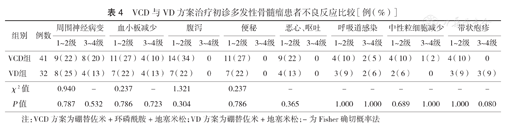
VCD与VD方案治疗初诊多发性骨髓瘤患者不良反应比较[例(%)]
VCD与VD方案治疗初诊多发性骨髓瘤患者不良反应比较[例(%)]
| 组别 | 例数 | 周围神经病变 | 血小板减少 | 腹泻 | 便秘 | 恶心、呕吐 | 呼吸道感染 | 中性粒细胞减少 | 带状疱疹 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1~2级 | 3~4级 | 1~2级 | 3~4级 | 1~2级 | 3~4级 | 1~2级 | 3~4级 | 1~2级 | 3~4级 | 1~2级 | 3~4级 | 1~2级 | 3~4级 | 1~2级 | 3~4级 | ||
| VCD组 | 41 | 9(22) | 8(20) | 11(27) | 4(10) | 14(34) | 0 | 11(27) | 0 | 9(22) | 0 | 4(10) | 2(5) | 4(10) | 1(2) | 4(10) | 0 |
| VD组 | 32 | 8(25) | 4(13) | 7(22) | 4(13) | 7(22) | 0 | 7(22) | 0 | 4(13) | 0 | 3(9) | 2(6) | 2(6) | 0 | 3(9) | 3(9) |
| χ2值 | 0.940 | - | 0.237 | - | 1.321 | 0.237 | - | - | - | - | - | - | - | ||||
| P值 | 0.787 | 0.532 | 0.786 | 0.723 | 0.304 | 0.786 | 0.365 | 1.000 | 1.000 | 0.689 | 1.000 | 1.000 | 0.080 | ||||
注:VCD方案为硼替佐米+环磷酰胺+地塞米松;VD方案为硼替佐米+地塞米松;-为Fisher确切概率法
两组患者中,VCD组死亡11例,VD组死亡9例。VCD组中位PFS时间27个月,VD组中位PFS时间24个月,两组PFS率差异无统计学意义(χ2=0.130,P=0.72)。VCD组中位OS时间35个月,VD组中位OS时间33个月,两组OS率比较差异无统计学意义(χ2=0.516,P=0.47)(图1)。
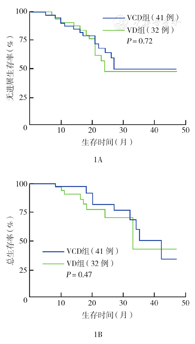

注:VCD方案为硼替佐米+环磷酰胺+地塞米松;VD方案为硼替佐米+地塞米松
VCD组高危患者中位PFS时间17个月,VD组高危患者中位PFS时间16个月,两组PFS率比较差异无统计学意义(χ2=0.672,P=0.412)。VCD组高危患者中位OS时间20个月,VD组高危患者中位OS时间18个月,两组OS率比较差异无统计学意义(χ2=1.656,P=0.198)(图2)。因非高危组例数较少,未进行统计学分析。
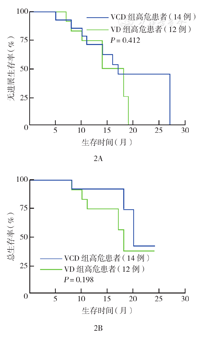

注:VCD方案为硼替佐米+环磷酰胺+地塞米松;VD方案为硼替佐米+地塞米松
目前MM仍是无法治愈的疾病。诱导治疗后获深度反应的患者,其PFS和OS期明显延长[7]。硼替佐米为主方案作为NDMM的一线诱导方案,较传统方案有更高的有效率,特别是CR率。我们早期的一项小样本报道[8],硼替佐米为主方案治疗初发及复发难治MM患者的有效率为60%[≥接近完全缓解(nCR)率为40%]。本研究中VCD方案的总有效率为80.5%。国外最近的一项Ⅱ期临床研究表明[9],VCD方案治疗NDMM患者的总有效率为85.4%(≥VGPR率为40.4%),序贯大剂量化疗/自体造血干细胞移植后(HDT/ASCT),总有效率可达95.5%(≥VGPR率为67.0%)。临床研究发现同时含有两种新药的治疗方案有更高的总有效率,如含蛋白酶体抑制剂及免疫调节剂的VTD(硼替佐米+沙利度胺+地塞米松)及VRD(硼替佐米+来那度胺+地塞米松)方案总有效率分别达93%~100%(≥VGPR率为62%~69%)和100%(≥VGPR率为67%)[10,11,12]。而同时含两种新药的联合方案诱导治疗后序贯自体造血干细胞移植(ASCT)是否比只含1种新药的联合方案有更长的生存期,目前尚无定论。有研究表明,VCD与VRD方案治疗NDMM患者,总体反应率、PFS、OS及不良反应差异均无统计学意义[13,14],进一步研究若考虑经济因素及医疗资源利用率,诱导治疗中VCD方案优于VRD方案。
多数研究表明三药联合较两药联合方案有更高的缓解率。但VCD方案疗效是否优于VD方案,目前报道不一。Davies等[15]报道,VCD与VD方案治疗复发难治MM患者,VCD方案总反应率(75%比31%)及CR率(47%比5%)高于VD组。两组在血小板减少、中性粒细胞减少及周围神经病变等不良反应方面差异无统计学意义。国内张亚平和王信峰[16]报道,VCD与VD方案治疗NDMM患者,4个疗程后两组总有效率分别为91.3%和89.3%(P>0.05),但VCD较VD方案有更高的CR率(39.1%比10.7%,P<0.05)。两组常见不良反应比较差异无统计学意义。而一项随机的Ⅲ期临床试验表明[17],VCD与VD方案治疗复发难治MM患者,总体反应率VD组略低于VCD组(70%比74%),中位进展时间VCD组略短于VD组(9.9个月比12.6个月,P=0.192),中位随访24个月,两组OS时间差异无统计学意义。两组不良反应基本相似。
细胞遗传学异常在含有新药的方案中对预后有着不同的影响。一项Ⅱ期临床研究[9]表明,VCD治疗初治MM患者,无论细胞遗传学高危还是非高危患者,均有很高的缓解率(84.3%与86.2%)。总体反应率在del(13q)患者中最高(90.2%),在del(17p)患者中最低(74.2%)。此外,t(4;14)患者对VCD诱导治疗有较高的反应率(89.5%);对随后行ASCT的患者中位随访55.5个月,发现细胞遗传学高危患者较非高危患者中位PFS和OS时间缩短(19.9个月比43.6个月;54.07个月比未达到)。本研究中VCD与VD方案治疗细胞遗传学高危患者有效率分别为78.6%与75.0%,差异无统计学意义;VCD组细胞遗传学高危患者CR率为14.3%,高于VD组。两组细胞遗传学高危患者中位PFS时间、中位OS时间差异均无统计学意义(P>0.05)。在后续研究中,有待加强初诊患者FISH检测。
VCD与VD方案组最常见的不良反应均为周围神经病变与血小板减少症,VCD组不良反应的发生率高于VD组,但比较差异均无统计学意义。其他常见的不良反应有腹泻、呼吸道感染等,NCI-CTCAE分级多在2级以下,两组比较差异均无统计学意义。本研究3级不良反应中发生率最高的为周围神经病变(20%),高于文献报道(2.8%~8.7%)[9,16]。周围神经病变为硼替佐米的最大不良反应,文献[18,19]报道每周给药1次,可使发生率显著下降。
综上所述,VCD和VD方案均可作为初诊MM患者的一线诱导方案。VCD方案可提高患者的缓解深度,但PFS及OS无明显差别,两组不良反应相似。因本研究病例数少,随访时间短,未来有望通过前瞻性的研究进一步明确两组方案的疗效及不良反应。
无



























