
探讨血细胞分析仪在恶性血液病初步诊断中的作用。
采用SYSMEX XE-2100血细胞分析仪的血细胞分类计数(DIFF)散点图和报警信息,对山西医科大学第二医院2016年10月至2017年2月收治的121例初发恶性血液病住院患者的血常规结果进行分析。
121例恶性血液病患者中,96例(79.3%)出现DIFF散点图异常。急性淋巴细胞白血病、慢性淋巴细胞白血病、急性早幼粒细胞白血病、慢性粒细胞白血病患者的DIFF散点图具有各自明显的特点,其他疾病类型的DIFF散点图特征不明显。经血涂片证实,血细胞分析中警示有原始细胞者符合率为87.7%(50/57),有未成熟粒细胞者符合率为76.3%(42/55),有有核红细胞者符合率为33.3%(19/57),有异型淋巴细胞者符合率为43.1%(31/72)。
血细胞分析仪DIFF散点图及报警信息在恶性血液病诊断中具有重要作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
恶性血液病是造血器官(骨髓和淋巴组织)的原发肿瘤,包括白血病、淋巴瘤、多发性骨髓瘤(MM)等[1],患者可见不同程度的贫血、出血、感染、发热、肝大、脾大、淋巴结肿大、关节疼痛等,尽早诊断对治疗和预后有重要意义。2016年世界卫生组织根据基因分子生物学、细胞遗传学等的研究进展更新了髓系肿瘤和急性白血病的分类[2]。同年,Papaemmanuil等[3]对1 540例AML患者进行了全基因组测序,并提出11个具有不同预后的亚群。然而,恶性血液病的诊治目前仍面临诸多挑战[4]。血细胞五分类检测是临床常规筛查手段,在恶性血液病的早期诊断方面,散点图相比于数据和直方图具有明显优势。我们通过对血细胞分析仪血细胞分类计数(DIFF)散点图及报警信息进行分析,探索其在恶性血液病诊断中的意义。
以2016年10月至2017年2月在我院初诊为恶性血液病的121例住院患者为研究对象,其中男性76例,女性45例;年龄17~74岁,中位年龄38岁。所有病例均符合国内血液病诊断标准[5],其中原始粒细胞白血病未分化型(M0)/原始粒细胞白血病部分分化型(M2)8例,急性早幼粒细胞白血病(M3)5例,急性粒-单核细胞白血病(M4)17例,急性单核细胞白血病(M5)4例,慢性粒细胞白血病(CML)12例,急性淋巴细胞白血病(ALL)12例,慢性淋巴细胞白血病(CLL)5例,淋巴瘤10例,MM 16例,再生障碍性贫血(AA)11例,骨髓增生异常综合征(MDS)21例。
采集所有患者空腹静脉血2 ml,乙二胺四乙酸(EDTA)抗凝,充分混匀后,采用日本Sysmex公司SYSMEX XE-2100血细胞分析仪及原装配套试剂(稀释液、鞘液、荧光染液、溶血剂、质控品)对样本进行检测。对符合复检规则的样本进行涂片镜检。
在121例血液病患者中,34例急性白血病患者WBC增高16例,Hb减少33例,Plt减少33例;16例MM患者WBC减少14例,Hb减少14例,Plt减少2例;21例MDS患者WBC减少14例,Hb减少20例,Plt减少17例;11例AA患者三系均显著减少(表1)。
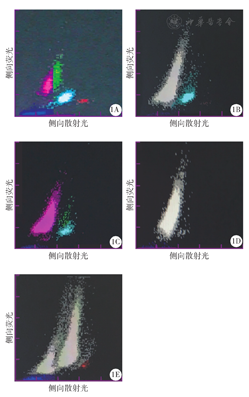
121例恶性血液病患者白细胞计数、血红蛋白和血小板计数情况(例)
121例恶性血液病患者白细胞计数、血红蛋白和血小板计数情况(例)
| 疾病类型 | 例数 | 白细胞计数 | 血红蛋白 | 血小板计数 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 正常 | 增高 | 减低 | 正常 | 增高 | 减低 | 正常 | 增高 | 减低 | |||
| AML | |||||||||||
| M0/M2 | 8 | 3 | 3 | 2 | 1 | 0 | 7 | 0 | 0 | 8 | |
| M3 | 5 | 0 | 1 | 4 | 0 | 0 | 5 | 1 | 0 | 4 | |
| M4 | 17 | 3 | 10 | 4 | 0 | 0 | 17 | 0 | 0 | 17 | |
| M5 | 4 | 0 | 2 | 2 | 0 | 0 | 4 | 0 | 0 | 4 | |
| CML | 12 | 0 | 12 | 0 | 0 | 0 | 12 | 5 | 5 | 2 | |
| ALL | 12 | 5 | 6 | 1 | 0 | 0 | 12 | 2 | 0 | 10 | |
| CLL | 5 | 0 | 7 | 0 | 1 | 0 | 6 | 4 | 0 | 3 | |
| MM | 16 | 14 | 0 | 2 | 2 | 0 | 14 | 14 | 0 | 2 | |
| AA | 11 | 3 | 0 | 8 | 0 | 0 | 11 | 1 | 0 | 10 | |
| 淋巴瘤 | 10 | 5 | 3 | 2 | 5 | 0 | 5 | 5 | 0 | 5 | |
| MDS | 21 | 7 | 0 | 14 | 1 | 0 | 20 | 4 | 0 | 17 | |
注:AML为急性髓系白血病;M0为原始粒细胞白血病未分化型;M2为原始粒细胞白血病部分分化型;M3为急性早幼粒细胞白血病;M4为急性粒-单核细胞白血病;M5为急性单核细胞白血病;CML为慢性粒细胞白血病;ALL为急性淋巴细胞白血病;CLL为慢性淋巴细胞白血病;MM为多发性骨髓瘤;AA为再生障碍性贫血;MDS为骨髓增生异常综合征
121例患者均出现至少1条报警信息(表2)。其中警示有原始细胞57例,血涂片证实50例(87.7%);有未成熟粒细胞55例,血涂片证实42例(76.3%);有有核红细胞57例,血涂片证实19例(33.3%);有异型淋巴细胞72例,血涂片证实31例(43.1%);贫血95例,血涂片观察红细胞大小形态及着色情况,大致推断有不同程度的贫血89例(93.7%);Plt减少82例,血涂片观察及显微镜人工计数证实79例(96.3%)。
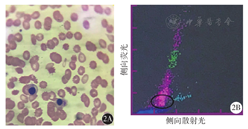
121例恶性血液病患者血细胞分析中出现的报警信息情况(例)
121例恶性血液病患者血细胞分析中出现的报警信息情况(例)
| 疾病类型 | 例数 | 原始细胞 | 未成熟粒细胞 | 异型淋巴细胞 | 有核红细胞 | 贫血 | 血小板异常直方图 | |
|---|---|---|---|---|---|---|---|---|
| AML | ||||||||
| M0/M2 | 8 | 7 | 6 | 7 | 3 | 5 | 8 | |
| M3 | 5 | 1 | 1 | 5 | 1 | 3 | 4 | |
| M4 | 17 | 15 | 14 | 14 | 15 | 16 | 17 | |
| M5 | 4 | 3 | 2 | 3 | 1 | 4 | 4 | |
| CML | 12 | 12 | 12 | 12 | 12 | 7 | 2 | |
| ALL | 12 | 9 | 7 | 11 | 5 | 10 | 10 | |
| CLL | 7 | 1 | 1 | 5 | 4 | 3 | 3 | |
| MM | 16 | 2 | 4 | 0 | 3 | 13 | 2 | |
| AA | 11 | 0 | 1 | 6 | 1 | 11 | 10 | |
| 淋巴瘤 | 10 | 2 | 1 | 3 | 2 | 4 | 5 | |
| MDS | 21 | 5 | 6 | 6 | 10 | 19 | 17 | |
注:AML为急性髓系白血病;M0为原始粒细胞白血病未分化型;M2为原始粒细胞白血病部分分化型;M3为急性早幼粒细胞白血病;M4为急性粒-单核细胞白血病;M5为急性单核细胞白血病;CML为慢性粒细胞白血病;ALL为急性淋巴细胞白血病;CLL为慢性淋巴细胞白血病;MM为多发性骨髓瘤;AA为再生障碍性贫血;MDS为骨髓增生异常综合征
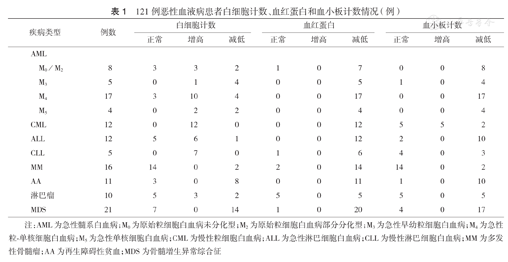
121例患者中,DIFF散点图出现不同程度异常96例(79.3%),DIFF散点图未出现异常的主要是AA、MDS、MM和淋巴瘤患者。白细胞未分类的DIFF散点图中,10例CML患者的DIFF散点图有较一致特征,12例ALL患者中8例DIFF散点图基本类似,5例M3患者的DIFF散点图也较一致,7例CLL患者的DIFF散点图也有一致特征(图1)。其他恶性血液病患者的DIFF散点图则无明显一致特征。

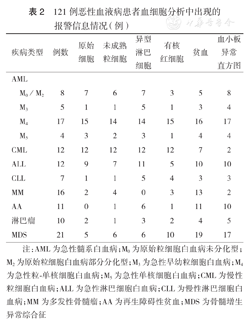
1例患者血细胞分析结果示:WBC 2.35×109/L,红细胞计数(RBC)3.04×1012/L,Hb 85 g/L,中性粒细胞比例0.03,淋巴细胞比例0.91,单核细胞比例0.06,嗜酸性粒细胞比例0,嗜碱性粒细胞比例0.04。DIFF散点图及光学显微镜下观察可见有核红细胞区域。有核红细胞通道检测结合显微镜观察结果显示,每100个白细胞对应有196个有核红细胞,经校正,该患者的实际WBC为0.80×109/L。结合细胞的形态特点(图2A),有核红细胞在DIFF通道散点图中位于淋巴细胞的下方(图2B),据此可在实际工作中预测是否存在有核红细胞以及估计其量的多少。

SYSMEX XE-2100全自动血细胞分析仪在白细胞分类上采用半导体激光的流式细胞技术结合阻抗与射频联合检测技术对细胞进行分类。半导体激光照射在通过鞘液包裹的单束细胞上,可根据细胞产生的前向散射光(FSC)、侧向散射光(SSC)、侧向荧光(SFL)来鉴别细胞类型。FSC反映细胞体积,SSC反映细胞内容物(颗粒和细胞核),SFL强度反映细胞DNA和RNA含量[6,7]。DIFF散点图以SFL为纵坐标,SSC为横坐标。幼稚粒细胞的DNA比成熟的粒细胞多,通常有着较强的荧光信号,所以在DIFF散点图中,粒细胞越幼稚,相应位置也越高,因此其在恶性血液病的早期诊断中有重要作用。本研究结果显示,121例恶性血液病患者中白血病患者占54%,其中WBC升高者占65%,减少者占21%;Hb减少者占100%,Plt减少者占76%,所以初诊白血病患者血细胞数变化多样,临床工作中要结合DIFF散点图、报警信息等进行综合分析。本研究中79.3%的患者出现了DIFF散点图的异常,虽然患者的DIFF散点图有很大异质性,但ALL、CLL、M3、CML患者的DIFF散点图具有各自明显的特点,这与文献[8,9]报道一致。ALL形态学以原始幼稚淋巴细胞增加为主,所以DIFF散点图淋巴细胞和单核细胞区域之间分界不清甚至融合,出现大量灰白色散点,有向上扩散趋势;CLL中以成熟淋巴细胞为主,达90%以上,所以DIFF散点图中淋巴细胞区域浓密且向单核细胞区域延伸;M3形态学以异常早幼粒细胞为主要特征,白细胞分化不良且不分类,各细胞群融合为灰色区域;CML中白细胞显著增多,以中幼、晚幼和杆状核粒细胞为主,伴有嗜酸、嗜碱性粒细胞增多,DIFF散点图中中性粒细胞浓集且范围增大,淋巴细胞和单核细胞区域分界清晰。因此,日常工作中,可以根据DIFF散点图大概推测血液病的类型。
报警信息警示有核红细胞的可信度较低,因此应结合DIFF散点图来综合评判。有核红细胞由于有细胞核,不能被溶血素破坏,容易被当作白细胞而干扰白细胞的计数,当前很多全血细胞分析仪,包括SYSMEX XE-2100分析仪,都具备专用通道用于有核红细胞计数[6],但仍需要检测人员依据DIFF散点图和报警信息分辨出有核红细胞增多的病例。外周血中出现的有核红细胞多为晚幼红细胞,而晚幼红细胞在形态上与淋巴细胞有相似性,即核固缩、胞质无颗粒,因此,其在DIFF散点图中位于淋巴细胞下方,在有核红细胞散点图中也有区域显示。
综上,在血细胞分析中,要足够重视仪器提示的各种信息,特别是DIFF散点图和报警信息,力求为血液病诊断提供早期提示信息。同时要结合临床表现和形态学、免疫学、细胞遗传学及分子生物学等结果,反向验证血细胞分析结果,进而提高处理DIFF散点图及报警信息的能力,尽早为临床精准的诊疗提供帮助。
无



























