
探讨急性髓系白血病(AML)患者CD34、CD123、CD38的表达及其临床意义。
收集2014年2月至2015年7月中南大学湘雅医院164例AML患者,用流式细胞术检测患者细胞免疫分型。根据CD34、CD38、CD123的表达情况,将患者分成阳性组与阴性组,对两组的临床资料及骨髓象进行比较分析。
164例AML患者中,CD34阳性102例,阳性率62.2%;CD123阳性126例,阳性率76.8%;CD38阳性144例,阳性率88.3%。各项阳性组与阴性组患者年龄、性别比较差异均无统计学意义(P>0.05);两组患者骨髓中幼稚细胞比例、白细胞计数及血红蛋白水平比较差异均有统计学意义(均P<0.05)。CD34、CD38、CD123表达率与微小残留病发生率、疾病完全缓解率有相关性(均P<0.05)。
CD34、CD123、CD38是AML检测的有效标志物,其表达可作为细胞成熟度的判断标志,有利于AML患者病情及预后的判定。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是一种常见的造血系统恶性肿瘤。采用流式细胞术应用单克隆抗体,能够鉴定细胞表面或胞质中免疫标志,分析细胞的分化阶段,从而指导临床分型、治疗方案选择及预后判断。CD34为造血干/祖细胞抗原标志物,在正常骨髓白细胞中表达率为2%~4%,而在AML细胞上则有较高的表达率[1]。有研究报道,CD123在急性白血病(AL)细胞中普遍表达,而正常骨髓干细胞很少表达[2]。亦有研究报道,CD123、CD38与急性淋巴细胞白血病预后有着密切联系[3,4],但CD123、CD38在AML中诊断与恶性程度评估的作用报道很少。我们对CD34、CD123、CD38在AML中的表达进行了探讨,现报道如下。
中南大学湘雅医院2014年2月至2015年7月收治的AML患者164例,男性81例,女性82例,年龄1~84岁,平均年龄42.56岁。按法、美、英(FBA)标准进行分型,其中M0 17例,M1 41例,M2 48例,M3 14例,M4、M5 34例,M6 10例。所有患者均排除有严重心、肺、脑、肝、肾等器官功能障碍及其他血液系统疾病。AML诱导治疗方案采用HADH、LA、DA等方案。疗效判断根据1987年苏州全国白血病化疗会议制订的标准:(1)临床无贫血、出血、感染及白血病细胞浸润表现;(2)外周血血红蛋白水平>90 g/L,白细胞计数正常或减低,白细胞分类无幼稚细胞,血小板计数>100×109/L;(3)骨髓象原始细胞加早幼阶段细胞(或幼稚细胞)<0.05,红细胞系统及巨核细胞系统正常。
采用FACS-calibur流式细胞仪(美国BD公司)进行检测。异硫氰酸荧光素(FITC)标志的单抗为:CD3、CD7、CD14、CD19、CD20、CD22、HLA-DR、cMPO、CD38;藻红蛋白(PE)标志的单抗为:CD2、CD5、CD10、CD13、CD33、CD34、CD117、CD96、CD123;多甲藻叶绿素蛋白(Pre-CP)标志的单抗为:CD45、CD34。所有抗体均购自美国BD公司。
患者骨髓涂片采用瑞特姬萨姆染色,于油镜下观察计数200个细胞,并进行过氧化物酶染色、过碘酸雪夫反应及醋酸萘酚酯酶染色和氟化钠抑制试验等细胞化学染色。
乙二胺四乙酸钠(EDTA-Na2)抗凝管采集患者骨髓1~2 ml,采集后6 h内处理,待测样品白细胞计数控制在(1.0~2.0)×105/L,取50 μl备用细胞与20 μl单抗混匀后,室温避光培养20 min,再向各试管中加入溶血素1 ml,振荡混匀后置室温避光培养10 min,400×g离心5 min,去上清,PBS洗涤2次,加入500 μl 1%多聚甲醛PBS,于4 ℃保存,24 h内上机检测。阳性判断标准:骨髓原始细胞≥0.20,CD38、HLA-DR均≥20%或CD3、cMPO≥10%,其他抗体≥20%。根据CD34、CD123、CD38的表达情况,将164例AML患者分成阳性组与阴性组,并对两组的临床资料及骨髓细胞进行比较分析。
采用SPSS 18.0统计软件进行统计学分析。计量资料符合正态分布,采用 ±s表示,两组间比较采用t检验;计数资料两组间比较采用χ2检验,以P<0.05为差异有统计学意义。
±s表示,两组间比较采用t检验;计数资料两组间比较采用χ2检验,以P<0.05为差异有统计学意义。
164例AML患者中,CD34阳性106例,阳性率64.6%;CD123阳性125例,阳性率76.2%;CD38阳性131例,阳性率79.9%。CD34、CD123、CD38阳性组与阴性组患者年龄及性别差异均无统计学意义(均P>0.05);两组患者骨髓幼稚细胞比例、白细胞计数及血红蛋白水平差异均有统计学意义(均P<0.05)(表1);两组患者CD34与CD123表达有相关性(P<0.05)(表2),二者与CD38表达均无相关性(均P>0.05)。
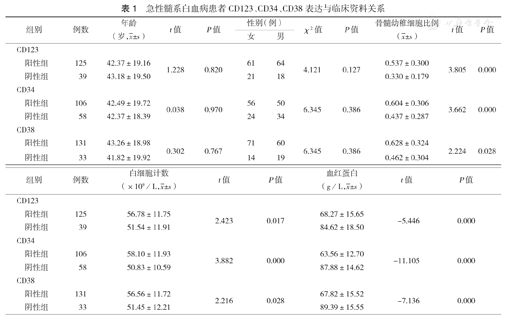
急性髓系白血病患者CD123、CD34、CD38表达与临床资料关系
急性髓系白血病患者CD123、CD34、CD38表达与临床资料关系
| 组别 | 例数 | 年龄(岁, ±s) ±s) | t值 | P值 | 性别(例) | χ2值 | P值 | 骨髓幼稚细胞比例( ±s) ±s) | t值 | P值 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 女 | 男 | |||||||||||
| CD123 | ||||||||||||
| 阳性组 | 125 | 42.37±19.16 | 1.228 | 0.820 | 61 | 64 | 4.121 | 0.127 | 0.537±0.300 | 3.805 | 0.000 | |
| 阴性组 | 39 | 43.18±19.50 | 21 | 18 | 0.330±0.179 | |||||||
| CD34 | ||||||||||||
| 阳性组 | 106 | 42.49±19.72 | 0.038 | 0.970 | 56 | 50 | 6.345 | 0.386 | 0.604±0.306 | 3.662 | 0.000 | |
| 阴性组 | 58 | 42.37±18.39 | 24 | 34 | 0.437±0.287 | |||||||
| CD38 | ||||||||||||
| 阳性组 | 131 | 43.26±18.98 | 0.302 | 0.767 | 71 | 60 | 6.345 | 0.386 | 0.628±0.324 | 2.224 | 0.028 | |
| 阴性组 | 33 | 41.82±19.92 | 14 | 19 | 0.462±0.304 | |||||||
| 组别 | 例数 | 白细胞计数(×109/L, ±s) ±s) | t值 | P值 | 血红蛋白(g/L, ±s) ±s) | t值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| CD123 | ||||||||
| 阳性组 | 125 | 56.78±11.75 | 2.423 | 0.017 | 68.27±15.65 | - 5.446 | 0.000 | |
| 阴性组 | 39 | 51.54±11.91 | 84.62±18.50 | |||||
| CD34 | ||||||||
| 阳性组 | 106 | 58.10±11.93 | 3.882 | 0.000 | 63.56±12.70 | - 11.105 | 0.000 | |
| 阴性组 | 58 | 50.83±10.59 | 87.88±14.62 | |||||
| CD38 | ||||||||
| 阳性组 | 131 | 56.56±11.72 | 2.216 | 0.028 | 67.82±15.52 | - 7.136 | 0.000 | |
| 阴性组 | 33 | 51.45±12.21 | 89.39±15.55 | |||||
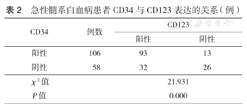
急性髓系白血病患者CD34与CD123表达的关系(例)
急性髓系白血病患者CD34与CD123表达的关系(例)
| CD34 | 例数 | CD123 | |
|---|---|---|---|
| 阳性 | 阴性 | ||
| 阳性 | 106 | 93 | 13 |
| 阴性 | 58 | 32 | 26 |
| χ2值 | 21.931 | ||
| P值 | 0.000 | ||
对经诱导化疗后获CR的79例AML患者采用流式细胞术进行MRD细胞检测(图1),分析MRD发生与CD34、CD38、CD123表达率的关系。结果发现,MRD发生与CD34、CD38、CD123表达率均有相关性(均P<0.05)。CD34、CD123双阳性患者MRD发生率较高(表3)。
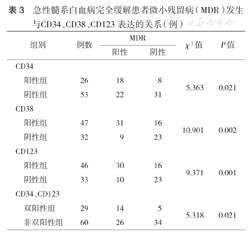
急性髓系白血病完全缓解患者微小残留病(MDR)发生与CD34、CD38、CD123表达的关系(例)
急性髓系白血病完全缓解患者微小残留病(MDR)发生与CD34、CD38、CD123表达的关系(例)
| 组别 | 例数 | MDR | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| 阳性 | 阴性 | |||||
| CD34 | ||||||
| 阳性组 | 26 | 18 | 8 | 5.363 | 0.021 | |
| 阴性组 | 53 | 22 | 31 | |||
| CD38 | ||||||
| 阳性组 | 47 | 31 | 16 | 10.901 | 0.002 | |
| 阴性组 | 32 | 9 | 23 | |||
| CD123 | ||||||
| 阳性组 | 46 | 30 | 16 | 9.371 | 0.001 | |
| 阴性组 | 33 | 10 | 23 | |||
| CD34、CD123 | ||||||
| 双阳性组 | 29 | 14 | 5 | 5.318 | 0.021 | |
| 非双阳性组 | 60 | 26 | 34 | |||

注:R3为残留白血病细胞
分析白血病患者缓解率与CD34、CD38、CD123表达率的关系,结果发现,CR率与CD34、CD38、CD123表达率均有相关性(均P<0.05)。CD34、CD123双阳性患者CR率较低(表4)。
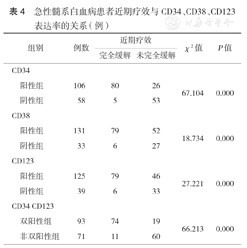
急性髓系白血病患者近期疗效与CD34、CD38、CD123表达率的关系(例)
急性髓系白血病患者近期疗效与CD34、CD38、CD123表达率的关系(例)
| 组别 | 例数 | 近期疗效 | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| 完全缓解 | 未完全缓解 | |||||
| CD34 | ||||||
| 阳性组 | 106 | 80 | 26 | 67.104 | 0.000 | |
| 阴性组 | 58 | 5 | 53 | |||
| CD38 | ||||||
| 阳性组 | 131 | 79 | 52 | 18.734 | 0.000 | |
| 阴性组 | 33 | 6 | 27 | |||
| CD123 | ||||||
| 阳性组 | 125 | 79 | 46 | 27.221 | 0.000 | |
| 阴性组 | 39 | 6 | 33 | |||
| CD34 CD123 | ||||||
| 双阳性组 | 93 | 74 | 19 | 66.213 | 0.000 | |
| 非双阳性组 | 71 | 11 | 60 | |||
大量研究表明,白血病细胞起源于白血病干细胞(LSC),LSC具有与正常造血干细胞类似的自我更新和无限增殖能力,是白血病发生发展及耐药和复发的根本原因[5,6]。LSC主要起源于多能造血干细胞(HSC)和早期造血祖细胞。CD34抗原是连续表达于造血干/祖细胞的一种细胞分化抗原高度糖基化的跨膜蛋白[7],从干细胞开始直至造血前体细胞。目前已证实CD34是造血干祖细胞分选的重要标志[8]。CD34常为AML预后不良因素[9],尤其与CD7或多耐药基因(MDR1)共表达时,常提示预后不良。CD34在AML中阳性表达国内报道不一,多在23.0%~61.0%,本研究中CD34阳性表达率为64.6%,CD34阳性组幼稚细胞比例明显高于阴性组,与文献报道基本一致。表明CD34表达与AML有相关性,能够为AML恶性程度判断提供一定的参考。
CD123又称白细胞介素3受体α(IL-3Rα),是高亲和性IL-3受体的重要组成部分,在LSC中高表达而正常HSC中几乎检测不到,可作为LSC的特异性标志。CD123与IL-3相互作用可促进造血干/祖细胞的生存、增殖和分化[10,11,12]。国外学者报道发现,IL-3R氨基酸序列的突变可诱发一系列信号转导的变化,从而引发肺脏腺癌及白血病的发生[13,14]。而国内也有研究表明,AL高危患者CD123表达率高于低危患者,提示CD123的表达与预后相关,CD123表达高提示预后不良。这可能与白血病干细胞含量高或FLT3突变有关导致患者对化疗药物不敏感成为患者复发和耐药的根源。此外,有研究者将纯化的CD34+ CD123+白血病细胞移植给有免疫缺陷的NOD/SCID小鼠,结果表明该细胞可在小鼠体内建立和保持白血病细胞群。本研究发现AML患者CD123表达率为76.2%,CD34阳性患者CD123表达率为87.7%,与以往报道一致,提示CD123是AML检测的有效标志。本研究还发现,CD34阳性患者中CD123阳性表达率明显增高,与已有报道在初治AML患者中CD34+细胞表面CD123高表达的结果一致,两者的内在联系及分子机制有待进一步研究。
CD38为单链Ⅱ型跨膜糖蛋白,广泛表达于多种正常造血细胞表面,参与细胞生长和分化的调节。CD38的表达可影响白血病细胞的增殖、分化和疾病的转归。CD38作为慢性淋巴细胞白血病患者的独立风险因素已逐渐被肯定[15,16],一些研究认为CD38表达对AML患者临床化疗疗效判断无明显指导意义。但本研究发现AML患者CD38表达率高达79.9%,且CD38阳性组幼稚细胞比例明显高于阴性组。因此,CD38与AML发病有一定的相关性,同时也可以考虑作为评估细胞成熟度的指标之一。
在初发AML患者中,外周血白细胞数量增高、贫血、血小板数降低及原始幼稚细胞比例高等常提示预后不良。本研究发现CD34、CD38、CD123与原始幼稚细胞比例、外周血白细胞及血红蛋白量有一定联系。随着原始幼稚细胞比例、患者外周血白细胞数增高及血红蛋白的降低,CD34、CD38、CD123表达率明显增高,CD34、CD38、CD123表达与AML预后有一定联系。
MDR是白血病复发的关键因素,残留白血病克隆性再生的特点类似于实体瘤的微小转移,先是原位增殖形成白血病细胞灶,当白血病细胞增殖到一定时间开始向外迁移,导致白血病复发。本研究白血病患者中,诱导缓解治疗后CD34、CD38、CD123阳性患者中CR率明显较低,而CD34、CD123双阳性患者CR率更低。CD34、CD38、CD123阳性组MDR阳性率明显增高,而CD34、CD123双阳性患者MDR阳性率更高。提示CD34、CD123的表达与白血病预后及复发有关。
总之,CD34、CD38、CD123能够作为AML的诊断指标,且与AML预后有一定联系,能够作为预后判定指标之一,并为白血病治疗方案的确定提供一定理论依据。进一步探究CD34、CD123、CD38与AML的关系,有望为AML的预后评估提供新的辅助指标。
无



























