
探讨骨髓免疫病理在淋巴瘤诊断与分期中的临床意义。
回顾性分析吉林大学第一医院肿瘤中心血液科2015年8月至2017年12月收治的266例初诊淋巴瘤患者的临床资料,比较不同骨髓检测方法对淋巴瘤诊断与分期的结果。使用SPSS 22.0软件进行统计学分析,采用χ2检验比较不同方法检测淋巴瘤骨髓浸润的阳性率。
266例患者中,64例(24.1%)无淋巴结病理检查结果,通过骨髓检测明确淋巴瘤的诊断;64例(24.1%)通过骨髓免疫病理检测结果明确淋巴瘤具体分型。266例淋巴瘤患者中,121例(45.5%)经骨髓检测确定为骨髓浸润;其中霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)骨髓浸润率分别为0(0/12)和47.6%(121/254),NHL中B细胞型及T细胞型骨髓浸润率分别为50.0%(105/210)和36.4%(16/44)。经骨髓检测确定为骨髓浸润的121例患者中,经骨髓涂片、骨髓活组织检查、骨髓流式细胞术、骨髓免疫病理检测的阳性率分别为78.5%(95/121)、87.6%(106/121)、89.3%(108/121)、96.7%(117/121);骨髓免疫病理检测阳性率高于其他检测方法,差异均有统计学意义(χ2值分别为18.38、9.09、3.76,均P<0.05)。经骨髓检测确定的121例骨髓浸润患者中,纠正临床分期42例(34.7%),其中通过骨髓免疫病理检测纠正者39例(32.2%)。
骨髓免疫病理可用于淋巴瘤的诊断与分型,其检测淋巴瘤骨髓浸润优于骨髓涂片、骨髓活组织检查及骨髓流式细胞术,并且可用于修正临床分期。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
淋巴瘤是一组起源于淋巴造血组织的恶性疾病[1],发病率居所有恶性肿瘤的第7位[2],且以每年约4%的速度递增[3],是发病率增长最快的恶性肿瘤之一。当淋巴瘤发生骨髓浸润时,疾病的分期达到Ⅳ期,直接影响治疗策略的选择,因此明确是否伴有骨髓浸润对淋巴瘤的精确分期、个体化治疗和预后评估具有重大意义[4]。骨髓活组织检查是各指南推荐的检测淋巴瘤骨髓浸润的金标准。骨髓免疫病理在骨髓活组织检查的基础上,对淋巴细胞免疫表型进行分析,不仅可以确定淋巴瘤骨髓浸润,还可以确定淋巴瘤具体分型,对于诊断无法获得淋巴结病理结果的患者极为重要,同时对评估疗效及微小残留病(MRD)也具有重要意义[5,6,7,8]。国内有关骨髓免疫病理对淋巴瘤诊断与分期的意义鲜见系统报道。本研究回顾性分析了266例淋巴瘤患者骨髓检测结果,以提高对骨髓免疫病理临床意义的认识。
收集吉林大学第一医院肿瘤中心血液科2015年8月至2017年12月初诊并进行骨髓检测的266例淋巴瘤患者的临床资料,其中男性158例,女性108例;中位年龄55岁(12~89岁);非霍奇金淋巴瘤(NHL)254例,霍奇金淋巴瘤(HL)12例。分析骨髓涂片、骨髓活组织检查、骨髓流式细胞术、骨髓免疫病理对淋巴瘤的诊断及分期情况。所有患者均知情同意,并获得本院伦理委员会批准(批准文号:2015-258)。
标本均经4%甲醛溶液固定,石蜡包埋,切片后参考EliVision法进行免疫组织化学染色,使用二氨基联苯胺(DAB)染色,苏木精-伊红(HE)对比染色,所有抗体均购自福州迈新生物技术开发有限公司。统计骨髓免疫病理纠正临床分期情况。
利用MACSQuant 10流式细胞仪(德国Miltenyi公司)及MACSQuantify软件行免疫荧光分析。采用CD45/SSC设门,经多参数分析,确定免疫表型。
运用SPSS 22.0软件进行统计学分析,采用χ2检验比较4种方法检测淋巴瘤骨髓浸润的阳性率。P<0.05为差异有统计学意义。
266例淋巴瘤患者均完成骨髓涂片、骨髓活组织检查、骨髓免疫病理、骨髓流式细胞术检测,确定121例(45.5%)患者伴骨髓浸润;其中HL和NHL患者骨髓浸润率分别为0(0/12)和47.6%(121/254),NHL中B细胞型NHL(B-NHL)及T细胞型NHL(T-NHL)骨髓浸润率分别为50.0%(105/210)和36.4%(16/44)。266例患者中,64例(24.1%)无淋巴结活组织检查病理结果,通过骨髓检测诊断为淋巴瘤;64例(24.1%)通过骨髓免疫病理明确淋巴瘤分型;45例(16.9%)通过骨髓流式细胞术明确淋巴瘤分型。不同病理类型淋巴瘤骨髓浸润情况见表1。
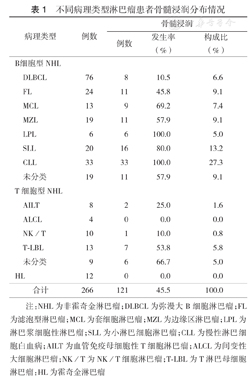
不同病理类型淋巴瘤患者骨髓浸润分布情况
不同病理类型淋巴瘤患者骨髓浸润分布情况
| 病理类型 | 例数 | 骨髓浸润 | |||
|---|---|---|---|---|---|
| 例数 | 发生率(%) | 构成比(%) | |||
| B细胞型NHL | |||||
| DLBCL | 76 | 8 | 10.5 | 6.6 | |
| FL | 24 | 11 | 45.8 | 9.1 | |
| MCL | 13 | 9 | 69.2 | 7.4 | |
| MZL | 19 | 11 | 57.9 | 9.1 | |
| LPL | 6 | 6 | 100.0 | 5.0 | |
| SLL | 20 | 16 | 80.0 | 13.2 | |
| CLL | 33 | 33 | 100.0 | 27.3 | |
| 未分类 | 19 | 11 | 57.9 | 9.1 | |
| T细胞型NHL | |||||
| AILT | 8 | 2 | 25.0 | 1.6 | |
| ALCL | 4 | 0 | 0.0 | 0.0 | |
| NK/T | 10 | 1 | 10.0 | 0.8 | |
| T⁃LBL | 13 | 7 | 53.8 | 5.8 | |
| 未分类 | 9 | 6 | 66.7 | 5.0 | |
| HL | 12 | 0 | 0.0 | 0.0 | |
| 合计 | 266 | 121 | 45.5 | 100.0 | |
注:NHL为非霍奇金淋巴瘤;DLBCL为弥漫大B细胞淋巴瘤;FL为滤泡型淋巴瘤;MCL为套细胞淋巴瘤;MZL为边缘区淋巴瘤;LPL为淋巴浆细胞性淋巴瘤;SLL为小淋巴细胞淋巴瘤;CLL为慢性淋巴细胞白血病;AILT为血管免疫母细胞性T细胞淋巴瘤;ALCL为间变性大细胞淋巴瘤;NK/T为NK/T细胞淋巴瘤;T-LBL为T淋巴母细胞淋巴瘤:HL为霍奇金淋巴瘤
经骨髓检测确定发生骨髓浸润的121例患者中,骨髓涂片、骨髓活组织检查、骨髓流式细胞术、骨髓免疫病理检测骨髓浸润的阳性率分别为78.5%(95例)、87.6%(106例)、89.3%(108例)、96.7%(117例),骨髓免疫病理检测阳性率均高于前三项检测方法,差异有统计学意义(χ2值分别为18.38、9.09、3.76,P值分别为<0.001、0.001、0.049)。
经骨髓检测确定的121例骨髓浸润患者中,共纠正临床分期42例(34.7%)。4种骨髓检测方法比较,骨髓免疫病理纠正临床分期最明显,纠正率为32.2%(39例)(表2)。
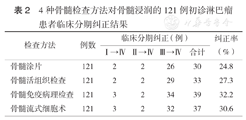
4种骨髓检查方法对骨髓浸润的121例初诊淋巴瘤患者临床分期纠正结果
4种骨髓检查方法对骨髓浸润的121例初诊淋巴瘤患者临床分期纠正结果
| 检查方法 | 例数 | 临床分期纠正(例) | 纠正率(%) | |||
|---|---|---|---|---|---|---|
| Ⅳ→Ⅳ | Ⅳ→Ⅳ | Ⅳ→Ⅳ | 合计 | |||
| 骨髓涂片 | 121 | 2 | 2 | 26 | 30 | 24.8 |
| 骨髓活组织检查 | 121 | 2 | 2 | 29 | 33 | 27.3 |
| 骨髓免疫病理检查 | 121 | 3 | 2 | 34 | 39 | 32.2 |
| 骨髓流式细胞术 | 121 | 3 | 2 | 32 | 37 | 30.6 |
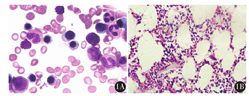
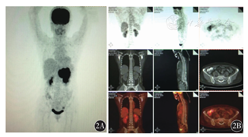
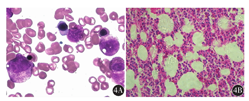
例1,以上腹部不适起病,行胃镜检查后诊断为NHL,后行骨髓检测,骨髓涂片、骨髓活组织检查均阴性(图1),骨髓流式细胞术检测及PET-CT均未明确淋巴瘤骨髓浸润(图2),但骨髓免疫病理检测结果示:骨髓增生大致正常(50%),少量异型淋巴细胞呈小簇状或散在分布(占有核细胞比例<0.02),胞体大,胞质少,核圆形或略不规则,部分细胞可见核仁。结合免疫组织化学检测CD20、PAX-5、MUM-1、c-myc均为阳性,明确诊断为弥漫大B细胞淋巴瘤(DLBCL)骨髓浸润(图3)。


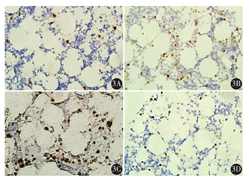

例2,以颈部淋巴结肿大起病,行淋巴结病理活组织检查后诊断为血管免疫母细胞性T细胞淋巴瘤,后行浅表淋巴结彩超、肺部CT、腹部CT,分期为Ⅲ期,进一步行骨髓涂片、骨髓活组织检查,均阴性(图4),但骨髓免疫病理检测结果示:骨髓增生较活跃(60%~70%),一类异型淋巴细胞呈散在或小簇状分布,胞体中等偏大,胞质丰富,核圆形或略不规则,部分细胞可见核仁;偏成熟阶段粒、红细胞散在分布,巨核细胞较多,分叶核为主,网状纤维染色(MF)1级。结合免疫组织化学检测CD2、CD3、CD5、CD7均为阳性,明确诊断为血管免疫母细胞性T细胞淋巴瘤骨髓浸润(图5),并纠正临床分期为Ⅳ期。

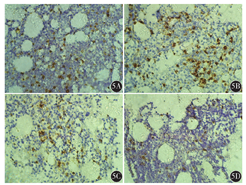

骨髓是淋巴瘤结外病变最常见的部位,骨髓浸润发生率与淋巴瘤具体病理类型有关。本组266例淋巴瘤中,骨髓浸润121例(45.5%)。HL共12例,无骨髓浸润,提示HL的骨髓浸润发生率低,预后良好。NHL共254例,骨髓浸润121例(47.6%),发生率高于HL,考虑与NHL的多中心起源、跳跃性播散相关,提示临床预后不良。国外Lambertenghi-Deliliers等[10]报道淋巴瘤骨髓受累率2%~75%,HL骨髓受累率2%~32%,NHL骨髓受累率16%~75%,本组研究结果与此报道一致。本组121例淋巴瘤骨髓浸润患者中,B-NHL 105例(50.0%),其中DLBCL 8例(6.6%),成熟B细胞型86例(71.1%),提示成熟B细胞淋巴瘤易出现骨髓浸润;其中6例淋巴浆细胞性淋巴瘤(LPL)和33例慢性淋巴细胞白血病(CLL)患者均发生骨髓浸润,提示该表型淋巴瘤主要以骨髓浸润为主,临床上应高度重视检测骨髓象;小淋巴细胞淋巴瘤(SLL)、套细胞淋巴瘤(MCL)的骨髓浸润率也较高,临床上也应注意检测患者骨髓象,以获得精准分期。T-NHL淋巴瘤中T淋巴母细胞淋巴瘤(T-LBL)骨髓浸润率为53.8%,提示应尽早检测骨髓象。有研究报道B-CLL/SLL骨髓浸润率为100%,几乎所有的LPL和毛细胞白血病(HCL)也存在骨髓浸润,MCL骨髓浸润率为55%~93%,FL为50%~60%[11]。相关研究报道SLL/CLL的骨髓浸润率为45%~75%,LPL为75%~90%,MCL为50%~80%,T-LBL为20%~60%[12,13]。本组研究结果与以上国外报道一致,个别差异考虑与样本量较少有关。
淋巴瘤的病理诊断主要依靠淋巴瘤累及的淋巴结、组织或器官的活组织检查,但部分患者以结外受累为主,特别是骨髓浸润,不能获得淋巴结活组织检查,诊断需依靠骨髓检测。淋巴瘤骨髓浸润的临床分期为Ⅳ期,预后差,直接影响治疗方案与治疗周期的选择,因此骨髓检测在淋巴瘤的诊断、分期、治疗及预后等方面具有极为重要的作用。
随着技术的进步,骨髓检测方法不再仅仅依靠单一的骨髓涂片,发展为骨髓涂片、骨髓活组织检查、骨髓流式细胞术、骨髓免疫病理等方法的综合运用。骨髓涂片、骨髓流式细胞术均为细胞学检测方法。骨髓涂片可反映淋巴瘤细胞骨髓浸润的形态特征,但部分体积小、分化程度高的淋巴瘤细胞与正常淋巴细胞较难鉴别,因而容易漏诊[14]。流式细胞术通过分析细胞群的免疫表型和分布特征实现其对正常与异常淋巴细胞的鉴别,从而明确淋巴系统肿瘤的诊断与分型,有利于NHL的诊断,尤其在B-NHL的诊断中尤为重要,而在T-NHL的诊断中,其作用仍存在争议[15,16]。本研究中流式细胞术检测骨髓浸润的阳性率高于骨髓涂片。骨髓活组织检查与骨髓免疫病理均为病理学检测方法,骨髓活组织检查取材面积大,可以直观地体现造血组织的天然结构,比较全面地反映骨髓增生程度,能够观察到骨髓组织的原位构象。但是,骨髓活组织检查无法进行细胞免疫表型检测,只能反映组织学特点[17,18]。骨髓免疫病理在骨髓活组织检查的基础上将抗原抗体反应与呈色反应结合,准确定位细胞上的特异抗原,同时观测组织细胞的形态与功能,能够更加深入地研究淋巴组织及细胞的病理学特点,是诊断与鉴别淋巴瘤骨髓浸润的重要方法,对于部分不能获得淋巴结或淋巴组织病理的病例,甚至可以进行淋巴瘤的分型诊断。
本研究121例伴骨髓浸润的淋巴瘤患者中,骨髓涂片、骨髓活组织检查、骨髓流式细胞术、骨髓免疫病理的阳性率分别为78.5%、87.6%、89.3%、96.7%,骨髓免疫病理检测的阳性率高于其他3种方法,差异均有统计学意义(均P<0.05)。16例淋巴瘤患者经骨髓涂片、骨髓活组织检查未检出骨髓浸润,行骨髓免疫病理检测示13例淋巴瘤骨髓浸润,阳性检出率为81.2%;行流式细胞术检测,8例检出淋巴瘤骨髓浸润,阳性检出率为50.0%。因此,骨髓检测敏感度由高到低依次为骨髓免疫病理、骨髓流式细胞术、骨髓活组织检查、骨髓涂片。
本组121例骨髓浸润淋巴瘤中,64例(24.1%)通过骨髓免疫病理明确淋巴瘤具体分型。此外,在恶性大B细胞并伴有大量反应性T细胞背景的病例中,免疫组织化学在诊断上具有明显优势;而且在伴有骨髓纤维化的滤泡淋巴瘤(FL)中,骨髓活组织检查诊断阳性率优于骨髓流式细胞术,成为该疾病骨髓浸润诊断及分级的金标准[19]。因而,推荐选择骨髓免疫病理及骨髓流式细胞术检测淋巴瘤骨髓浸润。
近年来,PET-CT在诊断淋巴瘤骨髓浸润中的价值受到广泛关注,Pelosi等[20]报道PET-CT与骨髓活组织检查的准确性相似,约为90%,敏感性较骨髓活组织检查略高(65%比55%),但是PET-CT对于弥漫型淋巴瘤浸润较局灶型淋巴瘤浸润的敏感性低,为此Pelosi等[21]提出PET-CT与骨髓活组织检查应相互结合。Cheng等[22]报道PET-CT具有高度的敏感性和准确性,同时联合骨髓活组织检查,可提高淋巴瘤骨髓浸润诊断阳性率。
全身磁共振成像(MRI)的出现丰富了淋巴瘤骨髓浸润的检测手段。MRI是目前唯一能够清晰显示骨髓变化的影像学检查方法,能够区分正常骨髓与异常病变的显像信号。全身MRI对淋巴瘤骨髓浸润的灵敏度极高,达96.4%。但MRI对骨髓病变的特异度较低,而且对与淋巴瘤骨髓浸润类型相似的骨髓瘤、转移瘤、白血病及其他良、恶性骨髓病变难以区分[23]。因此,淋巴瘤骨髓浸润诊断仍需依赖骨髓病理检查。
淋巴瘤骨髓浸润是疾病分期的明确证据,为疾病的预后及治疗提供了重要依据。影响DLBCL预后的独立危险因素包括骨髓浸润、Ⅳ期淋巴瘤组的中位总生存时间及中位无进展生存时间[24]。本组中骨髓检测淋巴瘤分期纠正率为20%~30%,其中骨髓免疫病理检测纠正率最高。提示骨髓免疫病理对淋巴瘤临床分期诊断的纠正效果最明显,使临床分期较早的患者纠正为Ⅳ期,提高骨髓浸润检出率对于确定临床分期、判断预后及进行个体化治疗具有重要意义。
综上,淋巴瘤骨髓浸润的检测方法较多,各有利弊,互为补充。骨髓免疫病理对淋巴瘤骨髓浸润的检出率高于其他检测方法。随着PET-CT与全身MRI的合理应用,在它们引导下行骨髓检测会使淋巴瘤骨髓浸润的检出率进一步提高,并可对无淋巴结侵犯或取材受限的患者直接进行病理诊断,使患者的诊断及分期更加精准。
无



























