
探讨初诊时18F-FDG PET-CT显像特征与多发性骨髓瘤(MM)患者实验室检查指标的相关性及其在预后评估中的价值。
回顾性分析天津医科大学肿瘤医院2008年9月至2016年8月75例初诊时行18F-FDG PET-CT检查MM患者的临床资料,包括患者的临床特征、生存期、PET-CT及实验室检查结果。对影像学改变与实验室检查结果进行相关性分析,用Kaplan-Meier法及log-rank检验进行生存分析。
75例患者中,有溶骨性病变者48例(64.0%),全身各个部位均有涉及,多见于中轴骨;有病理性骨折者26例(34.7%),均为肋骨或椎体病理性骨折。初诊时PET-CT显示溶骨性病变与患者是否贫血有关(χ2=0.455,P=0.032),而病理性骨折与患者C反应蛋白水平有关(χ2=0.976,P=0.007)。病理性骨折和溶骨性病变的发生与细胞遗传学异常、髓外病变及乳酸脱氢酶、清蛋白、β2微球蛋白(β2-MG)水平均无相关性(均P>0.05),与生存期亦无明显相关性(均P>0.05)。发现有髓外病变患者28例(37.3%),其β2-MG水平较无髓外病变者高,无进展生存(PFS)和总生存(OS)率均较无髓外病变者低(均P<0.05),是独立不良预后因素。初诊时PET-CT的最大标准摄取值与预后无关(P>0.05)。
初诊时18F-FDG PET-CT检测出的溶骨性病变和病理性骨折与实验室检查结果有一定相关性,可作为判断预后的间接指标。髓外病变是影响MM患者OS的独立不良预后因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨病变是多发性骨髓瘤(MM)最常见的症状,严重影响患者生命质量[1]。MM骨病变的检查手段主要包括X线、CT、磁共振成像(MRI)和PET-CT。溶骨性病变是MM骨病变的主要特征,70%~80%的患者在诊断时有溶骨性病变,90%的患者在疾病过程中出现溶骨性病变[2,3]。研究表明PET-CT图像的变化与实验室检查有一定关联,并可用于疗效评价[4,5]。我们回顾性分析MM患者的18F-FDG PET-CT影像学表现,旨在研究其与实验室检查结果之间的相关性及其在评估预后方面的价值。
回顾性分析我科2008年9月至2016年8月初诊时行18F-FDG PET-CT检查的75例MM患者的临床资料,其中男性49例,女性26例,中位年龄62岁(37~81岁)。首发症状最多见为腰痛,占33.3%(25/75),其次为胸背痛和腿痛,分别占22.7%(17/75)和16.0%(12/75),其余首发症状有全身多发痛(7例)、乏力(6例)、上臂痛(5例)、泡沫尿(2例)、贫血(1例)。IgG型41例(54.6%),IgA型17例(22.7%),轻链型14例(18.7%),不分泌型2例(2.7%),IgD型1例(1.3%)。贫血48例(64.0%),清蛋白减低47例(62.7%),乳酸脱氢酶(LDH)增高17例(22.7%),β2微球蛋白(β2-MG)增高57例(76.0%),血钙增高24例(32.0%),C反应蛋白(CRP)增高30例(40%),细胞遗传学异常52例(69.3%)。修订版国际分期系统(R-ISS)分期Ⅰ期11例(14.7%),Ⅱ期40例(53.3%),Ⅲ期24例(32.0%)。
全身显像采用美国GE Discovery ST PET-CT仪。患者检查前空腹4~6 h,控制血糖<8 mmol/L,安静休息15 min以后,于手臂静脉注射18F-FDG(3.70~4.81)MBq/kg,静卧45~60 min排尿后开始扫描。自颅顶至股骨上端首先行螺旋CT扫描。采集条件:电压120 kV、电流160~200 mA、螺距0.75、球管单圈旋转时间0.8 s;再行2D方式PET全身断层显像,每个床位采集3 min。横断面图像用与发射显像同层的CT横断图像进行衰减校正,PET图像重建采用迭代重建的有序子集最大期望值法进行,30个子集,2次迭代。重建图像在Xeleris工作站上与CT图像进行融合,分别得到冠状面、矢状面、横断面CT、PET及PET-CT融合图像。由3名经验丰富的影像学诊断医师阅片,并取一致意见作为最终影像学诊断。
75例患者中单纯化疗58例,化疗联合放疗3例,化疗联合自体干细胞移植14例。化疗方案:以沙利度胺为基础的化疗方案25例,包括TAD方案(沙利度胺、多柔比星、地塞米松)、TD方案(沙利度胺、地塞米松)、TCD方案(沙利度胺、环磷酰胺、地塞米松);以硼替佐米为基础的化疗方案36例,包括VD方案(硼替佐米、地塞米松)、PAD方案(硼替佐米、多柔比星、地塞米松)、VCD方案(硼替佐米、环磷酰胺、地塞米松)、VTD方案(硼替佐米、沙利度胺、地塞米松)。另外,VAD方案(长春新碱、多柔比星、地塞米松)4例,DVD方案(脂质体多柔比星、长春新碱、地塞米松)3例,MP方案(美法仑、泼尼松)3例,M2方案2例,DT-PACE方案(地塞米松、沙利度胺、顺铂、多柔比星、环磷酰胺、依托泊苷)1例,卡非佐米联合地塞米松1例。
PET-CT主要观察指标包括溶骨性病变、病理性骨折、髓外病变及最大标准摄取值(SUVmax)。溶骨性病变指直径≥5 mm的无硬化边缘或囊性内容物的典型穿凿样溶骨区域。髓外病变定义为髓外肿物经病理组织学检查证实为浆细胞肿瘤,除外孤立性髓外浆细胞瘤和骨孤立性浆细胞瘤。实验室检查主要观察指标包括血红蛋白、LDH、β2-MG、清蛋白、CRP水平以及细胞遗传学异常(IgH重排、RB-1缺失、TP53缺失、CCND1扩增、CKS1B扩增等)。
诊断依据中国MM诊治指南(2015年修订版)。分期依据最新Durie-Salmon标准、ISS标准、R-ISS标准。疗效判定参照欧洲骨髓移植协作组和国际骨髓移植登记处标准,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)。
随访截至2018年3月20日,中位随访时间37个月(5~79个月)。无进展生存(PFS)时间定义为疾病确诊(获得病理结果)至首次出现PD、复发、任何原因导致的死亡或末次随访时间。总生存(OS)时间定义为确诊至任何原因导致的死亡或末次随访时间。
采用SPSS 22.0软件进行统计学分析。计量资料非正态分布,以中位数(范围)表示;计数资料的比较采用χ2检验或Fisher确切概率法;用Kaplan-Meier法及log-rank检验进行单因素生存分析,用Cox回归模型进行多因素生存分析。以P<0.05为差异有统计学意义。
75例患者中,共65例可评估疗效,其中22例(33.8%)为CR,21例(32.4%)为PR,8例(12.3%)为SD,14例(21.5%)为PD,治疗总缓解(CR+PR)率为66.2%。75例患者的中位OS时间为32个月(1~79个月),中位PFS时间为25个月(1~75个月)。
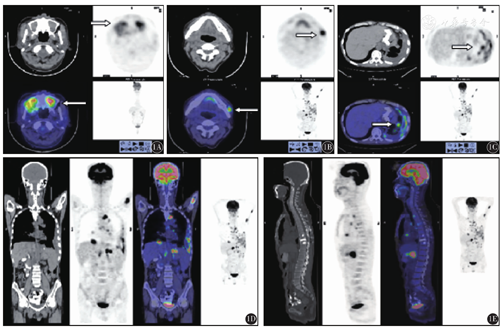
75例患者中,48例(64.0%)有溶骨性病变,全身各个部位均有涉及,多见于中轴骨;26例(34.7%)有病理性骨折,均为肋骨或椎体病理性骨折。这些病变在同机CT图像上主要表现为穿凿样、虫蚀样溶骨性改变,在PET图像上主要表现为局部代谢增高,有明显放射性浓聚;28例(37.3%)患者经病理组织学检查证实有髓外病变,影像学表现为软组织阴影或局部代谢明显增高。75例中有5例未见明显放射性浓聚,其余均有不同程度放射性浓聚,中位SUVmax为6.0(0~32.9)。
PET-CT检测出溶骨性病变的患者较无溶骨性病变患者贫血发生率更高(P=0.032);病理性骨折的患者较无病理性骨折患者CRP升高的发生率更高(P=0.007);而病理性骨折和溶骨性病变与LDH、清蛋白、β2-MG水平、髓外病变、细胞遗传学异常均无相关性(均P>0.05)(表1)。
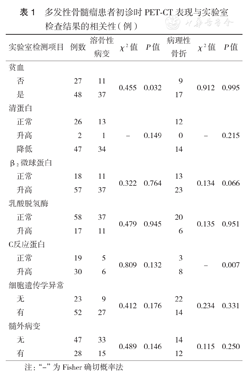
多发性骨髓瘤患者初诊时PET-CT表现与实验室检查结果的相关性(例)
多发性骨髓瘤患者初诊时PET-CT表现与实验室检查结果的相关性(例)
| 实验室检测项目 | 例数 | 溶骨性病变 | χ2值 | P值 | 病理性骨折 | χ2值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| 贫血 | ||||||||
| 否 | 27 | 11 | 0.455 | 0.032 | 9 | 0.912 | 0.995 | |
| 是 | 48 | 37 | 17 | |||||
| 清蛋白 | ||||||||
| 正常 | 26 | 13 | 12 | |||||
| 升高 | 2 | 1 | - | 0.149 | 0 | - | 0.215 | |
| 降低 | 47 | 34 | 14 | |||||
| β2微球蛋白 | ||||||||
| 正常 | 18 | 11 | 0.322 | 0.764 | 13 | 0.134 | 0.066 | |
| 升高 | 57 | 37 | 23 | |||||
| 乳酸脱氢酶 | ||||||||
| 正常 | 58 | 37 | 0.479 | 0.945 | 20 | 0.135 | 0.951 | |
| 升高 | 17 | 11 | 6 | |||||
| C反应蛋白 | ||||||||
| 正常 | 19 | 5 | 0.809 | 0.132 | 3 | - | 0.007 | |
| 升高 | 30 | 6 | 8 | |||||
| 细胞遗传学异常 | ||||||||
| 无 | 23 | 9 | 0.412 | 0.176 | 22 | 0.234 | 0.331 | |
| 有 | 52 | 27 | 14 | |||||
| 髓外病变 | ||||||||
| 无 | 47 | 33 | 0.489 | 0.146 | 14 | 0.115 | 0.250 | |
| 有 | 28 | 15 | 12 | |||||
注:"-"为Fisher确切概率法
28例有髓外病变的患者均经病理诊断为浆细胞瘤。共发现髓外病变32处,其中多发髓外病变者4例。发生于骨旁的有20处,最常见的部位为椎体旁(10处),PET-CT上表现为骨旁软组织肿块,边界多清楚,可见局部代谢活性增高,其他受累部位还包括肋骨、胸骨、耻骨、骶骨、肘关节旁等。非骨旁最常见的受累部位是胸膜和淋巴结(各3处),其余可见于纵隔、腹膜、胃、胰腺等。多发髓外病变者中1例患者上颌窦、颊面部、胰腺、胃均有涉及,1例患者胃壁、腹膜、肠系膜均有涉及,其余为多发骨旁或发生于骨旁及淋巴结(图1)。髓外病变患者中,IgG型所占比例最高(53.6%,15/28),β2-MG水平较无髓外病变者高(P<0.05),其余实验室检查结果均未发现与髓外病变有相关性。PET-CT上的髓外病变均有不同程度放射性浓聚,中位SUVmax为7.2(2.5~32.9)。生存分析显示,有髓外病变患者的3年OS率和PFS率低于无髓外病变者,差异均有统计学意义(均P<0.05)(图2、图3);多因素分析显示,髓外病变为OS独立不良预后因素(P<0.05)。

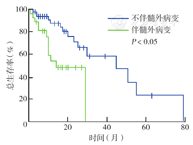

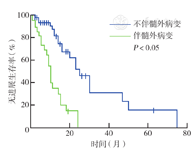

生存分析显示,初诊时PET-CT发现溶骨性病变与病理性骨折均对生存期无影响(均P>0.05)。取4.2作为PET-CT上SUVmax的临界值,结果显示SUVmax≤4.2和SUVmax>4.2患者的3年PFS率分别为45%、38%,3年OS率分别为57%、50%,差异均无统计学意义(P=0.338,P=0.507)。
MM是以浆细胞异常增生浸润骨髓并分泌过量单克隆免疫球蛋白为特点的浆细胞肿瘤。溶骨性破坏是区别症状性MM与意义未明的丙种球蛋白血症(MGUS)和冒烟型骨髓瘤(SMM)相鉴别的主要特征[6]。国际骨髓瘤工作组(IMWG)提出有"SLiM"(骨髓单克隆浆细胞比例≥60%;受累/非受累血清游离轻链比≥100;MRI检查出现1处5 mm以上局灶性骨破坏)或"CRAB"症状(高钙血症、肾损害、贫血、骨病变)的患者是需要积极治疗的,影像学发现也是Durie-Salmon分期的标准之一[7],IMWG建议对大多数MM患者行影像学检查[8]。因此,能够准确判断溶骨性病灶的存在及其范围的影像学检查,对于MM的分期和治疗是十分重要的。
MM的影像学检查方法主要有X线、CT、MRI、PET-CT等。X线由于其特异性及敏感性均较低,现已不作为推荐的检查手段。CT对脊柱、胸廓、骨盆的溶骨性病变的敏感性高于X线,能够更好地评估骨折风险和脊柱压缩性骨折的稳定性[9]。但CT辐射量较大,含碘对比剂有损肾功能,因此提出了全身低剂量CT,在保留较高的敏感性和分辨率的同时,大大减低了辐射剂量,国外一些机构甚至已将全身低剂量CT作为MM初诊时的首选检查,但在国内该检查手段尚未广泛开展。MRI对软组织和骨髓的分辨率很高,是检测弥漫性骨髓浸润和压缩性骨折的最敏感的手段[10],MRI还可以区分骨质疏松的良恶性,以此来评估骨折风险[11],但MRI检查时间长,不能用于有幽闭恐惧症、金属物和假体的患者,对于整个骨骼系统的视野较局限。18F-FDG PET-CT虽然对脊柱的敏感性不如MRI,但可以在出现溶骨性病变前就反映出新陈代谢的变化,能够直观地显示出肿瘤负荷[12]。
由于实验室检查在评估病情方面的限制,影像学检查在诊断、随访、评价疗效方面发挥着越来越重要的作用[13]。依据Durie-Salmon分期系统,骨质病变直接关系到疾病分期和危险分层[14]。血、尿免疫球蛋白水平是反映MM肿瘤负荷的间接指标,一直被用来监测MM疾病变化,然而血液学检查对于疾病进程的评价有一定滞后性,尤其在使用硼替佐米、来那度胺、沙利度胺等药物之后[15]。国内一项回顾性研究发现,CT诊断溶骨性病变阳性的患者较阴性患者的RB1基因缺失、D13s319基因缺失和高危细胞遗传学特征发生率更高,对预后判断具有一定临床意义[16]。另一项回顾性研究发现,MRI上的弥漫性病变、全身MRI多于25处溶骨性病变或中轴骨MRI多于7处溶骨性病变提示疾病早期进展可能性大和较短的PFS及OS[17]。Zamagni等[18]对282例MM患者进行中位67个月的随访后发现,局灶性病变(FL)>3处和SUVmax>4.2与更短的PFS和OS相关,PET-CT检查结果阴性为患者获得长期PFS的独立预测因素。Park等[19]的一项对59例MM患者的回顾性研究表明,FL≥3处与升高的β2-MG和LDH水平有关,贫血和细胞遗传学异常者在FL≥3处组更常见,但4年OS在FL≥3处和<3处组差异无统计学意义,并且SUVmax与实验室检查结果和生存期并无明显相关性。因此,PET-CT上的FL数量和SUVmax值是否可作为判断预后的指标还存在争议。另外,国外已有学者发现PET-CT上的代谢活性体积(MTV)、总糖酵解值(TLG)[20]和T/Mmax值(病变处的SUVmax与纵隔SUVmax的比值)[21]与实验室检查结果和生存期都有明显的相关性。
在本研究中,我们发现初诊时PET-CT检测出存在骨折的患者较无骨折患者CRP升高的发生率更高,伴溶骨性病变的患者较不伴溶骨性病变者贫血的发生率更高,而贫血和CRP水平升高作为MM不良预后因素具有较普遍的共识[22,23],因此可认为影像学中的骨折和溶骨性病变可以作为判断预后的间接指标。我们还发现有髓外病变患者OS和PFS时间短于无髓外病变者,髓外病变为预后不良因素,这与文献[24]报道相符。初诊时PET-CT上SUVmax与预后无相关性,原因可能是进行PET-CT检查的患者较少及回顾性研究的性质所造成的偏倚所致,并且从2008年至2016年MM的治疗方案发生过许多改进,且我们纳入了各个年龄段的患者,这些都对治疗效果有不同程度的影响,因此PET-CT显像特征在MM预后评估中的价值还有待更深入的研究。
所有作者均声明不存在利益冲突



























