
探讨异基因造血干细胞移植(allo-HSCT)治疗复发难治急性髓系白血病(AML)的效果及影响预后的相关因素。
回顾性分析2011年6月至2018年10月于郑州大学附属肿瘤医院行allo-HSCT治疗的35例复发难治AML患者临床资料。分析移植物抗宿主病(GVHD)发生率、移植后总生存(OS)率、无病生存(DFS)率、移植相关死亡率及复发率,并分析影响预后的危险因素。
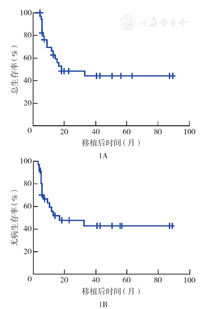
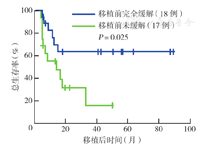
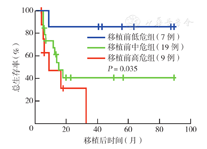
移植后所有患者均获得造血重建。100 d Ⅱ~Ⅳ度急性GVHD发生率为(22.9±7.7)%,3年慢性GVHD发生率为(49.5±10.6)%。移植后中位随访时间为14.1个月(4.2~89.4个月),18例生存(其中16例DFS),17例死亡;14例患者复发,中位复发时间为4.7个月(2.9~32.4个月)。移植后3年OS率、DFS率分别为(44.4±9.3)%、(43.0±9.5)%。单因素分析显示,移植前疾病未缓解、移植前不良遗传学危险度分组、移植后复发为影响OS的危险因素(均P<0.05)。移植前完全缓解组和移植前未缓解组的3年OS率分别为(63.2±12.0)%、(15.7±12.8)%(P=0.025),3年DFS率分别为(62.2±12.3)%、(15.3±12.7)%(P=0.028),3年复发率分别为(28.2±10.7)%、(80.6±15.7)%(P=0.057)。移植前遗传学高危组患者移植后3年复发率较中危组及低危组高,三组分别为100.0%、(45.0±12.1)%、(14.3±13.2)%(P=0.045)。移植后3年移植相关死亡率为(18.7±7.7)%。
allo-HSCT是挽救性治疗复发难治AML的有效手段,复发是影响生存的主要因素,移植前降低肿瘤负荷对减少复发和提高疗效至关重要。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
复发难治急性髓系白血病(AML)患者预后差,对于原发耐药或复发的AML患者,挽救性化疗获得第二次缓解的可能性低,患者4年总生存(OS)率约23%[1,2]。目前异基因造血干细胞移植(allo-HSCT)是唯一可能治愈AML原发性诱导失败或复发及第二次缓解失败的方式[2,3,4,5]。多项研究证实,复发难治AML患者在完全缓解(CR)期接受allo-HSCT疗效优于在未缓解状态下移植者[6,7]。然而,复发难治AML患者往往存在白血病细胞耐药,再诱导化疗CR率低。有研究发现,在未缓解状态下移植也可使部分患者获益[4,8]。为探讨allo-HSCT治疗复发难治AML的效果及影响移植疗效的因素,我们对35例接受allo-HSCT患者的临床资料进行回顾性分析。
收集2011年6月至2018年10月在我院接受allo-HSCT治疗的复发难治AML患者35例,均符合复发难治AML的诊断标准[9]。复发AML诊断标准:CR后外周血再次出现白血病细胞或骨髓中原始细胞比例>0.05(除外巩固化疗后骨髓再生等其他原因)或髓外出现白血病细胞浸润。难治AML诊断标准:经过标准方案治疗2个疗程无效的初治病例;CR后经过巩固强化治疗12个月内复发者;12个月后复发但经过常规化疗无效者;2次或多次复发者;髓外白血病持续存在者。35例患者中男性23例(65.7%),女性12例(34.3%),接受移植时中位年龄33岁(6~53岁);移植前疾病状态:第1次完全缓解(CR1)9例(25.7%),CR2 7例(20.0%),CR3 2例(5.7%),发病后持续未缓解(NR1)6例(17.1%),复发后接受化疗未缓解(NR2)10例(28.6%),复发后未接受化疗(NR3)1例(2.9%)。根据2017年版成年人AML(非急性早幼粒细胞白血病)中国诊疗指南中的预后危险度分组标准[10]:低危组7例(20.0%),中危组19例(54.3%),高危组9例(25.7%)。高危组中5例患者伴有FLT3-ITD阳性。
35例供者中,男性23例(65.7%),女性12例(34.3%),中位年龄33岁(11~55岁)。其中同胞全相合供者17例(48.6%),亲缘单倍体供者7例(20.0%),非血缘供者11例(31.4%);30例(85.7%)接受外周血造血干细胞(PBSC)移植,5例(14.3%)接受PBSC与骨髓混合移植;供受者ABO血型相合21例(60.0%),不合14例(40.0%)。
所有患者均采用强化清髓性预处理方案:采用白消安(Bu)+环磷酰胺(Cy)+去甲氧柔红霉素(IDA)方案5例,采用BCFAI[Bu+Cy+氟达拉滨(Flu)+阿糖胞苷(Ara-C)+IDA]方案13例,采用BCFA/BMFA(Bu+Flu+Ara-C+Cy/Bu+Flu+Ara-C+美法仑)方案17例。
GVHD的分级采用美国西雅图标准[11,12],所有患者均采用环孢素联合短程甲氨蝶呤及吗替麦考酚酯预防GVHD的发生。非血缘供者及亲缘单倍体供者加用抗胸腺细胞球蛋白预防GVHD。
患者连续3 d外周血中性粒细胞绝对值>0.5×109/L的首日为白细胞植活时间。在未输注血小板的情况下,患者持续1周外周血血小板计数>20×109/L的首日为血小板植活时间。
植活后根据病情每2~4周进行骨髓检查,采用骨髓涂片、流式细胞术及实时荧光定量聚合酶链反应(PCR)进行MRD的监测。
采用门诊和电话随访。随访截止日期为2018年11月1日。主要观察终点及定义:OS时间为从移植日开始至死亡或末次随访的时间;无病生存(DFS)时间为从移植日开始至复发或末次随访的时间;移植相关死亡时间为从移植日开始至非复发死亡的时间;复发时间为从移植日开始至骨髓或外周血白血病细胞≥0.05或髓外复发的时间。次要观察终点:造血重建、GVHD、移植相关并发症等。
采用SPSS 24.0统计学软件进行数据分析。采用Kaplan-Meier法绘制生存曲线,采用log-rank检验进行组间生存情况的单因素分析。以P<0.05为差异有统计学意义。
所有患者均获得造血重建,中位粒细胞植活时间为12 d(9~21 d),中位血小板植活时间为13 d(10~31 d)。
18例(51.4%)患者发生急性GVHD(aGVHD),其中Ⅰ度11例(31.4%),Ⅱ~Ⅳ度7例(20.0%);100 d aGVHD的发生率为(51.4±8.4)%,其中100 d Ⅱ~Ⅳ度aGVHD的发生率为(22.9±7.7)%。13例(37.1%)患者发生慢性GVHD(cGVHD),其中广泛性6例(17.1%),局限性7例(20.0%);3年cGVHD的发生率为(49.5±10.6)%,其中3年广泛性cGVHD的发生率为(29.5±11.3)%。
至随访终点,中位随访时间为14.1个月(4.2~89.4个月),共18例(51.4%)患者生存,其中16例(45.7%)为DFS;17例(48.6%)死亡。移植后3年OS率、DFS率分别为(44.4±9.3)%、(43.0±9.5)%(图1)。移植前CR组和未缓解组的3年OS率分别为(63.2±12.0)%、(15.7±12.8)%(P=0.025)(图2);3年DFS率分别为(62.2±12.3)%、(15.3±12.7)%(P=0.028)。移植前遗传学高、中、低危组的3年OS率分别为0、(40.5±12.3)%、(85.7±13.2)%(P=0.035)(图3);3年DFS率分别为0、(41.5±12.4)%、(83.3±15.2)%(P=0.067)。患者的年龄、性别、初诊白细胞计数、移植前有无髓外浸润、移植方式、供者年龄、供者来源、回输CD34+细胞数、移植后是否发生aGVHD、移植后是否发生cGVHD对移植后OS和DFS均无影响(均P>0.05)。移植后复发和非复发组3年OS率分别为(10.7±9.4)%、(72.0±10.7)%(P=0.002),提示移植后复发是影响患者OS的危险因素。



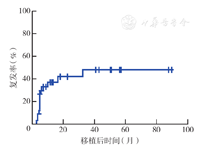
至随访终点,14例(40.0%)患者复发,中位复发时间为4.7个月(2.9~32.4个月),其中12例患者在移植后1年内复发;2例患者为髓外复发合并血液学复发,12例为单纯血液学复发。14例复发患者中,12例死亡,复发至死亡的中位时间为1.8个月(0.1~14.3个月),移植后3年复发率为(47.6±10.0)%(图4)。移植前未缓解组患者的移植后3年复发率高于移植前CR组[(80.6±15.7)%比(28.2±10.7)%],但差异无统计学意义(P=0.057);移植前遗传学高危组患者的移植后3年复发率高于中危组和低危组[分别为100.0%、(45.0±12.1)%、(14.3±13.2)%],差异有统计学意义(P=0.045)。

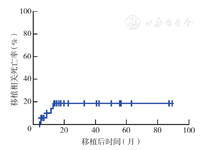
5例(14.3%)患者因复发以外的原因死亡。其中,3例死于肺部感染,1例死于闭塞性细支气管炎,1例死于血栓性微血管病(TMA)。移植后3年移植相关死亡率为(18.7±7.7)%(图5)。

近年来,尽管对新诊断的AML患者进行了强化诱导和巩固治疗以及靶向治疗等新型药物的引入,AML的缓解率得到了一定程度的提高,但仍有大约一半的年轻患者及80%~90%的老年患者复发[13,14,15],并且近半数获得CR的患者最终因复发而死亡[16]。多项研究表明,allo-HSCT是治愈复发难治AML的唯一挽救性治疗手段[17,18,19],可提高患者的长期生存率、降低复发率[20]。来自国际血液和骨髓移植研究中心(CIBMTR)的大样本(病例数超过2 000例)数据显示,移植后3年OS率为19%,其中预后较好组3年OS率达42%[6]。我国苏秀华等[19]研究显示,99例复发难治AML患者allo-HSCT后3年OS率达45%,本研究结果与之类似。
移植前疾病状态可以影响移植的疗效。Nemecek等[21]对58例复发难治AML患者分析发现,移植时处于缓解状态的患者5年无白血病生存(LFS)率为58%,复发率为42%;而移植前未缓解患者5年LFS率为22.5%,复发率为55%。Tian等[7]报道101例接受allo-HSCT的难治复发AML患者,移植前获得CR患者和未缓解患者的5年OS率分别为46%、18%。本研究移植前CR组和未缓解组OS结果与上述文献报道一致,结合本研究DFS及复发结果,提示移植前获得CR可以降低复发率、改善生存。由于复发难治AML患者往往存在白血病细胞耐药问题,再诱导化疗CR率低,有研究发现在未缓解状态下移植也可使部分复发难治AML患者获益[4,8,17]。Zhang等[22]分析了58例行allo-HSCT的复发难治AML患者,移植前CR组(35例)、移植前未缓解组(25例)5年DFS率分别为53.4%、51.6%(P=0.740),提示移植前缓解状态与allo-HSCT的预后无相关性。目前,对于复发难治AML患者,是再次诱导治疗达CR后再行移植还是直接进行挽救性移植,仍存在较大争议[23]。有学者认为,对于复发较晚、无不良细胞遗传学和分子学特征以及原始细胞比例较低的患者,再诱导治疗预期CR率超过50%,可在移植前尝试再诱导化疗[24]。对于早期复发、有不良细胞遗传学改变或FLT3突变的高危患者,再诱导化疗的CR率不足20%,以allo-HSCT作为挽救治疗更为合理[25,26],因为一味强求CR而反复化疗导致的脏器损伤和感染会增加移植风险。因此,对于原发诱导失败和复发的患者,在CR期进行移植疗效较好,对于再诱导化疗预期CR率低的患者,应直接行挽救性allo-HSCT。
对于复发难治AML患者,移植前遗传学危险度分组对预后有影响。Schneidawind等[27]对62例复发难治AML患者的移植疗效进行分析,发现中危-1组患者移植后2年OS率高于中危-2组(70%比34%,P=0.03)及高危组(70%比38%,P=0.06)。Todisco等[4]研究也发现,预后良好/中危-1组患者移植后3年OS率较中危-2/高危组患者高(20%比11%,P=0.014 2)。我国张利宁等[28]研究显示,预后良好/中等组患者移植后2年OS率高于预后不良组患者(40.4%比0,P=0.015)。在本研究中,低危和中危组患者移植后3年OS率均高于高危组患者,且高危组患者移植后3年复发率也较高。因此,复发难治AML患者的遗传学危险度分组也是影响移植患者预后的因素。
在进行危险因素分析时,我们比较了移植方式对移植疗效的影响,结果发现,非血缘供者组、同胞全相合供者组、亲缘单倍体组患者移植后OS、DFS无差异。Ruggeri等[29]研究显示,对于接受allo-HSCT治疗的复发难治AML患者,同胞全相合和非血缘受体移植的2年OS率分别为25%和33%,2年LFS率分别为21%和26%,差异无统计学意义。Liu等[8]回顾性分析了133例未缓解状态下接受移植的复发难治AML患者,无关供者、亲缘供者和单倍体相合移植组的3年OS率、DFS率差异均无统计学意义。对于高危的恶性血液病患者,单倍体移植较同胞相合移植具有更好的抗白血病效应[30],且复发率较非血缘移植低[31]。苏秀华等[19]研究了99例行allo-HSCT的复发难治AML患者,亲缘供者组移植后3年OS率达45.1%。董征等[32]报道了30例接受单倍体移植的复发难治白血病患者,移植后3年复发率为16.7%,OS率为50%。因此,对于复发难治AML患者,非血缘移植、同胞全相合移植及单倍体移植均是可选择的治疗手段。由于复发难治AML患者病情变化快,缓解后易复发,移植等待期较短,单倍体造血干细胞移植相比同胞全相合、非血缘移植更易获得、等待期更短,为此类患者带来了希望。
随着移植技术的进步,allo-HSCT为复发难治AML患者带来了长期生存的可能,移植相关死亡率显著下降,然而原发病的复发率并未降低。复发是复发难治AML患者移植失败的重要原因,与患者的高白血病负荷有关[33]。Schneidawind等[27]的研究表明,复发难治AML患者allo-HSCT后影响生存的最主要因素是复发。本组患者3年的复发率为(47.6±10.0)%,复发死亡占总体死亡的70.6%(12/17)。白血病患者移植后复发的防治重在监测和预防,监测白血病缓解状态下MRD的动态变化可预测白血病复发,因此移植后定期监测尤为重要[34]。移植前疾病状态≥CR2及高危的细胞遗传学异常是移植后复发的高危因素[35]。对高危复发患者应加强预处理,以最大限度杀灭肿瘤细胞,降低移植前肿瘤负荷,本研究所有患者均采用了强化清髓性预处理方案。Liu等[8]研究发现提高预处理强度可以提高未缓解状态下复发难治AML患者的移植疗效。目前,临床上治疗移植后复发的策略有限,有研究报道移植后给予预防性淋巴细胞输注(DLI)诱导移植物抗白血病效应,可以降低复发率,提高移植疗效。Jaiswal等[36]报道了41例接受allo-HSCT治疗的复发难治AML患者,接受预防性DLI治疗的患者移植后18个月无进展生存率(61.9%比25%,P=0.02)、OS率(70.5%比35%,P=0.03)较未接受组高,而疾病进展率明显降低(21.4%比66%,P=0.01)。因此,对于高危复发难治AML患者,移植前应加强预处理方案,移植后可给予预防性DLI或谨慎提前减停免疫抑制剂,严密监测患者MRD和GVHD发生情况,予以针对性化疗、二次移植、DLI或者联合应用。
综上,allo-HSCT是目前唯一可能治愈复发难治AML的方法。原发诱导失败和复发的患者在CR期进行移植疗效较好,但对于早期复发、遗传学危险度分组高危患者,再诱导化疗预期CR率低,应直接行挽救性allo-HSCT,同时采用强化清髓性预处理方案,移植后给予预防性DLI诱导移植物抗白血病效应,可降低移植后复发率,提高生存率。由于本研究病例较少,相关结论还有待更多大样本前瞻性研究予以证实。
所有作者均声明不存在利益冲突



























