
探讨雷公藤甲素(TPL)联合BET蛋白抑制剂JQ1对MLL基因重排阳性急性髓系白血病(AML)细胞株MV4-11的增殖抑制及凋亡诱导作用,并探讨其协同作用机制。
取对数生长期MV4-11细胞,分别接受不同浓度(100、200、300、400 nmol/L)JQ1单药、4 nmol/L TPL单药或4 nmol/L TPL联合上述不同浓度JQ1处理48 h后,采用CCK-8法检测细胞增殖情况,流式细胞术(FCM)检测细胞凋亡情况,JC-1法检测线粒体膜电位变化,蛋白质印迹法检测线粒体凋亡通路相关蛋白表达变化。
JQ1单药作用MV4-11细胞48 h半数抑制浓度(IC50)值为(283.9±10.7)nmol/L,而4 nmol/L TPL能增强JQ1对MV4-11细胞的增殖抑制作用,联合用药IC50值降低至(148.1±2.6)nmol/L,差异有统计学意义(t=25.31,P=0.029)。FCM检测细胞凋亡结果显示,4 nmol/L TPL联合不同浓度(100、200、300、400 nmol/L)JQ1作用MV4-11细胞48 h后,细胞凋亡率分别为(16.4±1.9)%、(27.5±2.1)%、(32.9±3.6)%、(35.5±3.0)%,与JQ1单药组[(9.6±2.3)%、(12.6±1.4)%、(19.5±3.3)%、(22.7±2.1)%]相比,差异有统计学意义(F=9.25,P<0.01)。4 nmol/L TPL联合JQ1作用MV4-11细胞12 h后,细胞膜电位水平低于JQ1单药组,差异有统计学意义(P<0.05)。4 nmol/L TPL联合JQ1作用MV4-11细胞24 h后,抗凋亡蛋白bcl-2、Mcl-1水平下降,而促凋亡蛋白bax水平上升。
TPL可增强BET蛋白抑制剂JQ1对MLL基因重排阳性AML细胞的增殖抑制及凋亡诱导作用,其机制可能与增强线粒体凋亡途径相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
混合谱系白血病(MLL)基因定位于11号染色体2区3带(11q23/MLL),常因与不同的染色体易位形成MLL基因和伙伴基因的嵌合体,从而引起下游调控基因的异常表达。研究表明MLL基因重排阳性急性髓系白血病(AML)对常规化疗耐药,且易发生中枢神经系统浸润,临床预后差[1],探索新的治疗策略迫在眉睫。MLL基因重排阳性AML常伴表观遗传学突变[2],而BET家族蛋白通过蛋白中的溴结构域(BRD)与染色质结合,从而在表观遗传学水平上对基因表达进行调控。BET蛋白抑制剂JQ1具有抗AML的效果,但单药疗效有限[3]。传统中药雷公藤甲素(TPL)具有较广谱的抗肿瘤作用,但其有效浓度与毒性比较接近,限制了其使用[4]。本研究选取MLL基因重排阳性的AML细胞株MV4-11为研究对象,探索低浓度TPL联合JQ1对MLL基因重排阳性AML细胞的杀伤作用,为两药联合治疗MLL基因重排阳性AML提供实验依据。
TPL和JQ1均购自美国Sigma-Aldrich公司。CCK-8试剂、JC-1试剂盒购自上海碧云天生物技术有限公司。Annexin V-FITC/碘化丙啶(PI)细胞凋亡检测试剂盒购自美国eBioscience公司。BCA蛋白浓度测定试剂盒购自美国Pierce公司。兔单克隆抗bcl-2抗体、兔单克隆抗Mcl-1抗体、兔多克隆抗Caspase-3抗体、兔多克隆抗Caspase-9抗体、辣根过氧化物酶(HPR)偶联抗兔二抗购自美国CST公司。兔单克隆抗bax抗体购自英国Abcam公司。
MV4-11细胞株为厦门大学附属第一医院血液病研究所传代保存。MV4-11细胞培养于含10%胎牛血清的RPMI 1640培养液中,置于37 ℃、5% CO2培养箱中培养,取对数生长期细胞离心,锥虫蓝染色后计数,拒染细胞超过95%用于后续实验。预试验结果提示浓度低于4 nmol/L TPL作用MV4-11细胞株48 h,细胞活力降低不足20%,因此我们后续实验选择4 nmol/L TPL联合不同浓度JQ1处理MV4-11细胞。
取对数生长期细胞悬液,以5×104/孔接种于96孔板中,每孔100 μl。设空白对照组、不同浓度(100、200、300、400 nmol/L)JQ1单药组、4 nmol/L TPL单药组及4 nmol/L TPL分别联合上述不同浓度JQ1的联合组。空白对照组加入含10%胎牛血清的RPMI 1640培养液100 μl。每个浓度设3个复孔,37 ℃、5% CO2培养箱中培养48 h后,加入10 μl/孔的CCK-8工作液,在培养箱中继续培养2~4 h后,酶标仪测定波长450 nm处的吸光度(A)值。计算细胞增殖抑制率。半数抑制浓度(IC50)为50%细胞生长受抑制时的药物浓度。
细胞增殖抑制率(%)=(1-药物组A值/对照组A值)×100%
取对数生长期细胞悬液,以2×105/孔接种于24孔板。设空白对照组(加入相应体积的培养液)、不同浓度(100、200、300、400 nmol/L)JQ1单药组、4 nmol/L TPL单药组及4 nmol/L TPL分别联合上述不同浓度JQ1的联合组。37 ℃、5% CO2培养箱培养48 h后收集细胞。参照Annexin V-FITC/PI试剂盒说明书处理细胞后,FCM检测细胞凋亡。为进一步验证细胞凋亡是否通过Caspase激活来介导,在给药前予Caspase抑制剂Z-VAD-FMK(20 μmol/L)处理细胞,检测细胞凋亡情况。
取对数期生长的细胞悬液,300×g离心5 min,弃上清,细胞计数,调整细胞密度为5×105/ml,并接种于24孔板中,每孔1 ml细胞悬液。设置空白对照组(加入相应体积的培养液)、300 nmol/L JQ1单药组、4 nmol/L TPL单药组以及上述浓度两药联合组。37 ℃、5% CO2培养箱培养12 h后收集细胞。参照JC-1线粒体膜电位检测试剂盒说明书进行操作,采用FCM检测细胞线粒体膜电位的变化。以JC-1多聚体与单体之间平均荧光强度(MFI)比值表示线粒体膜电位的变化情况。
收集空白对照组(加入相应体积的培养液)、300 nmol/L JQ1单药组、4 nmol/L TPL单药组以及上述浓度两药联合组处理24 h后的细胞,300×g离心5 min,弃上清。向各处理组细胞中加入100 μl含1%苯甲基磺酰氟的RIPA裂解液,将裂解液与细胞充分混匀,冰上裂解15 min,4 ℃、12 000×g离心15 min,取上清至新的1.5 ml EP管中,按照BCA试剂盒操作步骤测定线粒体凋亡通路相关蛋白bax、Mcl-1、bcl-2、Caspase-3及Caspase-9表达。取等量变性后的蛋白用12%十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳,完毕后转至聚偏二氟乙烯膜。然后用含5%脱脂奶粉的TBST溶液室温封闭2 h,分别放入相应的按1∶1 000稀释好的抗体稀释液中,4 ℃摇床过夜。用TBST洗膜3次后把目的条带放入HRP标记的羊抗兔二抗(1∶10 000),室温下培养1 h后,用TBST洗膜3次。膜与化学发光底物反应5 min,暗室中电化学发光显色,压片曝光。
采用SPSS 20.0统计学软件处理数据,计量资料满足正态分布,以均数±标准差( ±s)表示,多组间比较采用单因素方差分析,两组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
±s)表示,多组间比较采用单因素方差分析,两组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
4 nmol/L TPL单药作用MV4-11细胞48 h后,细胞增殖抑制率为(5.8±0.8)%,与空白对照组的(3.4±1.3)%比较,差异无统计学意义(P>0.05)。4 nmol/L TPL联合不同浓度(100、200、300、400 nmol/L)JQ1作用MV4-11细胞48 h后,细胞增殖抑制率分别为(34.1±4.3)%、(61.2±3.4)%、(77.4±2.4)%、(84.3±2.2)%,均高于不同浓度JQ1单药组的(22.4±3.5)%、(36.7±2.5)%、(59.3±3.4)%、(62.8±2.5)%,差异有统计学意义(F=22.49,P<0.01)。IC50值从JQ1单药的(283.9±10.7)nmol/L下降到联合用药后的(148.1±2.6)nmol/L,差异有统计学意义(t=25.31,P=0.029),增敏倍数为1.9。
4 nmol/L TPL单药作用MV4-11细胞48 h后,细胞凋亡率为(6.4±1.3)%,与空白对照组的(3.9±0.9)%比较,差异无统计学意义(P>0.05)。4 nmol/L TPL联合不同浓度(100、200、300、400 nmol/L)JQ1作用MV4-11细胞48 h后,细胞凋亡率分别为(16.4±1.9)%、(27.5±2.1)%、(32.9±3.6)%、(35.5±3.0)%,均高于不同浓度JQ1单药组的(9.6±2.3)%、(12.6±1.4)%、(19.5±3.3)%、(22.7±2.1)%,且呈剂量依赖性,差异有统计学意义(F=9.25,P<0.01)。Caspase抑制剂Z-VAD-FMK能抑制TPL联合不同浓度(100、200、300、400 nmol/L)JQ1对MV4-11细胞株的诱导凋亡作用,细胞凋亡率分别降至(9.3±2.6)%、(12.7±3.4)%、(15.6±4.2)%、(18.4±3.8)%,与联合组比较,差异有统计学意义(F=58.04,P<0.01)。
4 nmol/L TPL单药组JC-1多聚体/单体MFI比值为1.01±0.09,与空白对照组(1.21±0.36)相比,差异无统计学意义(t=0.751,P>0.05);4 nmol/L TPL联合300 nmol/L JQ1组JC-1多聚体/单体MFI比值为0.34±0.12,与300 nmol/L JQ1单药组(0.78±0.28)比较,差异有统计学意义(t=26.87,P<0.05)。提示联合处理12 h后的MV4-11细胞线粒体膜电位下降。
蛋白质印迹法检测结果显示,4 nmol/L TPL联合JQ1可使促凋亡蛋白bax表达水平上调,而抗凋亡蛋白Mcl-1、bcl-2表达水平下调;4 nmol/L TPL联合JQ1可使凋亡相关蛋白Caspase-3和Caspase-9裂解增加(表1)。表明TPL联合JQ1是通过线粒体依赖途径诱导MLL基因重排阳性AML细胞凋亡的。
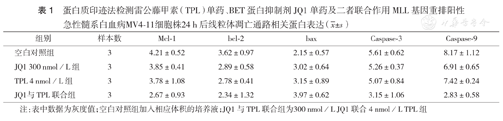
蛋白质印迹法检测雷公藤甲素(TPL)单药、BET蛋白抑制剂JQ1单药及二者联合作用MLL基因重排阳性急性髓系白血病MV4-11细胞株24 h后线粒体凋亡通路相关蛋白表达( ±s)
±s)
蛋白质印迹法检测雷公藤甲素(TPL)单药、BET蛋白抑制剂JQ1单药及二者联合作用MLL基因重排阳性急性髓系白血病MV4-11细胞株24 h后线粒体凋亡通路相关蛋白表达( ±s)
±s)
| 组别 | 样本数 | Mcl-1 | bcl-2 | bax | Caspase-3 | Caspase-9 |
|---|---|---|---|---|---|---|
| 空白对照组 | 3 | 4.21±0.52 | 3.62±0.97 | 2.15±0.57 | 5.61±0.62 | 8.17±1.12 |
| JQ1 300 nmol/L组 | 3 | 3.85±0.41 | 2.89±0.58 | 3.02±0.64 | 5.26±0.37 | 6.91±0.65 |
| TPL 4 nmol/L组 | 3 | 3.78±1.08 | 2.78±0.41 | 3.15±0.89 | 5.07±0.84 | 7.42±0.24 |
| JQ1与TPL联合组 | 3 | 2.67±0.93 | 2.34±1.32 | 3.97±0.62 | 3.15±1.06 | 2.83±0.58 |
注:表中数据为灰度值;空白对照组加入相应体积的培养液;JQ1与TPL联合组为300 nmol/L JQ1联合4 nmol/L TPL组
表观遗传学异常在AML发生和发展中发挥重要作用[5]。MLL基因编码的MLL蛋白具有组蛋白3的第4位赖氨酸(H3K4)甲基转移酶活性,介导染色质转录激活相关的表观遗传学修饰。MLL融合基因通过异常的表观遗传学改变引起造血干细胞增殖失控与分化受阻,导致AML的发生、发展[6]。针对表观遗传学异常的治疗方案可作为一种新的AML治疗手段。
BRD是一类能够特异性识别组蛋白中乙酰化赖氨酸(KAc)的保守蛋白结构域,通过与乙酰化赖氨酸结合,促使染色质重塑因子和转录因子等相关蛋白富集于特定的基因转录位点,进而调节基因的转录表达。BRD4作为其家族成员之一,在许多肿瘤的发生、发展中扮演重要的角色,包括MLL基因重排阳性白血病[7,8]。JQ1作为靶向BRD4的小分子抑制剂,在体内外研究中显示出良好的抗白血病作用[9]。但是,有研究证实AML细胞通过多种机制获得对BRD4抑制剂耐药,降低其疗效[7,10]。因此,通过联合其他药物提高JQ1在MLL基因重排阳性AML中的疗效成为重要策略[3,11]。
研究表明,低浓度TPL具有增强传统化疗药物以及靶向药物细胞毒的作用,甚至具有逆转耐药的功效[12]。本研究结果显示,低浓度TPL具有增强JQ1对MV4-11细胞的增殖抑制、诱导凋亡作用,呈现浓度依赖性。低浓度TPL联合JQ1作用MV4-11细胞24 h后导致细胞线粒体膜电位下降,提示联合作用可能是通过触发线粒体凋亡通路实现的。bcl-2蛋白家族在线粒体凋亡过程中发挥重要的调控作用,其促凋亡蛋白成员与抗凋亡蛋白成员相互作用,共同决定细胞是否进入凋亡程序。本研究蛋白质印迹法结果进一步证实联合组抗凋亡蛋白bcl-2和Mcl-1表达下调,促凋亡蛋白bax表达上调,进而激活Caspase-9、Caspase-3,从而诱导细胞凋亡发生。
总之,本研究结果表明,低浓度TPL联合BET蛋白抑制剂JQ1对MLL基因重排阳性AML细胞具有协同杀伤作用,可能的机制是通过调控bcl-2蛋白家族成员的表达,进而触发线粒体凋亡通路。下一步将在原代细胞、动物模型中验证上述协同杀伤作用及分子机制,为两药联合用于治疗MLL基因重排阳性AML提供实验依据。
所有作者均声明不存在利益冲突



























