
探讨复发低危儿童急性B淋巴细胞白血病(B-ALL)的临床和生物学特征。
回顾性分析2017年7月至2018年7月就诊于北京博仁医院的34例复发低危B-ALL患儿的临床及实验室检查资料,分析127~339种血液肿瘤相关基因突变情况。
34例复发低危B-ALL患儿从诊断到复发的中位时间为871 d(87~1 446 d)。早期复发26例(76%),晚期复发8例(24%)。维持治疗前复发3例(9%),维持治疗期复发12例(35%),停药后复发19例(56%)(停药后1年内复发13例,停药后1~2年间复发6例,无停药2年后复发者)。单纯骨髓复发26例(76%),髓内并髓外复发6例(18%),单纯髓外复发2例(6%)。流式细胞术检测微小残留病(MRD)转阳9例(转阳1次6例,转阳2次2例,转阳3次1例),MRD水平为0.02%~3.82%,其中早期复发8例,晚期复发1例。6例最初发病时为正常核型或超二倍体核型的患儿复发时染色体出现复杂核型。28例行血液肿瘤相关基因突变检测,结果显示每例患儿至少发生1种基因突变,25例(89%)检测出≥2种基因突变,出现频率较高的突变基因依次为CREBBP(7例,25%)、NRAS(7例,25%)、KRAS(7例,25%)、TP53(4例,14%)、NT5C2(4例,14%)。
低危B-ALL患儿复发多发生在维持治疗期间或停药后2年内;完全缓解后出现MRD阳性多有早期复发风险。肿瘤细胞发生预后不良的基因突变可能与低危B-ALL患儿复发相关,最常见突变基因为CREBBP、RAS信号通路基因及TP53、NT5C2。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性淋巴细胞白血病(ALL)是儿童最常见的恶性肿瘤之一。20世纪60年代ALL患儿的长期生存率低于10%,经过数十年的发展,患儿总体生存率已达80%以上,但仍有约20%复发[1],其中部分为低危组患儿。我国的一项长期随访研究显示低危组患儿5年无事件生存率约80%[2],早期明确低危组患儿复发相关的危险因素并给予相应处理,可进一步改善预后。本研究回顾性分析了我院34例复发的低危急性B淋巴细胞白血病(B-ALL)患儿的临床和生物学特征,现报道如下。
选取2017年7月至2018年7月就诊于我院的复发B-ALL患儿。符合以下标准者纳入研究:初诊年龄1~10岁;均于其他三甲医院或知名血液病专科医院明确诊断为B-ALL低危组;复发前治疗采用疗效类似的儿童ALL规范化疗方案,即CCLG-ALL2008方案,或儿童ALL诊疗建议(第四次修订)方案,或CCCG-ALL2015方案[3,4,5];治疗过程中或治疗结束后血液学复发。共有34例患儿符合标准,纳入本研究。
按照美国国立综合癌症网络(NCCN)儿童ALL临床实践指南(2020年第2版)[6],患儿入院后收集既往疾病诊治史及实验室检查结果,常规行骨髓形态学、流式细胞术、细胞遗传学、分子生物学检测。采用高通量DNA检测技术检测患儿127~339种与血液肿瘤疾病诊断、预后、复发、治疗相关的基因变异,包括基因编码区的单核苷酸位点变异(SNV)和小片段插入/缺失等类型变异,平均测序深度>3 000×,检测结果由分子生物学专业医师解读。应用流式细胞术检测微小残留病(MRD)情况。
采用SPSS 25.0软件进行数据处理和统计学分析,计数资料组间比较采用Fisher确切概率法,以P<0.05为差异有统计学意义。
34例患儿中,男性22例,女性12例;中位年龄3.5岁(1~10岁);初诊中位白细胞计数7.0×109/L (1.6×109/L~35×109/L);融合基因TEL-AML1阳性6例(18%),未发现其他融合基因阳性病例;6例最初发病时为正常核型或超二倍体核型的患儿复发时染色体出现复杂核型。从诊断到复发的中位时间为871 d(87~1 446 d)。早期复发26例(76%),晚期复发8例(24%)。维持治疗前(包括巩固治疗期及延迟强化期)复发3例(9%),维持治疗期复发12例(35%),停药后复发19例(56%)[停药后1年内复发13例(38%),停药后1~2年间复发6例(18%)]。单纯骨髓复发26例(76%),髓内并髓外复发6例(18%)[中枢神经系统白血病(CNSL)3例,睾丸白血病2例,局部软组织肿块1例],单纯髓外复发2例(6%)(CNSL 1例,睾丸白血病1例)。
34例患儿巩固治疗后至复发前曾出现骨髓形态学缓解,而流式细胞术检测骨髓MRD转阳9例(转阳1次6例,转阳2次2例,转阳3次1例),MRD水平0.02%~3.82%,其中早期复发8例,晚期复发1例。维持治疗前、维持治疗期、停药后各转阳3例。9例MRD转阳患儿中,2例调整为高危组治疗方案,后早期复发。9例MRD转阳患儿中,1例用初发病骨髓DNA检测出IKZF1基因突变阳性,1例用初发病骨髓行荧光原位杂交(FISH)检测提示存在第21号染色体内部扩增(iAMP21)。6例TEL-AML1融合基因阳性患儿中,1例于复发前监测到TEL-AML1融合基因量升高;2例为髓外复发患儿,复发前监测TEL-AML1为阴性;3例复发前未监测TEL-AML1融合基因量。
大部分患儿初发病时未检测或仅检测数个常见基因突变,基因突变资料不详。入我院后28例(包括5例TEL-AML1融合基因阳性患儿及10例超二倍体患儿)完成血液肿瘤相关基因突变检测,其中,19例患儿入我院时肿瘤细胞比例高,用新鲜骨髓DNA行基因突变检测;9例患儿入我院时因骨髓肿瘤细胞比例低于检测要求(<0.10)或仅有髓外病灶,用初发病骨髓DNA行基因突变检测。28例患儿均发生至少1种基因突变,其中25例(89%)检测出≥2种基因突变。检出主要突变基因包括:CREBBP、NRAS、KRAS各检出7例(25%),TP53、NT5C2各检出4例(14%),PTPN11、FLT3、FAT1、KMT2C、GATA2、TET2、EZH2、SETBP1各检出3例(11%)。初诊及复发时骨髓CREBBP、NRAS、KRAS、NT5C2、TP53基因突变检出情况比较,差异均无统计学意义(均P>0.05)(表1)。CREBBP突变7例,均早期复发;CREBBP联合KRAS突变2例,均早期复发;4例NT5C2突变的患儿中3例早期复发;4例TP53突变的患儿中3例早期复发。10例超二倍体患儿中KRAS、NRAS突变5例。
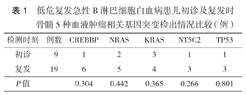
低危复发急性B淋巴细胞白血病患儿初诊及复发时骨髓5种血液肿瘤相关基因突变检出情况比较(例)
低危复发急性B淋巴细胞白血病患儿初诊及复发时骨髓5种血液肿瘤相关基因突变检出情况比较(例)
| 检测时刻 | 例数 | CREBBP | NRAS | KRAS | NT5C2 | TP53 |
|---|---|---|---|---|---|---|
| 初诊 | 9 | 1 | 2 | 3 | 1 | 1 |
| 复发 | 19 | 6 | 5 | 4 | 3 | 3 |
| P值 | 0.304 | 0.442 | 0.365 | 0.266 | 0.801 |
复发是导致B-ALL治疗失败的最常见原因。本研究病例选择于三甲医院或知名血液病专科医院明确诊断为B-ALL低危组,并按照规范B-ALL方案按序化疗的患儿进行研究,患儿接受的方案均为儿童ALL规范化疗方案,疗效类似,减少了治疗方案的影响。
本研究中大多患儿复发于维持治疗期(35%)及停药后(56%),提示低危患儿复发时间偏晚,且多发生于停药后。19例停药后复发患儿中13例复发于停药1年内,停药2年后无复发者,故停药后2年内尤其是1年内应注意疾病监测、随访,避免因高肿瘤负荷血液学复发而增加治疗难度。髓外浸润以中枢神经系统及睾丸为好发部位,缓解期患儿亦应定期通过腰椎穿刺行脑脊液检测,并注意男性患儿睾丸变化。
本研究复发患儿中9例在巩固治疗后至复发前曾出现MRD阳性,其中8例发生早期复发,提示完全缓解后MRD转阳可能与疾病早期复发相关。此外,本研究中MRD阳性的患儿初发病骨髓标本中检出iAMP21、IKZF1基因突变,应纳入中、高危组。提示初诊时应常规筛查如费城染色体样ALL、iAMP21、IKZF1等,及早发现高危因素,避免将中、高危组患者纳入低危组。
基因异常可影响肿瘤细胞特性和对治疗的反应[7],与白血病复发相关。本研究中血液肿瘤相关基因突变检测发现,出现频率较高的为CREBBP、RAS信号通路基因及TP53、NT5C2基因突变。(1)耐药相关基因:CREBBP基因突变导致糖皮质激素受体敏感基因表达明显减少,产生激素耐药,而糖皮质激素是ALL治疗的一线药物,耐药导致治疗失败及复发增多。本研究中7例复发低危B-ALL患儿存在CREBBP突变,且均为早期复发,与既往研究结果相符[8],表明CREBBP基因突变与ALL早期复发相关。NT5C2基因突变携带者对核苷类似物类药物(如6-巯基嘌呤、阿糖胞苷等)可产生耐药,是预后不良的遗传学因素[9]。Meyer等[10]的研究发现,NT5C2突变在儿童复发B-ALL中的发生率约为10%,且全部早期复发,本研究中4例(14%)患儿发生NT5C2突变,其中3例为早期复发患儿,与既往研究结果相似。(2)RAS信号通路(包括NRAS、KRAS等):该通路发生突变使RAS-RAF-MEK-ERK信号通路过度激活,导致肿瘤发生,与早期复发及不良预后相关。本研究中RAS信号通路基因突变发生率高,46%检测出NRAS和(或)KRAS突变,与Lu和Abdel-Wahab[11]的研究结果相近(44%)。而有研究报道CREBBP、KRAS同时突变较单一突变更易产生复发克隆,进而发生早期复发[9],本研究中CREBBP联合KRAS突变2例,均早期复发。(3)TP53基因失活突变:该突变被急性髓系白血病、骨髓增生异常综合征、骨髓增殖性肿瘤相关NCCN指南明确指出为不良预后的独立因素。一项涉及340例ALL患者的基因研究发现,TP53突变阳性患者与无突变者比较,儿童5年总生存率分别为50%、86%,成年人分别为0、43.3%。本研究4例TP53突变阳性患儿中3例早期复发。TP53阳性ALL患者易早期复发,预后不良,应作为危险分层因素对待[12]。(4)其他基因突变:PTPN11、FLT3、FAT1、KMT2C、GATA2、TET2、EZH2、SETBP1等突变对ALL复发的影响尚不明确,有待进一步研究。
虽然B-ALL中超二倍体及TEL-AML1融合基因阳性为低危组常见改变,治愈率高、预后良好,但其中不乏复发者。Dastugue等[13]对541例超二倍体ALL患儿进行研究发现,25%~30%患儿同时存在基因突变或缺失,包括FLT3、NRAS、KRAS、PTPN11、CREBBP等,与复发相关。有研究显示RAS信号通路基因异常在超二倍体患儿中的发生率为58.5%,其中NRAS、KRAS基因突变占47%[14]。目前一些研究把RAS通路的激活作为超二倍体ALL复发最重要的相关因素。本研究10例超二倍体患儿中KRAS、NRAS突变5例,与既往研究相符。本研究6例TEL-AML1阳性患儿中5例完成基因突变检测,均存在至少1种可能的有害变异,如KRAS、NRAS、TP53基因突变等。这表明预后不良相关基因突变可能抵消了超二倍体、TEL-AML1原有优势,初诊时存在超二倍体或TEL-AML1融合基因阳性者应排除不良预后基因的存在,调整危险度分层,修改治疗方案。此外,本研究中6例初发病时为正常核型或超二倍体核型的患儿复发时染色体出现复杂核型,表明肿瘤治疗过程中可能会诱导新的染色体异常发生,提示完全缓解患儿也应定期行染色体检测,若出现结构、数目异常,应高度警惕疾病复发。
因基因突变检测费用较高,为减轻患儿家庭经济负担,患儿入我院时肿瘤细胞比例高者,用新鲜骨髓DNA行基因突变检测,骨髓肿瘤细胞比例低于检测要求(<10%)或仅有髓外病灶者,用初发病骨髓DNA行基因突变检测,故患儿一般仅有1次基因突变检测的资料,本研究对5种发生频率较高的突变基因在初诊及复发时检出率差异进行了统计学分析,结果提示差异无统计学意义。此外,受限于我院目前初发病患儿数量较少的实际情况,未能进行非复发病例对照分析。但因目前国内儿童低危B-ALL复发与基因突变关系的相关研究较少,本研究检出基因突变情况与国外多篇文献报道结果相似[7,8,9,10,11,12],增加了我国儿童低危ALL复发相关基因突变方面的资料。
综上所述,B-ALL患儿初诊时完善各项检查,特别是分子生物学水平的检测,有助于精确分层,排除低危组中潜在的高危因素。完全缓解患者应定期监测MRD及染色体,治疗后期尤其是维持治疗期及停药后1年内应定期随访,发现问题时积极调整治疗方案。
所有作者均声明不存在利益冲突



























