
分析急性早幼粒细胞白血病(APL)合并肺癌脑转移的临床表现,提高对APL合并或继发第二肿瘤的认识。
回顾性分析南京市第一医院2018年2月收治的1例APL合并肺癌脑转移患者的诊断及治疗经过,并复习相关文献。
该患者初诊确诊为APL,治疗过程中因多尿、四肢乏力行PET-CT检查,结果发现胸椎异常信号,穿刺活组织检查诊断为APL伴肺癌脑转移。
APL治疗缓解后出现髓外异常肿块时,需借助多种检查方法明确肿块性质,避免误诊、漏诊。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性早幼粒细胞白血病(APL)是具有较高出血倾向和易早期死亡的特殊类型白血病,APL伴有第二原发肿瘤目前鲜有报道。我们收治了1例在治疗过程中伴发肺癌脑转移的APL患者,现报道如下。
患者,男性,62岁,2018年2月1日因咳嗽伴牙龈出血2周入院。血常规示:血红蛋白61 g/L,红细胞计数1.83×1012/L,白细胞计数3.32×109/L,中性粒细胞0.286,淋巴细胞0.322,单核细胞0.392,血小板计数11×109/L。外周血涂片见大量幼稚细胞,肝肾功能未见明显异常。2018年2月3日胸部CT示:右下肺小结节及左肺舌段、右中肺炎症(图1)。骨髓穿刺病理示APL(图2)。骨髓免疫分型:骨髓中异常细胞占91.5%,异常细胞表达CD9、CD13、CD33、CD38、CD64、CD117、CD123、MPO,部分表达CD15,BCR1型PML-RARα融合基因阳性,拷贝数为74 256。初步诊断为:急性髓系白血病(AML)M3型,美国东部肿瘤协作组(ECOG)评分0分。予以对症治疗改善症状,予维甲酸20 mg口服,2次/d,2个诱导疗程后复查骨髓细胞提示完全缓解。继续予以抗感染治疗,多次复查CT均示肺部感染较前吸收,右下肺结节性质待定,建议行肺穿刺活组织检查,患者家属拒绝,复查多次胸部CT均未见右下肺结节明显进展,感染灶较前吸收(图1),考虑右下肺结节为感染灶可能性较大。2018年4月11日给予伊达比星10 mg第1天至第3天,复查骨髓示PML-RARα融合基因阴性。2018年6月5日再给予三氧化二砷10 mg第1天至第14天治疗。再次复查胸部CT示:两肺感染,右中肺及右下肺高密度影,考虑炎症可能性大,右中肺可疑小结节。骨髓穿刺结果示:骨髓增生活跃,细胞形态未见明显异常,考虑为AML-M3完全缓解,且肺部结节病灶未见明显增长,故未再进行活组织检查。
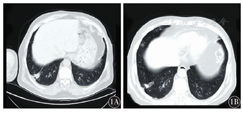

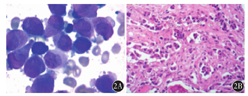

2018月10月6日患者因乏力、多尿半个月再次入院,肝肾功能检查未发现异常,排除内分泌性多尿后予以伊达比星及砷剂交替治疗,再次复查骨髓穿刺示骨髓象缓解,入院诊断为AML-M3完全缓解,ECOG评分3分。入院第4天患者突发头痛,急查脑部CT示脑内多发性异常信号,考虑转移瘤(部分病灶伴出血)?腰椎穿刺未见白血病细胞。入院第6天患者出现一过性口齿不清,无法直立行走,复查脑部CT均与前次结果一致。入院第8天PET-CT示:(1)APL,纵隔腔静脉窝淋巴结增大及胸6椎体局灶性骨密度增高,脱氧葡萄糖(FDG)摄取增高,考虑白血病浸润可能;(2)第11胸椎至第12胸椎水平椎管内条状FDG摄取增高灶,白血病浸润灶不除外;(3)双侧大脑、小脑、脑干密度不均,其中顶叶、枕叶及脑干多发结节影伴周围积液,FDG摄取与周围脑实质相近或略低,部分结节密度较高,伴出血可能;(4)右下肺叶不规则结节灶,FDG摄取稍增高,考虑机化性炎性病灶;白血病浸润肺或肺其他原发肿瘤不能完全除外。入院第10天胸椎穿刺病理结果示:骨髓组织中可见上皮样肿瘤细胞,细胞黏附性差,伴纤维组织增生(图2),结合免疫组织化学标志考虑差分化腺癌可能,考虑肺来源性大。分子病理结果显示:表皮生长因子受体(EFGR)第19号外显子缺失突变。修正诊断为:AML-M3完全缓解,ECOG评分3分,肺腺癌伴骨转移。患者口服靶向药物吉非替尼,后肺部结节较前减小,脑部多发异常信号区缩小。至截稿前,患者因肺癌化疗未再行骨髓穿刺检查。
APL是一种以异常早幼粒细胞增多、骨髓造血功能衰竭并伴t(15;17)为特征的特殊类型AML,随着维甲酸的诱导分化及砷剂的应用,诱导成功率可达85%~90%[1]。同时出现两种不同来源或不同性质的恶性肿瘤较少见,被称为重复癌或多原发肿瘤,根据发现的时间间隔可将其分为同时性和异时性多原发肿瘤[2]。本例患者结合骨髓病理及胸椎穿刺病理可诊断为APL合并肺腺癌,符合多原发肿瘤的诊断标准[3]。土耳其学者研究发现第一原发肿瘤最常见的部位通常在头颈部(22%)、乳腺(20%)和胃肠道(20%),而第二原发肿瘤最常见于胃肠道(22%)、呼吸系统(20%)及妇科(15%)[4];日本学者发现多原发肿瘤的发生率为0.73%~11.7%,大多位于消化系统[5],这与我国学者观点一致[6]。多原发肿瘤的病因目前尚无定论,考虑可能原因有:(1)肿瘤患者本身基因突变及内环境紊乱使恶性肿瘤再发生率增加;(2)化疗药物的使用及放疗射线对正常细胞的杀伤作用,细胞DNA复制表达错误,从而导致染色体畸变,正常细胞易于癌变,导致肿瘤的再发生;(3)生活方式及生活习惯、个体差异等;(4)患者基础疾病引起染色体核型的变化。本例患者最先诊断为急性白血病,在使用反式维甲酸及砷剂治疗过程中,不排除患者本身基因发生改变及化疗药物的致癌作用,因无法确定两种疾病发生的先后顺序,而根据确诊APL与肺癌的时间间隔>6个月,判断为异时性。有报道指出恶性血液肿瘤合并第二肿瘤中恶性血液肿瘤以AML及骨髓增生异常综合征最多见[7]。
临床上发生真菌感染的患者主要考虑曲霉菌属,而CT显示真菌感染类型主要有弥漫型、曲菌球型、实变型和结节型[8]。本例患者首次诱导治疗后,白细胞计数明显下降,免疫力低下,CT显示右下肺部结节状灶,考虑曲霉菌感染可能性大。而对于肺癌,当症状单一时可早期诊断,当需要与化疗后骨髓抑制所致肺部感染相区别时,往往会忽略肺部原发病灶感染,尤其当病灶吸收时,常易被误认为是炎性吸收。本例患者出现头痛,脑部CT示转移瘤可能,腰椎穿刺未见白血病细胞,因未行脑部活组织检查,结合后期患者使用吉非替尼后头痛症状较前减轻、行走尚可、肺部结节缩小及脑部异常信号区域减少,故诊断为肺癌脑转移。有学者分析了7 921例恶性血液肿瘤患者发现,合并肺癌发生率为0.33%(26/7 921)[9]。因此,本病例提示临床医生在治疗过程中遇到异常情况时,不应仅以肿瘤一元论考虑,需对化疗引起肺部感染及原发肺癌肺部感染加以区分。两者较难区分,通常需要根据患者的临床症状及实验室检查结果。李敏[10]认为影像学也是诊断肿瘤的重要方式,必要时可行多学科会诊、辅助诊断及通过穿刺明确病理类型。
在化疗过程中容易出现骨髓抑制,机会性感染的风险明显增加,最常见感染即是肺部感染,而对于骨髓抑制所引起的感染缺乏特异性,需加以区分及警惕。原发性肺部肿瘤引起的感染通常也无特异性,因此临床医生需要加强对不同疾病CT图像的认识。关于原发肿瘤与恶性肿瘤肺部转移的治疗,多原发肿瘤通常可针对各原发肿瘤的特性确定治疗方案,有根治的可能性[11]。但恶性肿瘤肺部转移大多数采用姑息治疗,导致患者生存率及生存时间明显不同,因此对易感人群尤其是放化疗后患者需要加强监测,发现异常情况后及时行病理检查以明确病因,及早应用靶向药物。
所有作者均声明不存在利益冲突



























