
B细胞淋巴瘤是一组高度异质性的肿瘤。不同亚型的表型取决于B细胞的分化阶段和遗传变化,反映在免疫表型、核型和肿瘤微环境的变化上,特别是微环境细胞组成的不同。文章介绍了B细胞淋巴瘤细胞的性质和微环境的细胞组成,探讨肿瘤微环境细胞在B细胞淋巴瘤发生、发展中的作用,为临床诊疗研究提供新的思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近半个世纪的分子生物学研究表明白血病与实体瘤虽然表型差别很大,但是没有本质区别,都是细胞的新生物,许多表型的差异由自身的遗传学特征及肿瘤微环境决定。多数肿瘤细胞在天然状态下只能存在于体内,在纯系动物中可以传代,有的能在体外培养成系,成为体外实验模型[1]。不同肿瘤有各自独特的肿瘤微环境,血液系统肿瘤的特点在于其微环境是血液、骨髓和淋巴组织等,与免疫细胞关系更为密切。然而白血病和实体瘤并无绝对的界限:有不少白细胞总数不高的非白血性白血病;临床上外周血出现肿瘤细胞的患者并不罕见,血液和淋巴是肿瘤细胞转移的常见渠道。淋巴瘤可发展为白血病,在某些情况下淋巴瘤的亚型可发生改变,同一患者在同一解剖部位可出现两种或以上不同细胞类型的淋巴瘤,称为复合型淋巴瘤;同一患者在不同解剖部位可出现不同细胞类型的淋巴瘤,称为不一致性淋巴瘤[2]。慢性淋巴细胞白血病(CLL)可呈惰性状态多年,也可呈侵袭性,有些研究者将其归为B细胞淋巴瘤[3,4]。肿瘤类型的转换反映了肿瘤与微环境免疫细胞共进化博弈的演化,阐明肿瘤微环境的性质,尤其是肿瘤细胞与微环境细胞的相互作用,不仅有理论意义,对于临床诊疗也有重要的指导意义。
B细胞淋巴瘤是B细胞发育过程中与其他免疫细胞和基质细胞异常相互作用形成的肿瘤。不同类型B细胞淋巴瘤的微环境差异很大,从炎症性的霍奇金淋巴瘤(HL)到免疫无能(anergic)导致免疫缺陷和易于感染的CLL。淋巴瘤细胞对微环境细胞的依赖程度至少有3种典型类型:经典霍奇金淋巴瘤(cHL)中,恶性细胞很少,其存活很大程度上依赖微环境中的其他细胞,称为"募集型"(recruitment);滤泡淋巴瘤(FL)中,至少在疾病早期,恶性细胞的存活和增殖在一定程度上依赖微环境细胞,称为"再教育型"(re-education);而在伯基特淋巴瘤(BL)中,恶性细胞由于携带突变获得自律性生长性质,完全不依赖微环境细胞,称为"抹杀型"(effacement)。其他类型的淋巴瘤细胞与微环境间的依赖程度各不相同(表1)[4,5]。
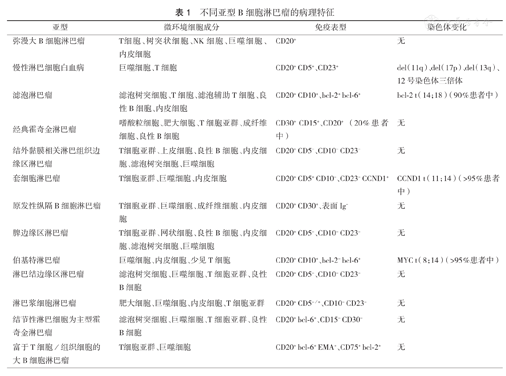
不同亚型B细胞淋巴瘤的病理特征
不同亚型B细胞淋巴瘤的病理特征
| 亚型 | 微环境细胞成分 | 免疫表型 | 染色体变化 |
|---|---|---|---|
| 弥漫大B细胞淋巴瘤 | T细胞、树突状细胞、NK细胞、巨噬细胞、内皮细胞 | CD20+ | 无 |
| 慢性淋巴细胞白血病 | 巨噬细胞、T细胞 | CD20+ CD5+、CD23+ | del(11q)、del(17p)、del(13q)、12号染色体三倍体 |
| 滤泡淋巴瘤 | 滤泡树突细胞、T细胞、滤泡辅助T细胞、良性B细胞、内皮细胞 | CD20+ CD10+、bcl-2+ bcl-6+ | bcl-2 t(14;18)(90% 患者中) |
| 经典霍奇金淋巴瘤 | 嗜酸粒细胞、肥大细胞、T细胞亚群、成纤维细胞、良性B细胞 | CD30+ CD15+、CD20+(20% 患者中) | 无 |
| 结外黏膜相关淋巴组织边缘区淋巴瘤 | T细胞亚群、上皮细胞、良性B细胞、内皮细胞、滤泡树突细胞、巨噬细胞 | CD20+ CD5-、CD10- CD23- | 无 |
| 套细胞淋巴瘤 | T细胞亚群、巨噬细胞、内皮细胞 | CD20+ CD5+ CD10-、CD23- CCND1+ | CCND1 t(11;14)(>95% 患者中) |
| 原发性纵隔B细胞淋巴瘤 | T细胞亚群、巨噬细胞、成纤维细胞、内皮细胞 | CD20+ CD30+、表面Ig- | 无 |
| 脾边缘区淋巴瘤 | T细胞亚群、网状细胞、良性B细胞、内皮细胞、滤泡树突细胞、巨噬细胞 | CD20+ CD5-、CD10- CD23- | 无 |
| 伯基特淋巴瘤 | 巨噬细胞、内皮细胞、少见T细胞 | CD20+ CD10+、bcl-2- bcl-6+ | MYC t(8;14)(>95% 患者中) |
| 淋巴结边缘区淋巴瘤 | 滤泡树突细胞、巨噬细胞、T细胞亚群、良性B细胞 | CD20+ CD5-、CD10- CD23- | 无 |
| 淋巴浆细胞淋巴瘤 | 肥大细胞、巨噬细胞、内皮细胞、T细胞亚群 | CD20+ CD5-/+、CD10- CD23- | 无 |
| 结节性淋巴细胞为主型霍奇金淋巴瘤 | 滤泡树突细胞、巨噬细胞、T细胞亚群、良性B细胞 | CD20+ bcl-6+、CD15- CD30- | 无 |
| 富于T细胞/组织细胞的大B细胞淋巴瘤 | T细胞亚群、巨噬细胞 | CD20+ bcl-6+ EMA+、CD75+ bcl-2+ | 无 |
HL的肿瘤细胞很少(<1%),瘤体以炎症细胞为主,原称霍奇金病,在确认其瘤细胞源于B细胞后称HL。cHL的特点是少数肿瘤细胞被大量正常细胞组成的免疫抑制细胞包围,cHL的瘤体由大量CD4+ T细胞和不同数量的嗜酸性粒细胞、组织细胞/巨噬细胞、各种B细胞、肥大细胞、浆细胞、成纤维细胞、间充质细胞和内皮细胞及丰富的细胞外基质组成。EB病毒相关的cHL含有更多的巨噬细胞。
HRS细胞是HL的肿瘤细胞,也是病理诊断的标志细胞,单个细胞核的称为Hodgkin细胞,双核或多核的称为RS细胞,现统称为HRS细胞。HRS通过多种机制逃逸免疫系统的作用,产生多种细胞因子和外泌体等,重编程正常细胞,使它们成为免疫抑制和促进肿瘤生长的肿瘤微环境的重要组成部分。HRS细胞具有特殊的形态和免疫表型,尤其是持续表达CD30,可通过免疫组织化学染色加以识别[6,7]。虽然HRS细胞来源于B细胞,但已失去B细胞受体,仅微弱表达CD19、CD20和CD79a等一些B细胞表面标志物。HRS细胞胞体大,直径可达50 μm以上,胞质数量适中,核内可见核仁。近年来的研究表明在一些非霍奇金淋巴瘤(NHL)、CLL和传染性单核细胞增多症中也可发现HRS细胞或HRS样细胞[8]。体外实验表明,这类多核大肿瘤细胞的形成机制可有两种:细胞融合和分裂阻滞[9,10]。多核巨细胞在其他恶性肿瘤的病理标本中也不少见,所以对HRS细胞的深入研究有重要意义。
在肿瘤微环境中HRS细胞与其他细胞的相互作用已有深入的阐明,包括直接的细胞相互作用和可溶性介质介导的相互作用。多种细胞因子和趋化因子参与各种类型细胞与HL微环境的相互作用。HRS细胞通过分泌趋化因子TARC、CC趋化因子5(CCL5)和CCL22募集CD4+辅助性T细胞。通过CCL20吸引调节性T(Treg)细胞。在对嗜酸性粒细胞和肥大细胞招募中,CCL5起重要作用。不仅HRS细胞可募集嗜酸性粒细胞,成纤维细胞也可通过分泌Eotaxin和CCL5募集它们。成纤维细胞分泌的CCL5也可能参与CD4+ T细胞的募集。嗜酸性粒细胞和肥大细胞可通过CD30-CD30配体相互作用刺激HRS细胞,粒细胞可通过4-BCMA相互作用和神经生长因子(NGF)的分泌刺激HRS细胞,NGF与受体酪氨酸激酶TRKA结合。CD4+ T细胞间相互作用可能涉及黏附分子(CD54-CD18或CD54-CD11a)和同源B细胞-T细胞相互作用的关键分子,即CD40-CD40L、主要组织相容性复合体Ⅱ(MHCⅡ)- T细胞受体(TCR)和CD80-CD28。细胞毒性T细胞(Tc细胞)被Treg细胞分泌的白细胞介素10(IL-10)及其他可能机制抑制,而RS细胞则通过分泌免疫抑制分子及程序性死亡受体配体1(PD-L1)直接抑制Tc细胞(图1)[11,12]。
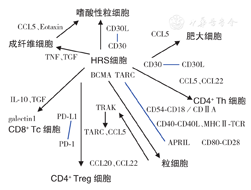

注: 表示受体与配体作用;
表示受体与配体作用; 表示细胞释放因子;CCL5为CC趋化因子5;TNF为肿瘤坏死因子;TGF为转化生长因子;IL为白细胞介素;PD-1为程序性死亡受体1;PD-L1程序性死亡受体配体1;Treg细胞为调节性T细胞;MHCⅡ为主要组织相容性复合体Ⅱ;TCR为T细胞受体;APRIL为增殖诱导配体;Tc细胞为细胞毒性T细胞;Th细胞为辅助性T细胞
表示细胞释放因子;CCL5为CC趋化因子5;TNF为肿瘤坏死因子;TGF为转化生长因子;IL为白细胞介素;PD-1为程序性死亡受体1;PD-L1程序性死亡受体配体1;Treg细胞为调节性T细胞;MHCⅡ为主要组织相容性复合体Ⅱ;TCR为T细胞受体;APRIL为增殖诱导配体;Tc细胞为细胞毒性T细胞;Th细胞为辅助性T细胞
肿瘤细胞利用细胞间的相互作用形成免疫抑制机制,促进肿瘤从免疫监视中逃逸,有的可以促进肿瘤的发病和进展,如FL和弥漫大B细胞淋巴瘤(DLBCL)的肿瘤微环境中存在大量的免疫逃逸机制(表2)[13]。

滤泡淋巴瘤和弥漫大B细胞淋巴瘤的免疫逃逸机制
滤泡淋巴瘤和弥漫大B细胞淋巴瘤的免疫逃逸机制
| 免疫缺陷 | 推测的机制 | |
|---|---|---|
| 免疫逃逸 | ||
| CD4+ T细胞识别缺陷 | MHCⅡ缺陷、MHCⅡ缺失、CREBBP突变、原浆细胞分化、突变谱系演变 | |
| CD8+ T细胞识别缺陷 | MHCⅠ缺陷、β2微球蛋白突变或缺失、突变谱系演变 | |
| NK细胞识别缺陷 | CD58缺陷、突变或缺失 | |
| 吞噬功能降低 | CD47过表达 | |
| 免疫颠覆 | ||
| T/NK细胞活力缺损 | 表达抑制分子(CD200、PD-L1、HVEM、LLT1)、产生IL-12和TGF-β、产生IDO和IL4I1 | |
| Treg/Tfr细胞增多 | 产生CCL22,表达CD70、CD80/CD86、ICOSL、TGF-β | |
| MDSC增多 | 产生IL-10 | |
| 抑制性非造血细胞增多(内皮细胞、基质细胞) | 未知 | |
注:Treg细胞为调节性T细胞;Tfr细胞为滤泡调节T细胞;MDSC为骨髓来源的抑制性细胞;MHC为主要组织相容性复合体;CREBBP为CREB结合蛋白;PD-L1为程序性死亡受体配体1;IL为白细胞介素;TGF为转化生长因子
与实体恶性肿瘤不同,许多淋巴瘤在初诊时已经播散。许多淋巴瘤细胞表达趋化因子受体和黏附分子,它们的表达模式与淋巴瘤亚型的变异位点相关。尽管淋巴瘤的不同亚型在肿瘤微环境的范围和组成上存在很大差异,在cHL、DLBCL和FL等常见淋巴瘤的活组织检查中进行的基因表达谱研究表明,诊断时微环境的状况与患者预后密切相关(表3)[14]。

部分B细胞淋巴瘤肿瘤微环境中细胞成分变化的预后意义
部分B细胞淋巴瘤肿瘤微环境中细胞成分变化的预后意义
| 淋巴瘤亚型变化 | 肿瘤微环境细胞成分变化 | 预后意义 |
|---|---|---|
| 霍奇金淋巴瘤CD68+浸润↑ | 巨噬细胞基因表达↑ | 不利 |
| 骨髓衍生抑制细胞↑ | 不利 | |
| 调节性T细胞↑ | 有利 | |
| 非滤泡B细胞↑ | 有利 | |
| 细胞毒性T细胞↑ | 不利 | |
| 弥漫大B细胞淋巴瘤 | CD68+ TAM和CD68 mRNA↑ | 化疗不利、化疗-免疫有利 |
| 滤泡淋巴瘤 | PD-1+ TIL↑ | 有利 |
| 调节性T细胞↑ | 不利 | |
| 边缘区淋巴瘤 | 大量CD40+细胞浸润 | 不利 |
| 套细胞淋巴瘤 | 瘤细胞黏附到基质上 | 不利 |
注:TAM为肿瘤相关巨噬细胞;PD-1为程序性死亡受体1;TIL为肿瘤浸润淋巴细胞
文献报道的肿瘤相关髓系细胞有5类:肿瘤相关巨噬细胞(TAM)、表达血管生成蛋白2受体的单核细胞(TEM)、骨髓来源抑制细胞(MDSC)、肿瘤相关中性粒细胞(TAN)和肿瘤相关树突细胞(TADC),其中对TAM的研究较多(图2)[15]。
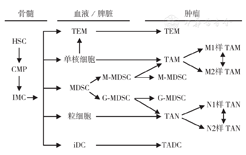

注:HSC为造血干细胞;CMP为髓系共同祖细胞;IMC为不成熟髓系细胞;TEM为表达血管生成蛋白2受体的单核细胞;MDSC为骨髓来源抑制细胞;G-MDSC为粒系MDSC;M-MDSC为单核系MDSC;iDC为不成熟树突细胞;TADC为肿瘤相关树突细胞;TAM为肿瘤相关巨噬细胞;TAN为肿瘤相关粒细胞
巨噬细胞在许多病理生理过程中起核心作用,在癌症或慢性炎症中巨噬细胞持续感知它们的微环境,适应其变化,呈现明显的可塑性。除了应激信号、代谢物及与细胞的直接接触外,许多细胞因子在控制巨噬细胞极化方面起着核心作用。血液循环的单核细胞是组织巨噬细胞的重要来源,随着微环境的不同极化为M1或M2型。M1型由干扰素(IFN)-γ和LPS诱导产生,表达高水平的IL-6、IL-12、IL-23和肿瘤坏死因子(TNF)-α等促炎细胞因子及Toll样受体激动剂。M2表型可分为M2a、M2b、M2c和M2d 4个亚型,分别由不同的微环境因素诱导。其中IL-4和IL-13诱导形成M2a;免疫复合物和Toll样受体诱导形成M2b;IL-10和转化生长因子(TGF)-β诱导形成M2c;肿瘤微环境诱导形成M2d。通常把肿瘤微环境中TAM归为M2活化表型,它们表现出抗炎和促肿瘤作用,有利于肿瘤生长。TAM合成和分泌多种生长因子、细胞因子、趋化因子、细胞外基质成分和蛋白酶,这些因子促进基质重构、血管新生、抗免疫和促肿瘤发展,并参与肿瘤耐药机制。更深入的研究证实,肿瘤微环境中的巨噬细胞也具有异质性,不仅不同类型肿瘤中TAM的性质不同,而且同一肿瘤不同部位TAM性质也不同,如低氧区的TAM表现出更多M2表型的性质,而常氧区的TAM表现出更多M1表型的性质。
TAM不仅影响周围的炎症环境,还产生类似活性氧的致突变物质,这些物质可能支持或加快肿瘤的发生。此外,TAM还能表达关键的免疫检查点分子,包括程序性死亡受体1(PD-1)和PD-L1,抑制全身炎症反应,使肿瘤细胞逃避抗肿瘤免疫。TAM直接影响肿瘤生长的多个方面,包括肿瘤细胞的存活、增殖、干细胞性和侵袭性,还影响血管生成和免疫抑制。TAM通过与肿瘤进展相关的细胞(包括Th2细胞、肿瘤相关成纤维细胞、肿瘤细胞、Treg细胞和MDSC)的相互作用实现这些功能。TAM细胞对抑癌细胞(Tc和NK细胞)也有负调节作用。PD-1是TAM表达的关键受体之一,当与PD-L1相互作用时,在诱导肿瘤细胞免疫逃逸中起至关重要的作用。此外,TAM还能中和促炎症和抗肿瘤M1表型的作用。经典活化的M1巨噬细胞表达高水平的MHC分子,有很强的杀伤肿瘤细胞作用。相关研究推测,将M2重编程为M1表型,是逆转肿瘤、促进肿瘤消退的有应用前景的方法[16,17]。
巨噬细胞广泛存在于复杂的肿瘤微环境中,并与其他细胞相互作用。B淋巴细胞和巨噬细胞是人类免疫系统的重要组成部分,二者的相互作用可能产生致瘤的内在环境。B细胞瘤有时转化为单核细胞/巨噬细胞,甚至成为双表型细胞[18]。对于巨噬细胞与B淋巴细胞之间日益重要的相互作用,尤其是侵袭性NHL-B患者的巨噬细胞与B淋巴样细胞的相互作用知之甚少,有待深入研究[19]。
近半个世纪以来,在肿瘤学中采用进化医学的观点和方法进行研究取得了很大进步[20,21],淋巴瘤的发病机制和防治研究进展尤其显著,如HL。虽然大多数HL患者通过初步治疗能够治愈,但是10%~15%的早期患者和15%~30%的晚期患者存在原发难治或复发[22],其更深层次的机制有待进一步的临床和实验研究阐明。
所有作者均声明不存在利益冲突



























