
目前针对复发难治性非霍奇金淋巴瘤(NHL),治疗方案较少且疗效有限。组蛋白去乙酰化酶抑制剂(HDACi)可以通过靶向抑制组蛋白去乙酰化酶(HDAC)活性,调控基因表达,从而发挥抗肿瘤作用。HDACi单药或联合其他抗肿瘤药物治疗复发难治NHL表现出较好的疗效。现就HDACi治疗NHL的进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
组蛋白修饰是人体细胞表观遗传学重要的调控方式。组蛋白去乙酰化酶(HDAC)是重要的维持细胞新陈代谢动态平衡酶。HDAC通过组蛋白去乙酰化介导的染色质缩合发挥抑制转录作用[1]。HDAC异常被证实是淋巴血液肿瘤和其他实体肿瘤的主要致病因素。组蛋白去乙酰化酶抑制剂(HDACi)可以通过靶向抑制HDAC活性,调节组蛋白乙酰化水平,调控基因表达,从而发挥抗肿瘤作用。HDACi可分为苯酰胺类(如西达本胺)、异羟肟酸类(如贝利司他、伏立诺他)、环四肽类(如罗米地辛)、短链脂肪酸类、亲电子酮类和其他类。复发难治非霍奇金淋巴瘤(NHL)尤其是应用2种以上系统治疗方案后进展的患者,很难再从单纯化疗方案中获益。在临床上,HDACi联合其他抗肿瘤药物的治疗方案在复发难治的外周T细胞淋巴瘤(PTCL)及治疗中表现出较好的疗效和安全性,提高了患者的客观缓解率(0RR)及生存期。还有研究表明HDACi对复发难治的B细胞淋巴瘤也有较好治疗效果。文章就HDACi治疗NHL的应用现状及进展进行综述。
西达本胺是我国自主研发的选择性苯酰胺类口服HDACi,并被我国食品药品监督管理总局批准上市。西达本胺主要针对第Ⅰ类HDAC中的1、2、3亚型和第Ⅱb类的10亚型。相对于现有的异羟肟酸和苯甲酰胺类抑制剂,表现出更好的代谢稳定性。在反转耐药肿瘤细胞增加其药物的敏感性和抑制肿瘤转移、复发等方面发挥良好的效果。
早期临床试验中,西达本胺在复发难治的PTCL治疗中表现出了良好的疗效。Shi等[2]应用西达本胺单药治疗79例复发难治PTCL患者的Ⅱ期研究,患者ORR达28%,其中14%获得完全缓解/未确认完全缓解(CR/CRu)。中位无进展生存(mPFS)和总生存(OS)时间分别为2.1、21.4个月。其中血管免疫母T细胞淋巴瘤(AITL)患者的疗效高于其他PTCL亚型。最常见的不良反应为血液学不良反应,多为1、2级,耐受性良好。且与已上市的HDACi和普拉曲沙相比,西达本胺引起可观察到的胃肠道紊乱和感染发生率较低,且不良反应较轻。由此,西达本胺在我国被批准用于复发难治PTCL的治疗。随后,Shi等[3]的多中心真实世界研究发现西达本胺联合和(或)不联合化疗治疗复发难治PTCL也表现出良好的疗效和安全性。其中,西达本胺联合CHOP方案、含铂方案和其他方案的患者ORR分别为53.13%、45.83%和55.32%,疾病控制率(DCR)分别为81.25%、66.67%和76.60%,mPFS分别为172、119、160 d。相较于单纯化疗,西达本胺联合化疗可延长患者PFS,但未观察到OS的差异[4]。
本中心通过试验发现弥漫大B细胞淋巴瘤(DLBCL)患者对R-CHOP方案耐药的机制与利妥昔单抗导致CD20表达下调有关。此外,西达本胺联合利妥昔单抗可以克服利妥昔单抗诱导的CD20表达下调,并上调CD20表达,逆转DLBCL对利妥昔单抗的耐药性。这为西达本胺治疗利妥昔单抗耐药的DLBCL患者提供了理论依据。本中心1例患者经过23个周期化疗及免疫治疗后,复发的DLBCL患者在应用该方案3个周期后达到CR[5]。Li等[6]报道1例TP53突变的复发难治DLBCL患者,应用西达本胺联合利妥昔单抗、泼尼松、环磷酰胺、沙利度胺治疗,达到持续部分缓解(PR)。有研究认为西达本胺可能是通过抑制突变的TP53转录和翻译,并上调肿瘤细胞表面CD20表达来发挥的。这些结果都为复发难治B细胞淋巴瘤治疗提供新的思路。
贝利司他为异羟肟酸类静脉HDACi,主要抑制Ⅰ、Ⅱ和Ⅳ类HDAC。贝利司他单药或联合用药在T细胞淋巴瘤中表现出良好的疗效和耐受性,特别适用于血小板减少患者。但在B细胞淋巴瘤中疗效并不理想。
Foss等[7]和O'Connor等[8]的研究证明贝利司他单药在治疗复发难治PTCL(ORR为25.0%和25.8%)和皮肤T细胞淋巴瘤(CTCL)(ORR为14%)患者中有良好的疗效和耐受性,血小板减少的患者不仅可耐受该药物还可从治疗中获益,该药还为桥接干细胞移植(SCT)提供机会。在O'Connor等[8]研究中,12例PTCL患者在接受贝利司他治疗后进行SCT,10例在数据截止时仍生存(OS范围为9.4~22.9个月)。其中1例73岁复发难治PTCL患者持续CR>39个月[9]。该药于2014年7月被美国食品药品监督管理局(FDA)批准用于复发难治PTCL。Patrick等[9]在2015年美国血液学会(ASH)年会上报道,应用贝利司他联合CHOP方案治疗初治PTCL患者,表现出较好的疗效及耐受性。ORR为89%(16/18),13例患者获得CR,最常见3/4级不良反应为血液学不良反应。不良反应的发生率与单独应用CHOP方案治疗无明显差异。
贝利司他单药治疗复发难治B细胞淋巴瘤疗效不理想,只有小部分患者可能受益。一项贝利司他单药治疗复发难治B细胞淋巴瘤的研究发现,患者ORR为10.5%(2/19),mPFS为2.1个月,mOS为13.4个月。其中2例患者获得PR,PFS时间分别为50.9、11.7个月。3例患者获得疾病稳定(SD),PFS时间分别为4.7、>42.3和>68.4个月[10]。
罗米地辛为环四肽类静脉HDACi,抑制Ⅰ类HDAC的酶活性。该药物在2009年被美国FDA批准用于治疗复发难治CTCL,在2011年被批准用于治疗复发难治PTCL。一些研究发现该药与其他抗肿瘤药物联合方案可使晚期淋巴瘤患者获益,为患者进行SCT提供机会。
Coiffier等[11]证明了罗米地辛单药治疗复发难治PTCL具有较好的疗效和安全性,且罗米地辛的有效性与之前的治疗方案和治疗周期数无关。截止到最后一次随访时间,19例(19/130)获得CR/CRu的患者中有10例持续CR≥12个月,其中6例患者总缓解期≥24个月,最长>48个月,mPFS为29个月[12]。Strati等[13]发现罗米地辛联合ICE(异环磷酰胺,卡铂,依托泊苷)方案治疗复发难治PTCL患者的疗效优于单用罗米地辛或ICE方案治疗,且不增加不良反应。在可评价的15例患者中,ORR为93%,经治疗9例患者获得了SCT机会。
罗米地辛联合GDP(吉西他滨、地塞米松、顺铂)方案[14]、普拉曲沙[15]、阿扎胞苷(AZA)[16]或苯达莫司汀[17]治疗复发难治PTCL反应性均好于单用其中一种治疗方案(表1),且不良反应可耐受。尽管每种方案治疗患者数量较少,但值得进一步研究。
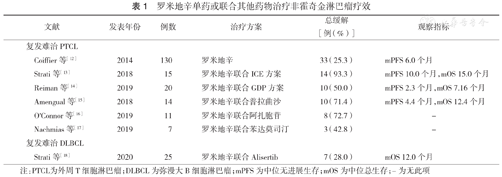
罗米地辛单药或联合其他药物治疗非霍奇金淋巴瘤疗效
罗米地辛单药或联合其他药物治疗非霍奇金淋巴瘤疗效
| 文献 | 发表年份 | 例数 | 治疗方案 | 总缓解[例(%)] | 观察指标 | |
|---|---|---|---|---|---|---|
| 复发难治PTCL | ||||||
| Coiffier等[12] | 2014 | 130 | 罗米地辛 | 33(25.3) | mPFS 6.0个月 | |
| Strati等[13] | 2018 | 15 | 罗米地辛联合ICE方案 | 14(93.3) | mPFS 10.0个月,mOS 15.0个月 | |
| Reiman等[14] | 2019 | 20 | 罗米地辛联合GDP方案 | 10(50.0) | mPFS 2.3个月,mOS 7.16个月 | |
| Amengual等[15] | 2018 | 14 | 罗米地辛联合普拉曲沙 | 10(71.4) | mPFS 4.4个月,mOS 12.4个月 | |
| O'Connor等[16] | 2019 | 11 | 罗米地辛联合阿扎胞苷 | 8(72.7) | - | |
| Nachmias等[17] | 2019 | 7 | 罗米地辛联合苯达莫司汀 | 3(42.8) | - | |
| 复发难治DLBCL | ||||||
| Strati等[18] | 2020 | 25 | 罗米地辛联合Alisertib | 7(28.0) | mOS 12.0个月 | |
注:PTCL为外周T细胞淋巴瘤;DLBCL为弥漫大B细胞淋巴瘤;mPFS为中位无进展生存;mOS为中位总生存;-为无此项
罗米地辛联合Alisertib治疗复发难治B细胞(14例)、PTCL(4例)及霍奇金淋巴瘤(7例)患者的Ⅰ期临床研究发现,仅1例DLBCL患者获得PR。且在后期随访中该患者疾病进展,mOS为12个月[18],效果劣于单药方案。
伏立诺他为异羟肟酸类口服HDACi,抑制Ⅰ类和Ⅱ类HDAC活性。该药物通过调控细胞周期和MAPK信号通路相关基因表达发挥抗肿瘤作用。
伏立诺他治疗复发难治CTCL患者的疗效较好,两项单臂Ⅱ期研究的ORR分别为24%和30%,持续反应时间分别为4个月和>6个月[1]。常见不良反应为恶心、腹泻、疲劳和血小板减少等。在一项扩展研究中,32%的患者临床症状缓解,生活质量改善。基于以上结果,伏立诺他于2006年成为第一个被批准用于治疗复发难治CTCL的口服HDACi[1]。伏立诺他联合CHOP方案治疗12例初治PTCL患者表现出较好的安全性及疗效,12例患者均达到CR,总缓解期为29个月,2年PFS、OS率分别为79%和82%[19]。
Budde等[20]的伏立诺他联合(R)ICE方案治疗复发难治淋巴瘤试验。在可评估的27例中,ORR为70%,其中DLBCL 4例(67%),套细胞淋巴瘤(MCL)3例(60%),滤泡淋巴瘤(FL)3例(100%)。常见3~4级不良反应为胃肠道反应、发热性中性粒细胞减少、感染、低磷血症等。
Nieto等[21]应用伏立诺他联合大剂量吉西他滨、白消安和美法仑在治疗复发难治DLBCL患者中体现出较好的疗效,ORR为96.4%(27/28)。随后该团队在此基础上将AZA加入到方案中。中位随访时间15个月,其中DLBCL的ORR为76.9%(20/26),EFS和OS率分别为65%和77%;常见不良反应为黏膜炎、皮炎、肝功能异常等。试验证明进行双表观遗传调控是可行的,疗效良好,且加入AZA后不良反应并未显著增加,值得进一步试验评估[22]。
另一项应用伏立诺他联合克拉屈滨和利妥昔单抗(SCR)方案治疗复发B细胞NHL和初治MCL患者的试验研究中发现,伏立诺他联合SCR方案对初治MCL患者有较好的疗效。ORR为97.4%(38/39),其中31例患者获得CR,mPFS为84个月,mOS未达到。但对复发的B细胞NHL效果不明显。进一步证明双表观遗传调控的有效性及潜力[23]。
然而,FL的ORR为50%(11/22,9例CR)。MCL中3例患者中有1例达到了PR,边缘区淋巴瘤(MZL)中2例患者中有1例达到了CR。部分联合方案在治疗B细胞淋巴瘤中表现较差。伏立诺他联合硼替佐米治疗复发难治DLBCL或MCL患者[24],联合R-CHOP治疗初治的晚期DLBCL患者均未达到预期的疗效,且不良事件发生率高[25]。
对于复发难治的NHL,有效治疗方案少且疗效有限。免疫、靶向治疗等方法是主要的研究方向,并取得了较好的治疗效果[1]。HDACi的出现改善了T细胞淋巴瘤患者的预后,同时单药或联合其他药物治疗复发难治的NHL也表现出较好的疗效。未来HDACi联合方案能否成为适合复发难治NHL的治疗方法,仍需要进一步的试验和评估。
所有作者均声明不存在利益冲突



























