
研究阿帕替尼对FLT3-ITD突变的急性髓系白血病(AML)细胞增殖及凋亡的影响,并探讨相关机制。
取对数生长期FLT3-ITD突变的AML细胞株MV4-11和MOLM-13,分别采用不同浓度阿帕替尼处理48 h,采用CCK-8法检测细胞增殖情况,流式细胞术检测细胞凋亡情况,JC-1法检测线粒体膜电位的变化,蛋白质印迹法分析血管内皮生长因子受体2(VEGFR2)通路相关蛋白表达的变化。
阿帕替尼对MV4-11和MOLM-13细胞株均具有增殖抑制作用,48 h半数抑制浓度(IC50)分别为(2.23±0.42)μmol/L、(4.08±2.62)μmol/L。流式细胞术检测细胞凋亡结果显示,10、20、30、40 μmol/L阿帕替尼对MV4-11和MOLM-13细胞具有诱导凋亡作用,且作用呈浓度依赖性,48 h细胞凋亡率分别为(81.95±1.15)%、(88.80±0.23)%、(97.46±0.49)%、(99.29±0.05)%及(47.30±0.87)%、(67.00±3.71)%、(82.60±2.89)%、(98.06±5.34)%,差异均有统计学意义(F=6 915.0,P<0.01;F=5 385.0,P<0.01)。JC-1法检测线粒体膜电位结果显示,10、20、30、40 μmol/L阿帕替尼作用MV4-11和MOLM-13细胞24 h后,JC-1多聚体/单体平均荧光强度(MFI)比值分别为0.45±0.06、0.19±0.07、0.12±0.03、0.09±0.01及0.84±0.05、0.66±0.13、0.35±0.11、0.27±0.02,与对照组(0.67±0.15和0.97±0.42)相比,差异均具有统计学意义(F=372.3,P<0.05;F=276.4,P<0.05)。蛋白质印迹法检测不同浓度阿帕替尼(2.5、5.0、10.0 μmol/L)作用MV4-11细胞株24 h结果发现,阿帕替尼可下调VEGFR2、Src和STAT3磷酸化水平,且作用呈浓度依赖性。
阿帕替尼对FLT3-ITD突变AML细胞具有抑制增殖和诱导凋亡的作用,其机制可能与下调VEGFR2及其下游Src和STAT3磷酸化水平相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
FLT3-ITD突变是正常核型急性髓系白血病(AML)患者最常见的突变类型,约占初诊AML患者的30%。FLT3-ITD突变AML患者预后较差,接受造血干细胞移植者的中位总生存(OS)时间仅17个月,而未接受移植者的中位OS时间仅9个月[1]。由于传统治疗效果不佳,靶向抑制FLT3抑制剂成为治疗FLT3-ITD突变AML的热点,目前已有多种FLT3抑制剂进入临床应用阶段[2]。然而目前国内上市药物只有索拉非尼(sorafenib),临床应用发现其疗效并不满意,不良反应及继发耐药的问题相对严重[3]。我国自主研发的新型小分子酪氨酸激酶抑制剂阿帕替尼(apatinib)是一种选择性靶向抑制血管内皮生长因子受体2(VEGFR2)的抗血管生成药物,已广泛应用于实体瘤的治疗[4,5,6,7]。但是关于阿帕替尼在血液肿瘤中的研究目前相关报道尚少,因此本研究探讨阿帕替尼对FLT3-ITD突变AML细胞的作用及其分子机制,为FLT3-ITD突变AML患者提供治疗选择。
甲磺酸阿帕替尼(YN968D1)为江苏恒瑞医药股份有限公司产品。CCK-8试剂、JC-1试剂盒均购自上海碧云天生物技术有限公司。Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国eBioscience公司。BCA法蛋白浓度测定试剂盒购自美国Pierce公司。兔单克隆抗VEGFR2抗体、兔单克隆抗pVEGFR2抗体、兔单克隆抗Src抗体、兔单克隆抗pSrc抗体、兔单克隆抗STAT3抗体、兔多克隆抗pSTAT3抗体、辣根过氧化物酶(HRP)偶联抗兔二抗均购自美国Cell Signaling Technology公司。
FLT3-ITD突变AML细胞株MV4-11和MOLM-13均由厦门大学附属第一医院血液病研究所传代保存。MV4-11和MOLM-13细胞培养于含10%胎牛血清的伊思柯夫改良培养液(IMDM)中,置于37 ℃、5% CO2恒温细胞培养箱中培养,取对数生长期细胞离心,锥虫蓝染色后计数,拒染细胞超过98%用于后续实验。
取对数生长期MV4-11和MOLM-13细胞悬液以5×104/孔分别接种于96孔板中,每孔100 μl。设置对照组(加入含10%胎牛血清的IMDM 100 μl)及不同浓度阿帕替尼组(2.5、5.0、10.0、20.0、40.0 μmol/L)。37 ℃、5% CO2恒温细胞培养箱中培养48 h后,每孔加入10 μl CCK-8工作液,在培养箱中继续培养2~4 h后,酶标仪测定450 nm处吸光度(A)值,计算细胞增殖抑制率。半数抑制浓度(IC50)为50%细胞生长受抑时的药物浓度。
细胞增殖抑制率(%)=(1-药物组A值/对照组A值)×100%
取对数生长期MV4-11和MOLM-13细胞,以2×105/孔分别接种于24孔板。设置对照组(加入含10%胎牛血清的IMDM 100 μl)和不同浓度阿帕替尼组(10、20、30、40 μmol/L)。37 ℃、5% CO2恒温细胞培养箱中培养48 h后收集细胞。参照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作步骤处理细胞后,流式细胞仪检测。凋亡细胞比例为Annexin V阳性细胞占分析细胞的比例。
取对数生长期MV4-11和MOLM-13细胞悬液,300×g,离心5 min,弃上清,计数细胞,调整细胞密度为5×105/ml,接种于24孔板中,每孔1 ml细胞悬液。设置对照组(加入含10%胎牛血清的IMDM 100 μl)及不同浓度阿帕替尼组(10、20、30、40 μmol/L)。37 ℃、5% CO2恒温细胞培养箱中培养24 h后收集细胞。参照上海碧云天生物技术有限公司JC-1线粒体膜电位检测试剂盒说明书操作步骤处理细胞后,流式细胞仪检测。细胞线粒体膜电位用JC-1多聚体/单体平均荧光强度(MFI)比值表示。
分别收集对照组(加入含10%胎牛血清的IMDM 100 μl)及不同浓度阿帕替尼(2.5、5.0、10.0 μmol/L)分别作用24 h后的MV4-11细胞,300×g离心5 min,弃上清。加入100 μl含1% PMSF的RIPA裂解液,将裂解液与细胞充分混匀,冰上裂解15 min后,4 ℃,12 000×g离心15 min,取上清至新的1.5 ml EP管中,按照BCA试剂盒说明书操作步骤测定蛋白浓度。取等量变性后的蛋白用12%十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,完毕后转至聚偏氟乙烯(PVDF)膜。用含5%脱脂奶粉的TBST溶液室温封闭2 h,分别放入相应的1∶1 000抗体稀释液中,4 ℃摇床过夜。TBST洗膜3次后把目的条带放入HRP标记的羊抗兔二抗(1∶10 000),室温培养1 h,TBST洗膜3次。膜与化学发光底物反应5 min,暗室中电化学发光法(ECL)显色,压片曝光。
采用SPSS 20.0软件处理数据,计量资料符合正态分布,以均数±标准差( ±s)表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。每个实验重复3次,每次实验设置至少3个复孔。
±s)表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。每个实验重复3次,每次实验设置至少3个复孔。
阿帕替尼对MV4-11和MOLM-13细胞均具有增殖抑制作用,IC50值分别为(2.23±0.42)μmol/L、(4.08±2.62)μmol/L。不同浓度阿帕替尼(2.5、5.0、10.0、20.0、40.0 μmol/L)对MV4-11细胞增殖抑制作用呈浓度依赖性,细胞增殖抑制率分别为(57.89±2.31)%、(69.86±1.42)%、(80.63±3.41)%、(86.50±2.01)%和(91.10±2.34)%,差异有统计学意义(F=139.5,P<0.01);对MOLM-13细胞增殖抑制作用同样呈浓度依赖性,细胞增殖抑制率分别为(45.15±3.12)%、(59.45±2.75)%、(87.10±1.92)%、(93.80±3.22)%和(99.03±1.76)%,差异有统计学意义(F=201.7,P<0.01)。
10、20、30、40 μmol/L阿帕替尼对MV4-11细胞具有浓度依赖性诱导凋亡作用,48 h细胞凋亡率分别为(81.95±1.15)%、(88.80±0.23)%、(97.46±0.49)%和(99.29±0.05)%,差异有统计学意义(F=6 915.0,P<0.01)(图1);对MOLM-13细胞同样具有浓度依赖性诱导凋亡作用,细胞凋亡率分别为(47.30±0.87)%、(67.00±3.71)%、(82.60±2.89)%和(98.06±5.34)%,差异有统计学意义(F=5 385.0,P<0.01)(图2)。


注:对照组加入含10%胎牛血清的伊恩柯夫改良培养液
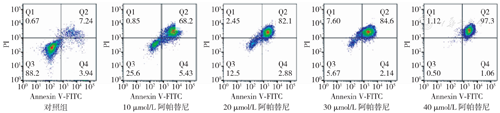

注:对照组加入含10%胎牛血清的伊恩柯夫改良培养液
10、20、30、40 μmol/L阿帕替尼作用MV4-11后,JC-1多聚体/单体MFI比值为0.45±0.06、0.19±0.07、0.12±0.03、0.09±0.01,与对照组(0.67±0.15)相比均下降,差异具有统计学意义(F=372.3,P<0.05);10、20、30、40 μmol/L阿帕替尼作用MOLM-13后,JC-1多聚体/单体MFI比值为0.84±0.05、0.66±0.13、0.35±0.11、0.27±0.02,与对照组(0.97±0.42)相比均下降,差异具有统计学意义(F=276.4,P<0.05)。提示阿帕替尼处理24 h后的MV4-11和MOLM-13细胞线粒体膜电位呈浓度依赖性下降。
不同浓度(2.5、5.0、10.0 μmol/L)阿帕替尼作用MV4-11细胞24 h后,阿帕替尼呈浓度依赖性下调VEGFR2、Src和STAT3磷酸化水平,而总蛋白水平无明显变化(图3)。提示阿帕替尼对MV4-11和MOLM-13细胞诱导细胞凋亡作用可能与下调VEGFR2、Src、STAT3表达有关。
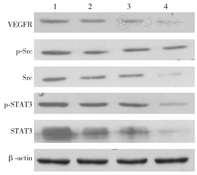

注:1为对照组(加入含10%胎牛血清的伊思柯夫改良培养液);2为2.5 μmol/L阿帕替尼组;3为5.0 μmol/L阿帕替尼组;4为10.0 μmol/L阿帕替尼组
AML是一种高度异质性的恶性克隆性疾病,FLT3-ITD突变是AML中最常见的遗传学改变,FLT3-ITD突变AML患者常表现为高白细胞血症,且复发率高及无病生存期短。美国国立综合癌症网络(NCCN)指南已将FLT3-ITD作为AML患者预后不良的独立预后标志,是目前AML治疗的重点及难点[8]。
由于传统化疗策略对FLT3-ITD突变AML疗效不佳,FLT3的抑制剂成为FLT3-ITD突变AML治疗的重点。目前已有5种FLT3抑制剂[米哚妥林(midostaurin)、索拉菲尼(sorafenib)、奎扎替尼(quizartinib)、吉列替尼(gilteritinib)及crenolanib]进入临床试验。然而目前国内仅有索拉菲尼,有报道索拉菲尼虽可以改善年龄<60岁难治复发AML患者的无事件生存率,却增加年龄>60岁难治复发AML患者的死亡率[9]。提示该药不良反应较大,且继发耐药发生率较高。探索已有新型靶向药物对FLT3-ITD突变AML细胞杀伤作用的新潜能具有"事半功倍"的效果。本研究发现阿帕替尼对FLT3-ITD突变AML具有增殖抑制和诱导凋亡作用,而且48 h的IC50均低于目前临床所应用的浓度,表明该药对于FLT3-ITD突变AML具有较好的转化前景。阿帕替尼为我国自主研发的新药,并已上市,价格相对较低且不良反应相对较小,本研究的发现为阿帕替尼在FLT3-ITD突变AML中的应用奠定了理论基础和实验基础。
线粒体膜电位在决定细胞存活及凋亡过程中起关键作用。研究表明,线粒体膜电位下降是细胞凋亡的早期标志性事件[10],且不可逆转。本研究结果显示,阿帕替尼作用MV4-11和MOLM-13细胞24 h后导致细胞线粒体膜电位下降,提示阿帕替尼诱导FLT3-ITD突变AML细胞凋亡的作用可能与触发线粒体凋亡有关。
FLT3-ITD突变导致FLT3的异常激活,致使FLT3受体在不依赖配体的情况下持续自身磷酸化,激活VEGF-Src及JAK-STAT等信号转导通路,导致因子非依赖性细胞增殖和抑制凋亡,进而促进白血病的发生与发展[11]。当VEGF与其细胞表面受体结合后,可导致Src的激活,进而磷酸化及激活STAT3。磷酸化后的STAT3迅速进入细胞核,由单体形成同源或异源二聚体而作为转录因子,与靶基因的启动子结合,激活转录,促进肿瘤细胞增殖及耐药形成[12]。临床研究表明STAT3的持续激活导致AML患者无疾病进展时间及总生存时间缩短[13]。此外,动物研究证实靶向抑制STAT3不仅抑制AML细胞增殖、促进凋亡,而且能够激活免疫系统,进而阻断肿瘤免疫逃逸发生[14,15]。本研究中蛋白质印迹法检测结果证实,不同浓度阿帕替尼作用MV4-11细胞后,VEGFR2、Src及STAT3磷酸化水平下降且呈浓度依赖性,提示阿帕替尼对FLT3-ITD突变AML细胞的抑制增殖和诱导凋亡作用可能与抑制该通路相关。
总之,阿帕替尼对FLT3-ITD突变AML细胞具有抑制增殖和诱导凋亡的作用,可能机制与下调VEGFR2及其下游Src和STAT3磷酸化水平相关。未来我们将在动物模型中进一步验证上述现象及机制,为临床FLT3-ITD突变AML患者靶向治疗提供更多帮助。
所有作者均声明不存在利益冲突



























