
探讨CUEDC1基因对急性单核细胞白血病THP-1细胞基因表达谱的影响。
构建CUEDC1基因干扰的THP-1细胞差异表达基因库。基于RNA测序技术比较CUEDC1基因干扰的THP-1细胞与阴性对照THP-1细胞基因表达谱的差异性表达。采用实时荧光定量聚合酶链反应验证差异表达的部分基因。将表达上调和下调的基因分别导入DAVID软件,进行基因本体(GO)功能富集分析。
成功构建CUEDC1基因干扰的THP-1细胞差异表达基因库。CUEDC1干扰组与阴性对照组间共检测到161个差异表达基因(P<0.05),其中显著上调基因85个,显著下调基因76个;与细胞增殖相关的基因9个,与细胞凋亡相关的基因10个,与p53基因有关的基因2个,与转录调控有关的基因3个,与泛素化有关的基因8个;其中SMAD5、SG15、CBLL1、FANCF等基因与急性白血病的发生发展密切相关。
CUEDC1基因可能影响SMAD5、SG15、CBLL1、FANCF等基因的表达,进而参与了急性单核细胞白血病的发生发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性单核细胞白血病为急性髓系白血病(AML)最常见的亚型之一,即AML-M5,其发病率占AML的20%~30%,与其他AML亚型相比,急性单核细胞白血病预后不佳,其高白细胞血症、髓外浸润以及不良染色体核型的发生率更高,常规化疗完全缓解率低、复发率高[1]。近年有研究发现其发生频率最高的突变是FLT3-ITD和NRAS,但是目前分子学特征尚不清楚[2]。为了进一步提高急性单核细胞白血病的疗效,迫切需要对其分子机制进一步探索。泛素偶联雌激素受体降解(CUE)家族是一类含有泛素结合结构域的蛋白分子,主要由CUEDC1和CUEDC2组成。Lopes等[3]研究证实,乳腺癌患者中CUEDC1的表达水平与乳腺癌细胞的雌激素受体α(ERα)表达水平呈正相关,CUEDC1促进乳腺癌细胞的增殖,并被视作ERα的功能性靶基因。本课题组前期应用蛋白质印迹法及实时荧光定量聚合酶链反应(RT-qPCR)检测到5种急性白血病细胞株(U937、THP-1、HEL、Jurkat、MOLT-4)中均表达CUEDC1,其中MOLT-4细胞中CUEDC1基因表达量最低,THP-1细胞CUEDC1基因表达量最高,上调CUEDC1蛋白可显著促进白血病细胞的增殖[4]。本课题组前期研究还证实了CUEDC2通过调控SOCS1的泛素化降解、调节JAK1-STAT3信号通路以及NF-κB通路的活性,参与AML干细胞的干性维持及细胞生物学行为的调控[5]。本研究拟通过RNA测序研究急性单核细胞白血病THP-1细胞以及CUEDC1基因干扰的THP-1细胞基因表达谱的变化,探讨CUEDC1基因对THP-1细胞基因表达谱的影响及其作用通路。
低温高速离心机购自德国Heraeus公司,恒温水浴加热器购自上海跃进医疗器械有限公司,倒置显微镜购自日本Olympus公司,UV-1601PC紫外分光光度计购自日本岛津公司,垂直凝胶电泳槽购自美国Bio-Rad公司,RT-qPCR仪购自美国ABI公司。慢病毒转移质粒pCDH及慢病毒包装质粒pSPAX2、被膜蛋白质粒pMD2.G均购自美国Addgene公司,菌株E.coLi DH5ct购自美国Excell公司。RPMI 1640、DMEM、IMDM培养液购自美国Gibco公司。兔抗CUEDC1多抗购自美国CST公司。DNA凝胶回收试剂盒购自上海捷瑞生物工程有限公司,总RNA提取试剂盒购自上海生物工程有限公司,Green PCR Reagents试剂盒购自瑞士Roche公司。
选择蚌埠医学院附属连云港医院实验室前期建立的干扰CUEDC1基因表达的慢病毒载体pHHsi-shCUEDC1-1、pHHsi-shCUEDC1-2和对照载体pHHsi-sh control[4],经三质粒包装系统包装后获得高滴度慢病毒颗粒。将THP-1细胞以1×105/孔接种于12孔板中,加入浓缩的慢病毒颗粒,感染复数(MOI)为100,加入聚凝胺(终质量浓度为8 μg/ml)促进病毒吸附,30 ℃、2 000×g离心30 min,感染24 h后换成正常RPMI 1640培养液继续培养24 h;48 h后将THP-1细胞分孔传代,按浓度梯度(2、3、4、6 μg/ml)加入嘌呤霉素。48 h后观察细胞生长状态及细胞荧光情况,100倍视野下拍照;根据细胞生长状态选择嘌呤霉素浓度为4 μg/ml细胞进行扩大培养。通过流式细胞术分选获得稳定表达CUEDC1基因的THP-1细胞株,选择pHHsi-shCUEDC1-1、pHHsi-shCUEDC1-2、pHHsi-sh control感染的细胞,分别设为shCUEDC1-1干扰组、shCUEDC1-2干扰组和阴性对照组;采用蛋白质印迹法验证CUEDC1蛋白表达水平。用RT-qPCR检测CUEDC1干扰组和阴性对照组CUEDC1 mRNA相对表达量,计算CUEDC1干扰组相较于阴性对照组目标基因表达的抑制率。
通过预冷的磷酸盐缓冲液对目标细胞进行冲洗,适当吸干残液后,加入0.5 ml TRIzol试剂,振荡30 s进行裂解,放置5 min;加入0.2 ml氯仿,振荡30 s,放置30 s,4 ℃、6 000×g离心10 min;吸出上层水相,转移到另一个离心管中,加入1/2体积异丙醇,适当混合均匀;放入吸附柱,通过移液器将溶液移入其中,放置2 min,高速离心3 min,倒掉其中的废液;将吸附柱放回,向其中加入75%乙醇0.5 ml,放置2 min,高速离心30 s,倒掉其中的废液;重复1次;将吸附柱放回,6 000×g离心2 min;将吸附柱放到新的离心管中,加入30 μl DEPC溶解RNA,放置5 min,6 000×g离心2 min,使用TRIzol于0 ℃提取各组细胞总RNA;2%琼脂糖凝胶电泳,检测RNA的完整性,用微量紫外分光光度计检测RNA的纯度,标本的吸光度比值要求在1.75~1.95。
由杭州联川生物有限公司提供技术服务。CUEDC1干扰组与阴性对照组各设3个复孔。总RNA经质检合格后,使用连接有Oligo(dT)的磁珠富集真核生物mRNA。经抽提的mRNA被片段化试剂(fragmentation buffer)随机打断成短片段,以片段化mRNA为模板,用六碱基随机引物合成第一链cDNA,随后加入缓冲液、dNTP、RNaseH和DNA聚合酶Ⅰ进行第二链cDNA合成。应用AMPure XP beads核酸纯化试剂盒纯化双链产物,利用T4 DNA聚合酶和Klenow DNA聚合酶将DNA的黏性末端修复为平末端,3'末端加碱基A并加接头;应用AMPureXP beads核酸纯化试剂盒进行片段选择,最后进行PCR扩增获得最终测序文库。文库质检合格后采用Illumina Hiseq4000系统进行测序,测序读取序列长为双端2×150 bp(PE150)。
对测序获得的原始数据进行预处理,采用Cutadapt软件过滤掉不合格的序列后得到有效数据,再进行下一步分析。具体处理步骤如下:(1)去除带接头(adaptor)的reads;(2)去除含有无法确定的碱基信息的比例>5%的reads;(3)去除低质量reads[质量值(Q)≤10的碱基数占整个reads的20%以上];(4)统计原始测序量、有效测序量、Q20、Q30、GC含量,并进行综合评价。
利用Hisat软件将测序数据与参考基因组比对,利用比对的结果(alignments)组装转录本;利用StringTie软件拼装得到转录本,预测基因、转录本或外显子的差异表达;对于生物学重复结果,使用R语言的Ballgown软件包对StringTie软件组装和定量完毕的基因进行差异分析(| log2倍数变化|≥1,P<0.05),采用R语言对Ballgown软件包生成的数据结果进行图形化展示,包括差异表达基因热图、散点图、火山图和主成分分析图。根据所检测基因表达谱的相近程度,将基因进行聚类分析,展示基因在CUEDC1干扰组与阴性对照组中的表达情况,由此获取生物学相关信息,采用log10(FPKM+1)进行基因表达展示。
将表达水平上调和下调的基因分别导入DAVID软件进行基因本体(GO)功能富集分析。GO共含3个本体,分别描述基因的分子功能、所处的细胞位置、参与的生物学过程。对富集性分析结果进行图形化展示,同时针对GO的功能差异表达基因丰度列表展示。
采用RT-qPCR对筛选出的表达差异最大的基因进行验证。使用Primer Premier 5.0软件设计引物,经过NCBI Blast比对引物特异性,由上海生工生物工程股份有限公司合成。引物序列见表1。分别提取CUEDC1干扰组和阴性对照组的总RNA,反转录成cDNA后进行RT-qPCR检测重复3次,反应体系为20 μl,使用Green PCR Reagents试剂盒检测,以GAPDH作为内参基因。以2-ΔΔCt计算差异表达基因mRNA相对表达量。

实时荧光定量聚合酶链反应验证CUEDC1基因干扰的急性单核细胞白血病THP-1细胞部分差异表达基因的扩增引物序列
实时荧光定量聚合酶链反应验证CUEDC1基因干扰的急性单核细胞白血病THP-1细胞部分差异表达基因的扩增引物序列
| 基因 | 正向引物 | 反向引物 |
|---|---|---|
| SMAD5 | 5'-GTAGATTCTGCTTGGGTTTGTTGTCA-3' | 5'-TGTCACTGAGGCATTCCGCATAC-3' |
| FAM32A | 5'-CCTGTTTGGCATTCCTACCTTACG-3' | 5'-CTGGACCCTCCCATTTGACTG-3' |
| FAM129A | 5'-AGTGACTGCGTCAGGCATCTCAATC-3' | 5'-AGCTCCTCCATCACCAGGTTACTC-3' |
| ZNF623 | 5'-ACCTTCACGTTTAATTCGGACCTAG-3' | 5'-AAAGCCTTTCCCACACTGATCG-3' |
| UBC | 5'-GGATTTGGGTCGCAGTTCTTGT-3' | 5'-TTCACGAAGATCTGCATTGTCAAGT-3' |
采用SPSS 23.0软件进行统计学分析。计量资料符合正态分布,以均数±标准差( ±s)表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
流式细胞术分选获得阳性细胞后经RT-qPCR检测,shCUEDC1-1干扰组、shCUEDC1-2干扰组THP-1细胞中CUEDC1 mRNA相对表达量分别为0.287 9±0.026 7、0.307 2±0.016 8,基因表达抑制效率分别为(71.67±4.86)%和(69.67±4.16)%。蛋白质印迹法检测结果显示,shCUEDC1-1干扰组、shCUEDC1-2干扰组CUEDC1蛋白水平较阴性对照组降低(图1),提示两组干扰RNA均可有效下调THP-1细胞中CUEDC1基因的表达。
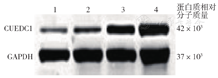

注:1为shCUEDC1-1干扰组;2为shCUEDC1-2干扰组;3为CUEDC1干扰的阴性对照组;4为未经处理的THP-1细胞组
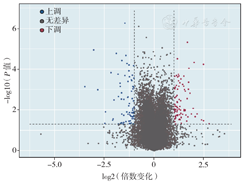
与阴性对照组相比,CUEDC1干扰组共检测到161个差异表达基因,其中显著上调基因85个,显著下调基因76个,差异表达基因表达火山图见图2。通过查询各基因的功能发现,与细胞增殖相关的基因9个(上调3个,下调6个),与细胞凋亡相关的基因10个(上调3个,下调7个),与p53基因有关的基因2个(上调、下调各1个),与转录调控有关的基因3个(上调1个,下调2个),与泛素化有关的差异表达基因8个(上调2个,下调6个)(表2)。GO功能富集分析显示,差异表达基因涉及25个生物学过程,主要集中在DNA转录调控、DNA转录模板、信号转导、蛋白受体和RNA代谢(图3)。

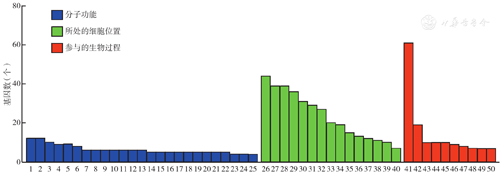

注:1为转录调控,DNA模板化;2为转录,DNA模板化;3为G蛋白偶联受体信号通路;4为信号转导;5为免疫应答;6为中性粒细胞脱颗粒;7为凋亡过程;8为炎症反应;9为氧化还原过程;10为病毒过程;11为转运;12为Ⅰ型干扰素信号通路;13为蛋白泛素化;14为对病毒的反应;15为生物学过程;16为蛋白磷酸化;17为固有免疫应答;18为RNA聚合酶Ⅱ启动子转录的正调控;19为GTPase活性正调控;20为RNA聚合酶Ⅱ启动子转录的负调控;21为蛋白均聚;22为蛋白水解;23为精子形成;24为病毒防御反应;25为干扰素γ介导的信号通路;26为细胞质;27为细胞膜;28为细胞核;29为细胞内液;30为膜的组成成分;31为质膜;32为胞外体;33为核质;34为胞外区;35为细胞间隙;36为细胞内;37为高尔基体;38为线粒体;39为内质网;40为高尔基膜;41为蛋白结合;42为金属离子结合;43为水解酶活性;44为锌离子结合;45为转移酶活性;46为DNA结合;47为核酸结合;48为转录因子活性,序列特异性DNA结合;49为G蛋白偶联受体活性;50为信号传感器活性
CUEDC1基因干扰的急性单核细胞白血病THP-1细胞涉及细胞各功能的主要差异表达基因差异表达情况
CUEDC1基因干扰的急性单核细胞白血病THP-1细胞涉及细胞各功能的主要差异表达基因差异表达情况
| 基因 | 宿主染色体 | 基因序列号 | 差异表达状态 | |
|---|---|---|---|---|
| 涉及细胞增殖功能 | ||||
| COPS9 | 2q37.3 | NC_000002.12 | 上调 | |
| ISG15 | 1p36.33 | NC_000001.11 | 上调 | |
| SIGLEC1 | 20p13 | NC_000020.11 | 上调 | |
| SMAD5 | 5q31.1 | NC_000005.10 | 下调 | |
| CBLL1 | 7q22.3 | NC_000007.14 | 下调 | |
| FGFRL1 | 4p16.3 | NC_000004.12 | 下调 | |
| DIPK2A | 3q24 | NC_000003.12 | 下调 | |
| PLIN2 | 9p22.1 | NC_000009.12 | 下调 | |
| SDCBP | 8q12.1 | NC_000008.11 | 下调 | |
| 涉及细胞凋亡功能 | ||||
| MT2A | 16q13 | NC_000016.10 | 上调 | |
| XAF1 | 17p13.2 | NC_000017.11 | 上调 | |
| IFI27 | 14q32.12 | NC_000014.9 | 上调 | |
| FAM32A | 19p13.11 | NC_000019.10 | 下调 | |
| NIBAN1 | 1q25.3 | NC_000001.11 | 下调 | |
| DNASE2 | 19p13.13 | NC_000019.10 | 下调 | |
| TAOK1 | 17q11.2 | NC_000017.11 | 下调 | |
| GRINA | 8q24.3 | NC_000008.11 | 下调 | |
| HMOX1 | 22q12.3 | NC_000022.1 | 下调 | |
| DHCR24 | 1p32.3 | NC_000001.11 | 下调 | |
| 涉及p53基因 | ||||
| COPS9 | 2q37.3 | NC_000002.12 | 上调 | |
| FAM129A | 1q25.3 | NC_000001.11 | 下调 | |
| 涉及转录调控 | ||||
| LCMT2 | 15q15.3 | NC_000015.10 | 上调 | |
| ZNF623 | 8q24.3 | NC_000008.11 | 下调 | |
| ZNF57 | 19p13.3 | NC_000019.10 | 下调 | |
| 涉及泛素化功能 | ||||
| ISG15 | 1p36.33 | NC_000001.11 | 上调 | |
| USP18 | 22q11.2 | NC_000022.11 | 上调 | |
| UBC | 12q24.3 | NC_000012.12 | 下调 | |
| CBLL1 | 7q22.3 | NC_000007.14 | 下调 | |
| UBQLN2 | Xp11.21 | NC_000023.11 | 下调 | |
| ASB13 | 10p15.1 | NC_000010.11 | 下调 | |
| PJA1 | Xq13.1 | NC_000023.11 | 下调 | |
| FANCF | 11p14.3 | NC_000011.10 | 下调 | |
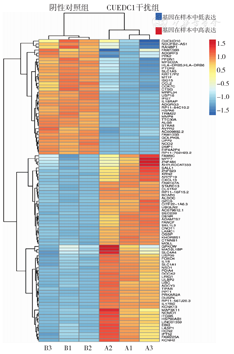
从聚类图中可见CUEDC1干扰组和阴性对照组能够完整区分开,提示两者对应基因表达的差异性较大(图4)。

RT-qPCR法检测阴性对照组和CUEDC1干扰组5个差异表达基因,包括SMAD5、FAM32A、COPS9、ZNF623、UBC,均证实两组间相应基因mRNA表达水平差异有统计学意义(均P<0.05),上调或下调趋势均与RNA测序结果一致(表3)。

实时荧光定量聚合酶链反应检测CUEDC1基因干扰及阴性对照急性单核细胞白血病THP-1细胞5个RNA测序差异表达基因的mRNA相对表达量比较( ±s)
±s)
实时荧光定量聚合酶链反应检测CUEDC1基因干扰及阴性对照急性单核细胞白血病THP-1细胞5个RNA测序差异表达基因的mRNA相对表达量比较( ±s)
±s)
| 组别 | 样本数 | SMAD5 | FAM32A | FAM129A | ZNF623 | UBC |
|---|---|---|---|---|---|---|
| CUEDC1干扰组 | 3 | 0.511±0.111 | 0.758±0.125 | 0.823±0.269 | 0.484±0.021 | 0.595±0.134 |
| 阴性对照组 | 3 | 1.211±0.244 | 1.528±0.167 | 1.278±0.152 | 1.456±0.250 | 1.151±0.939 |
| t值 | -4.521 | -6.377 | 2.546 | -6.689 | -3.393 | |
| P值 | 0.011 | 0.041 | 0.031 | 0.022 | 0.033 |
在AML的复发及耐药中,白血病干细胞(LSC)起着重要的作用[6]。本课题组前期研究结果显示,过表达CUEDC1促进MOLT-4细胞的增殖,使细胞阻滞在S期,而下调CUEDC1表达使THP-1细胞处于G0/G1期,抑制细胞增殖,提示CUEDC1可能参与LSC的干性维持和自我更新,并影响了AML(非M3型)患者的预后[4],但是CUEDC1通过影响哪些分子和通路参与了急性单核细胞白血病的发生发展至今并不明确。RNA测序技术具有简便、精准的特点,已成为识别疾病相关转录特征和确定疾病分子基础不可或缺的工具[7]。
本研究对急性单核细胞白血病细胞株THP-1以及CUEDC1干扰的THP-1细胞进行RNA测序,对检测结果进行差异分析,最终得到161个差异表达基因,采用RT-qPCR验证5个差异表达基因均证实相应基因mRNA表达水平差异有统计学意义(P<0.05),且差异表达趋势与RNA测序结果一致,证实了RNA测序结果的可靠性。
正常体细胞在向白血病细胞的转变过程中,主要涉及细胞增殖、凋亡能力的改变以及转录调控,并由此导致白血病细胞具有永生、浸润、复发等特点[8],本研究中CUEDC1基因干扰的THP-1细胞RNA测序发现与细胞增殖、凋亡以及转录调控有关的差异表达明显的基因21个,大多与白血病、实体瘤的发生以及相关分子表达相关[9,10,11],其中SMAD5是一种保护多能干细胞和恶性细胞不受骨形成蛋白(BMP)生长抑制和分化信号影响、导致肿瘤和白血病发生发展的因子[9]。
p53基因突变在许多肿瘤性疾病、白血病中都很普遍,包括AML[12]。研究发现,p53激活药物具有强大的抗AML活性,而抗肿瘤免疫进一步增强了这种活性[13]。本研究中,CUEDC1基因干扰的THP-1细胞RNA测序得到两个与p53相关的差异表达基因,分别是显著上调的COPS9和显著下调的FAM129A,其中FAM129A经过PCR验证,与RNA测序结果一致。FAM129A与甲状腺癌的发生发展密切相关,并可作为甲状腺癌的分子标志[14,15,16],我们未检索到FAM129A及COPS9与白血病相关的报道,本团队将进一步验证其在白血病发生发展中的作用。泛素介导的蛋白酶体降解对AML关键基因的表达发挥重要作用[17]。CUEDC1为一种CUE结构域的包含蛋白,本研究中CUEDC1基因干扰的THP-1细胞经RNA测序检测到8个与泛素化显著相关的基因,显著上调的基因2个(ISG15、USP18),显著下调的基因6个(UBC、CBLL1、UBQLN2、ASB13、PJA1、FANCF),其中ISG15、CBLL1、FANCF与急性白血病的发生发展密切相关[18,19,20],USP18、UBQLN2等与乳腺癌、尿路上皮癌、骨肉瘤、肺癌等肿瘤性疾病的发生发展密切相关[18,21,22,23]。
在后续的研究中,我们将着重从两方面进一步研究差异表达基因表达库:(1)从基因涉及白血病/肿瘤的重要生物学行为方面筛选差异表达基因(如p53基因等在血液系统肿瘤中有重要预后意义的分子标志[24]);(2)挑选差异表达上调或下调显著的基因进行研究。本课题组将以这些基因作为切入点,分别从细胞功能、蛋白表达以及作用通路等方面研究基因功能,深入探讨CUEDC1对于THP-1细胞基因表达谱以及作用通路的影响,进一步探索其在急性单核细胞白血病发生发展中的作用。
所有作者均声明不存在利益冲突



























