
探讨急性T淋巴细胞白血病患者的近期疗效、预后及预后相关因素。
回顾性分析2013年1月至2018年12月上海交通大学医学院附属瑞金医院北部院区收治的23例初发急性T淋巴细胞白血病患者临床资料,并结合文献对其临床特征、治疗及转归进行总结。
23例患者中,男性14例,女性9例,中位年龄32岁(14~58岁)。诱导治疗采用标准VDPCP方案,总有效率为60.9%(14/23),完全缓解率为47.8%(11/23),部分缓解率为13.0%(3/23);中位无进展生存时间为11.5个月(0~66.0个月),中位总生存时间为15.4个月(2.0~66.0个月)。与诱导缓解相关的可评价预后因素包括年龄、初发时白细胞计数、NOTCH1基因突变、染色体核型及疾病特殊类型,但差异均无统计学意义(均P>0.05)。
急性T淋巴细胞白血病患者预后较差,初次诱导缓解率低,无进展生存时间和总生存时间短。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性T淋巴细胞白血病(T-ALL)约占急性淋巴细胞白血病的25%,总体发病率不高。治疗上采用与B淋巴细胞白血病相同的化疗方案,然而年轻的成年患者疾病诱导缓解率低[1],长期生存不理想。疾病复发者长期生存率低于10%[2]。本研究旨在探讨T-ALL患者的近期疗效、预后及预后相关因素。
回顾性分析2013年1月至2018年12月我院23例初发T-ALL患者资料,其中男性14例,女性9例;中位年龄32岁(14~58岁);染色体核型异常7例。仅存在NOTCH1基因突变7例,仅存在HOX11基因突变1例,同时存在2个基因突变7例。早前T淋巴细胞白血病(ETP-ALL)8例,皮质T淋巴细胞白血病4例,前T淋巴细胞白血病7例,成熟T淋巴细胞白血病3例,早前T淋巴细胞+皮质T淋巴细胞白血病1例。初发时高白细胞(白细胞计数>50×109/L)7例。23例患者基本临床资料见表1。
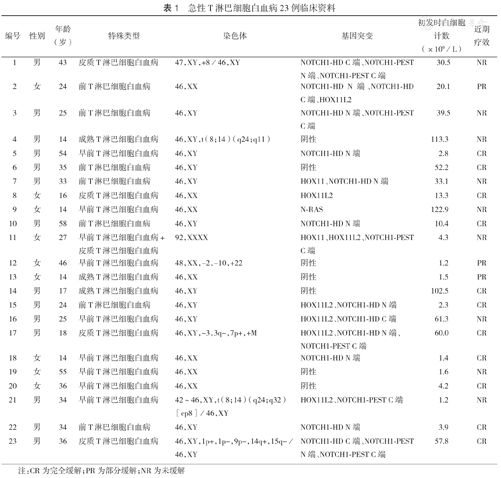
急性T淋巴细胞白血病23例临床资料
急性T淋巴细胞白血病23例临床资料
| 编号 | 性别 | 年龄(岁) | 特殊类型 | 染色体 | 基因突变 | 初发时白细胞计数(×109/L) | 近期疗效 |
|---|---|---|---|---|---|---|---|
| 1 | 男 | 43 | 皮质T淋巴细胞白血病 | 47,XY,+8/46,XY | NOTCH1-HD C端、NOTCH1-PEST N端、NOTCH1-PEST C端 | 30.5 | NR |
| 2 | 女 | 24 | 前T淋巴细胞白血病 | 46,XX | NOTCH1 - HD N端、NOTCH1 - HD C端、HOX11L2 | 20.1 | PR |
| 3 | 男 | 25 | 前T淋巴细胞白血病 | 46,XY | NOTCH1-HD N端、NOTCH1-PEST C端阴性 | 39.5 | NR |
| 4 | 男 | 14 | 成熟T淋巴细胞白血病 | 46,XY,t(8;14)(q24;q11) | 113.3 | NR | |
| 5 | 男 | 54 | 早前T淋巴细胞白血病 | 46,XY | NOTCH1-HD N端 | 2.8 | CR |
| 6 | 男 | 35 | 前T淋巴细胞白血病 | 46,XY | 阴性 | 52.2 | CR |
| 7 | 男 | 33 | 前T淋巴细胞白血病 | 46,XY | HOX11、NOTCH1-HD N端 | 33.1 | NR |
| 8 | 女 | 16 | 皮质T淋巴细胞白血病 | 46,XX | HOX11L2 | 13.3 | CR |
| 9 | 女 | 14 | 早前T淋巴细胞白血病 | 46,XX | N-RAS | 122.9 | NR |
| 10 | 男 | 58 | 前T淋巴细胞白血病 | 46,XY | NOTCH1-HD N端 | 10.4 | CR |
| 11 | 女 | 27 | 早前T淋巴细胞白血病+皮质T淋巴细胞白血病 | 92,XXXX | HOX11、HOX11L2、NOTCH1-PEST C端 | 4.3 | NR |
| 12 | 女 | 46 | 早前T淋巴细胞白血病 | 48,XX,-2,-10,+22 | 阴性 | 1.2 | PR |
| 13 | 女 | 14 | 成熟T淋巴细胞白血病 | 46,XX | 阴性 | 1.5 | PR |
| 14 | 男 | 17 | 成熟T淋巴细胞白血病 | 46,XY | 阴性 | 102.5 | CR |
| 15 | 男 | 24 | 前T淋巴细胞白血病 | 46,XY | HOX11L2、NOTCH1-HD N端 | 2.3 | CR |
| 16 | 男 | 25 | 早前T淋巴细胞白血病 | 46,XY | HOX11L2、NOTCH1-HD C端 | 61.3 | NR |
| 17 | 男 | 18 | 皮质T淋巴细胞白血病 | 46,XY,-3,3q-,7p+,+M | HOX11L2、NOTCH1-HD N端、NOTCH1-PEST C端 | 60.0 | CR |
| 18 | 女 | 14 | 早前T淋巴细胞白血病 | 46,XX | NOTCH1-HD N端 | 1.4 | CR |
| 19 | 女 | 55 | 早前T淋巴细胞白血病 | 46,XX | 阴性 | 1.6 | NR |
| 20 | 女 | 36 | 早前T淋巴细胞白血病 | 46,XX | 阴性 | 4.2 | CR |
| 21 | 男 | 34 | 早前T淋巴细胞白血病 | 42~46,XY,t(8;14)(q24;q32)[cp8]/46,XY | HOX11L2、NOTCH1-PEST C端 | 1.2 | NR |
| 22 | 男 | 34 | 前T淋巴细胞白血病 | 46,XY | NOTCH1-HD N端 | 3.9 | CR |
| 23 | 男 | 36 | 皮质T淋巴细胞白血病 | 46,XY,1p+,1p-,9p-,14q+,15q-/46,XY | NOTCH1-HD C端、NOTCH1-PEST N端、NOTCH1-PEST C端 | 57.8 | CR |
注:CR为完全缓解;PR为部分缓解;NR为未缓解
诱导治疗均采用VDPCP方案:长春地辛4 mg,第1、8、15、22天;柔红霉素45 mg/m2,第1天至第3天;培门冬酶3 750 U,第8天;环磷酰胺750 mg/m2,第1天;泼尼松1 mg/kg,第1天至第14天;后逐渐减量至停用。
疗效依据中国成年人急性淋巴细胞白血病诊断与治疗指南(2016年版)进行评价[3],分为完全缓解(CR)、部分缓解(PR)、未缓解(NR),以CR+PR为总有效。无进展生存(PFS)时间定义为患者起病至疾病复发、进展、死亡或末次随访的时间,总生存(OS)时间定义为患者起病至死亡或末次随访的时间。不良反应依据美国国立癌症研究所(NCI)不良事件常用术语评定标准进行评价。
采用SPSS 16.0软件进行统计学分析,多因素分析采用logistic回归分析法,P<0.05为差异有统计学意义。
23例患者中,11例(47.8%)CR,3例(13.0%)PR,9例(39.1%)NR,总有效率为60.9%(14/23),患者具体疗效见表1。随访时间2~66个月,中位无进展生存时间为11.5个月(0~66.0个月),中位总生存时间为15.4个月(2.0~66.0个月)。与诱导缓解相关的可评价预后因素包括年龄、初发时白细胞计数、NOTCH1基因突变、染色体核型及疾病特殊类型。logistic回归分析结果提示上述因素均与诱导缓解无相关性(均P>0.05)。
23例患者化疗过程中均出现3~4级骨髓抑制,中位最低白细胞绝对计数为1.45×109/L(0.71×109/L~2.55×109/L),中位最低血小板计数为13.6×109/L(4×109/L~20×109/L),多出现在治疗后第9天至第11天。骨髓抑制期间10例患者出现发热,其中4例发生重症肺炎,经积极抗感染治疗后均好转。另有1例患者发生脑梗死,经中性治疗(未采用脑梗死的常用治疗方法,仅在发生颅内压升高时予降颅压等对症处理)后好转,无后遗症。23例患者均有轻度非造血系统不良反应,主要表现为恶心、口腔溃疡、便秘等,经对症处理后症状或体征消失。无一例患者出现严重心、肝、肾功能受损。
T-ALL总体发病率不高,年轻成年患者初次诱导缓解率低,复发率高,长期生存预后差[1]。可能影响急性淋巴细胞白血病预后的因素包括特殊类型的T淋巴细胞白血病(如ETP-ALL)、细胞遗传学分析、培门冬酶应用、治疗后微小残留病数值等[4,5,6,7,8,9,10]。
ETP-ALL因基因表达谱及免疫表型的不同而被独立列出[4],其细胞由部分未成熟的胸腺细胞演化而来[11],保留了同时向T系及髓系分化的特性,具有更低的诱导缓解率,更高的复发率,更差的长期生存。然而,UKALL2003研究显示按照当前的治疗方案,年轻的成年人ETP-ALL仅划为中危组[12]。研究表明ETP-ALL依赖异常的JAK-STAT信号通路[13],HOXA的表达与其预后相关[14]。
细胞遗传学分析在急性B淋巴细胞白血病(B-ALL)的诊断与治疗中尤为重要,T-ALL的细胞遗传学分析却相对并不影响其治疗策略的制订[2]。至少60%的T-ALL患者存在NOTCH1突变[15],多数研究认为这一基因突变提示更好的治疗反应和长期生存[16,17]。部分研究显示存在PTEN及NK-RAS突变预示着更差的长期生存[18],但UKALL2003研究并未得出这一结论[19]。对于细胞遗传学分析在T-ALL中的应用价值尚需大样本的临床研究予以佐证。
根据美国国立综合癌症网络(NCCN)指南,T-ALL的诱导治疗以VDCLP方案为主。研究显示培门冬酶的应用明显提高了诱导缓解率及长期生存[7,8],美国Dana-Farber癌症研究所数据提示强化培门冬酶方案可以使T-ALL患者的3年总生存率达到75%[8]。
微小残留病监测在T-ALL治疗过程中极为重要,研究显示2个疗程化疗结束后微小残留病的数值越低,患者的预后越好[20]。本研究提示年龄、初发时白细胞计数、NOTCH1基因突变、染色体核型及疾病特殊类型等因素均与诱导缓解无相关性,与国外相关研究存在差异。此类差异可能与本研究病例数少有关,且本中心收治的患者以早前及前T细胞白血病为主,故而总体反应率及CR率亦不甚理想。同时本研究中涉及病例年龄除4例患者外均<44岁,可能存在偏倚。事实上,即便不存在上述预后不良因素,T-ALL患者临床结局依然不理想。异基因造血干细胞移植后仍存在25%的复发率[6],而自体造血干细胞移植疗效并不优于化疗组[21]。奈拉滨作为复发难治儿童T-ALL患者唯一批准的新药,在成年人T-ALL中也显示出不错的单药疗效,反应率约41%,1年总生存率约28%[22]。γ分泌酶抑制剂作用于NOTCH1信号通路,适用于60%的T-ALL患者,Ⅰ期临床试验结果显示25例复发患者中8例获得了疗效[23]。dNUP214-ABL1融合基因存在于6%的成年人T-ALL当中,伊马替尼对此类患者可能有效,提供了新的治疗思路[24]。30%的T-ALL患者存在JAK-STAT信号通路的激活[13],芦可替尼对于这类患者也是不错的选择。其他如抗CD30单抗、嵌合抗原受体T细胞治疗等均可用于复发难治T-ALL患者。
所有作者均声明不存在利益冲突



























