
探讨ALK+间变性大细胞淋巴瘤(ALCL)预后相关因素,建立一种治疗前预测其总生存(OS)的临床预后模型。
选取监测、流行病学和最终结果(SEER)数据库(涵盖18个登记处)中2004年1月至2015年12月诊断为ALK+ ALCL的1 602例患者,按简单随机法分成训练组(1 122例,用于模型的构建和内部验证)和验证组(480例,用于外部验证)。应用Cox比例风险模型对OS进行单因素、多因素分析,选取独立预后因素建立ALK+ ALCL 3年、5年的OS列线图。应用受试者工作特征(ROC)曲线、一致性指数(C指数)和校准曲线评估模型的区分度和校准度。与Ann Arbor分期进行对比,使用净重新分类指数(NRI)、综合判别改善指数(IDI)和决策曲线分析(DCA)对建立的模型准确性和效益进行评估。
多因素Cox比例风险模型分析结果显示,年龄、性别、全身症状、Ann Arbor分期、原发部位是ALK+ ALCL患者OS的独立影响因素,并据此建立预测OS的列线图。与Ann Arbor分期相比,C指数(训练组:0.726比0.597,验证组:0.777比0.639)、ROC曲线下面积(AUC)(训练组3年OS率AUC:0.758比0.620,5年OS率AUC:0.761比0.614;验证组3年OS率AUC:0.819比0.672,5年OS率AUC:0.832比0.656)、校准曲线均提示所建模型具有较好的预测能力;在验证组中,3年、5年OS率的NRI分别为0.866(95%CI 0.683~1.079)、0.922(95% CI 0.760~1.099),IDI分别为0.219和0.233(均P<0.01)。构建的OS预测模型3年、5年DCA比Ann Arbor分期有更大的临床净收益。
成功建立了ALK+ ALCL的OS预测模型,可个体化预测生存结果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
ALK+间变性大细胞淋巴瘤(ALCL)是一种具有较强侵袭性的外周T细胞淋巴瘤(PTCL),常涉及2p23位点ALK基因易位,导致ALK蛋白高表达,并伴CD30抗原强表达[1]。ALK+ ALCL患者发病年龄多低于30岁,以男性多见,占成年人非霍奇金淋巴瘤的约3%和儿童淋巴瘤的10%~15%,通常为晚期疾病(Ⅲ、Ⅳ期),常伴有全身症状,如B症状(不能解释的发热,体温高于38 ℃,在过去1个月内反复夜间盗汗,半年内体质量降低大于10%)、皮肤瘙痒等,多有结外受累(20%~68%)[2,3]。ALK+ ALCL对化疗敏感,采用以蒽环类药物为基础的化疗方案治疗时,5年总生存(OS)率在70%以上,但仍有30%的患者复发[4,5,6,7]。目前应用于ALCL的预后评价方法主要有国际预后指数(IPI)和非特指型外周T细胞淋巴瘤预后指数(PIT)[7,8]。IPI主要用于B细胞淋巴瘤的预后分层,而且ALK+ ALCL比其他PTCL预后好[6,9,10],故有必要建立针对ALK+ ALCL的临床预后模型。列线图是一种方便、可靠的预后预测工具,其将重要的预后因素数字化,用概率来说明预后结果[11]。本研究利用监测、流行病学和最终结果(SEER)数据库中的ALK+ ALCL数据,对生存资料进行回顾性分析,明确影响ALK+ ALCL预后的重要因素,并构建OS的预测模型。
使用最新的SEER*Stat8.3.6软件(www.seer.cancer.gov)从SEER数据库(涵盖18个登记处)中筛选2004年1月至2015年12月确诊为ALK+ ALCL(第3版组织学编码:9714/3)患者共2 162例,研究因素包括性别、年龄、全身症状、原发部位、Ann Arbor分期、随访时间、随访状态、生存状态、生存时间、种族、手术、放疗、化疗。排除以上因素信息不完整及非第一原发肿瘤的患者,最终确定1 602例符合标准患者进入本研究。SEER数据库中的以上所有数据均可免费获取,不涉及患者个人隐私。
为了准确评估年龄因素,避免任意年龄分组造成偏倚结果,采用X-tile软件获取初诊年龄最佳的两个截断值[12]。考虑儿童ALK+ ALCL在发病率、治疗方案选择、预后等方面与成年人ALK+ ALCL存在差异[13],所以加入18岁作为另一个截断值。
为了构建ALK+ ALCL临床预后预测模型,将1 602例患者按简单随机法以7∶3比例分成训练组(1 122例)和验证组(480例),训练组用于模型的构建和内部验证,验证组用于外部验证。采用Cox比例风险模型对训练组潜在的预后因素进行单因素、多因素分析,以确定影响患者OS[确诊至任何原因死亡或末次随访时(2016年12月)]的独立影响因素,并构建预测3年、5年OS率列线图。对列线图进行内部和外部验证:使用一致性指数(C指数)和受试者工作特征(ROC)曲线下面积(AUC)评估模型的预测准确性,校准曲线用Hosmer-Lemeshow检验比较实际概率和预测概率之间的拟合度(Bootstrap自抽样法重复1 000次),并分别基于训练组和验证组进行综合评估;使用净重新分类指数(NRI)和综合判别改善指数(IDI)比较模型和Ann Arbor分期的预测准确性[14],应用决策曲线分析(DCA)法比较建立的模型和Ann Arbor分期的临床净收益[15,16]。
采用X-tile3.6.1软件,通过寻找最大χ2值对应的截断值进行年龄分组,绘制Kaplan-Meier生存曲线,采用log-rank检验进行比较;其余统计学分析采用SPSS 25.0软件和R 3.6.1软件。计数资料组间比较采用χ2检验或Fisher确切概率法;计量资料非正态分布,用中位数(P25,P75)表示,组间比较采用Mann-Whitney检验;采用Cox比例风险回归模型进行单因素及多因素生存分析,并计算出每个因素的风险比(HR)和95%可信区间(95%CI)。以P<0.05(双侧)为差异有统计学意义。
纳入本研究的1 602例患者及分成的训练组和验证组的人口基线特征见表1。全组患者中位年龄为49岁(28岁,64岁),主要集中在38~73岁、男性和白色人种,患者多表现为原发结内病变和晚期(Ⅲ~Ⅳ期)病变(865例,54.0%),47.5%患者存在全身症状(B症状或皮肤瘙痒)。在治疗方面,79.5%患者接受化疗,18.4%接受放疗,33.9%接受肿瘤直接相关手术治疗;在治疗方案选择方面,大部分进行化疗,部分接受术后化疗或者联合放化疗,10.2%未接受任何治疗。使用X-tile软件截取两个最佳截断值为37、73岁,按初诊年龄分组为:≤18岁225例,>18岁且≤37岁335例,>37岁且≤73岁852例,>73岁190例。
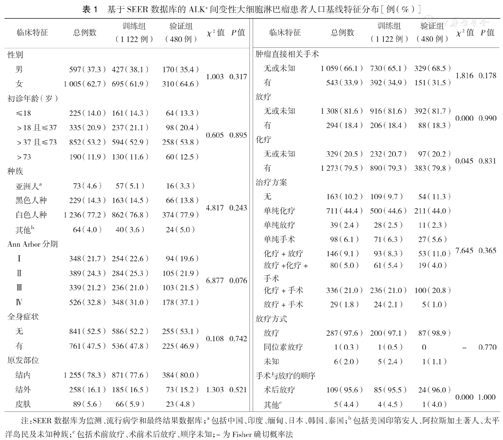
基于SEER数据库的ALK+间变性大细胞淋巴瘤患者人口基线特征分布[例(%)]
基于SEER数据库的ALK+间变性大细胞淋巴瘤患者人口基线特征分布[例(%)]
| 临床特征 | 总例数 | 训练组(1 122例) | 验证组(480例) | χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 性别 | ||||||
| 男 | 597(37.3) | 427(38.1) | 170(35.4) | 1.003 | 0.317 | |
| 女 | 1 005(62.7) | 695(61.9) | 310(64.6) | |||
| 初诊年龄(岁) | ||||||
| ≤18 | 225(14.0) | 161(14.3) | 64(13.3) | 0.605 | 0.895 | |
| >18且≤37 | 335(20.9) | 237(21.1) | 98(20.4) | |||
| >37且≤73 | 852(53.2) | 594(52.9) | 258(53.8) | |||
| >73 | 190(11.9) | 130(11.6) | 60(12.5) | |||
| 种族 | ||||||
| 亚洲人a | 73(4.6) | 57(5.1) | 16(3.3) | 4.817 | 0.243 | |
| 黑色人种 | 229(14.3) | 163(14.5) | 66(13.8) | |||
| 白色人种 | 1 236(77.2) | 862(76.8) | 374(77.9) | |||
| 其他b | 64(4.0) | 40(3.6) | 24(5.0) | |||
| Ann Arbor分期 | ||||||
| Ⅰ | 348(21.7) | 254(22.6) | 94(19.6) | 6.877 | 0.076 | |
| Ⅱ | 389(24.3) | 284(25.3) | 105(21.9) | |||
| Ⅲ | 339(21.2) | 236(21.0) | 103(21.5) | |||
| Ⅳ | 526(32.8) | 348(31.0) | 178(37.1) | |||
| 全身症状 | ||||||
| 无 | 841(52.5) | 586(52.2) | 255(53.1) | 0.108 | 0.742 | |
| 有 | 761(47.5) | 536(47.8) | 225(46.9) | |||
| 原发部位 | ||||||
| 结内 | 1 255(78.3) | 871(77.6) | 384(80.0) | 1.303 | 0.521 | |
| 结外 | 258(16.1) | 185(16.5) | 73(15.2) | |||
| 皮肤 | 89(5.6) | 66(5.9) | 23(4.8) | |||
| 肿瘤直接相关手术 | ||||||
| 无或未知 | 1 059(66.1) | 730(65.1) | 329(68.5) | 1.816 | 0.178 | |
| 有 | 543(33.9) | 392(34.9) | 151(31.5) | |||
| 放疗 | ||||||
| 无或未知 | 1 308(81.6) | 916(81.6) | 392(81.7) | 0.000 | 0.990 | |
| 有 | 294(18.4) | 206(18.4) | 88(18.3) | |||
| 化疗 | ||||||
| 无或未知 | 329(20.5) | 232(20.7) | 97(20.2) | 0.045 | 0.831 | |
| 有 | 1 273(79.5) | 890(79.3) | 383(79.8) | |||
| 治疗方案 | ||||||
| 无 | 163(10.2) | 109(9.7) | 54(11.3) | 7.645 | 0.365 | |
| 单纯化疗 | 711(44.4) | 500(44.6) | 211(44.0) | |||
| 单纯放疗 | 39(2.4) | 28(2.5) | 11(2.3) | |||
| 单纯手术 | 98(6.1) | 71(6.3) | 27(5.6) | |||
| 化疗+放疗 | 146(9.1) | 93(8.3) | 53(11.0) | |||
| 放疗+化疗+手术 | 80(5.0) | 61(5.4) | 19(4.0) | |||
| 化疗+手术 | 336(21.0) | 236(21.0) | 100(20.8) | |||
| 放疗+手术 | 29(1.8) | 24(2.1) | 5(1.0) | |||
| 放疗方式 | ||||||
| 放疗 | 287(97.6) | 200(97.1) | 87(98.9) | - | 0.770 | |
| 同位素放疗 | 1(0.3) | 1(0.5) | 0 | |||
| 未知 | 6(2.0) | 5(2.4) | 1(1.1) | |||
| 手术与放疗的顺序 | ||||||
| 术后放疗 | 109(95.6) | 85(95.5) | 24(96.0) | 0.000 | 1.000 | |
| 其他c | 5(4.4) | 4(4.5) | 1(4.0) | |||
注:SEER数据库为监测、流行病学和最终结果数据库;a包括中国、印度、缅甸、日本、韩国、泰国;b包括美国印第安人、阿拉斯加土著人、太平洋岛民及未知种族;c包括术前放疗、术前术后放疗、顺序未知;-为Fisher确切概率法
全组中位随访35个月(7个月,82个月),训练组和验证组中位随访时间分别为35.5个月(7个月,83个月)、34.5个月(6个月,78个月)。全组中位OS时间未达到,5年OS率为60.9%(95% CI 58.5%~63.4%)。Cox比例风险模型分析显示,接受治疗的训练组患者OS比未接受治疗患者好,其中放疗+化疗+手术组患者OS最佳(P<0.01)(表2、表3)。Kaplan-Meier生存分析显示,单纯化疗、化疗+放疗、放疗+化疗+手术、化疗+手术4种治疗方案间OS差异有统计学意义(P=0.040)(图1),放疗+化疗+手术组与单纯化疗组间OS差异有统计学意义(P=0.016);化疗+手术或化疗+放疗组与单纯化疗组间OS差异均无统计学意义(均P>0.05)。Kaplan-Meier生存分析显示,≤18岁组患者OS最佳,年龄越大,OS越差(P<0.01)(图2)。
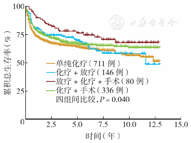

注:SEER数据库为监测、流行病学和最终结果数据库
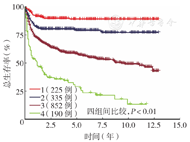

注:SEER数据库为监测、流行病学和最终结果数据库;1为≤18岁;2为>18岁且≤37岁;3为>37岁且≤73岁;4为>73岁
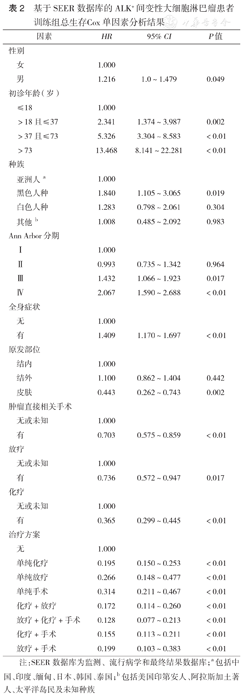
基于SEER数据库的ALK+间变性大细胞淋巴瘤患者训练组总生存Cox单因素分析结果
基于SEER数据库的ALK+间变性大细胞淋巴瘤患者训练组总生存Cox单因素分析结果
| 因素 | HR | 95% CI | P值 | |
|---|---|---|---|---|
| 性别 | ||||
| 女 | 1.000 | |||
| 男 | 1.216 | 1.0~1.479 | 0.049 | |
| 初诊年龄(岁) | ||||
| ≤18 | 1.000 | |||
| >18且≤37 | 2.341 | 1.374~3.987 | 0.002 | |
| >37且≤73 | 5.326 | 3.304~8.583 | <0.01 | |
| >73 | 13.468 | 8.141~22.281 | <0.01 | |
| 种族 | ||||
| 亚洲人a | 1.000 | |||
| 黑色人种 | 1.840 | 1.105~3.065 | 0.019 | |
| 白色人种 | 1.283 | 0.798~2.061 | 0.304 | |
| 其他b | 1.008 | 0.485~2.092 | 0.983 | |
| Ann Arbor分期 | ||||
| Ⅰ | 1.000 | |||
| Ⅱ | 0.993 | 0.735~1.342 | 0.964 | |
| Ⅲ | 1.432 | 1.066~1.923 | 0.017 | |
| Ⅳ | 2.067 | 1.590~2.688 | <0.01 | |
| 全身症状 | ||||
| 无 | 1.000 | |||
| 有 | 1.409 | 1.170~1.697 | <0.01 | |
| 原发部位 | ||||
| 结内 | 1.000 | |||
| 结外 | 1.100 | 0.862~1.404 | 0.442 | |
| 皮肤 | 0.443 | 0.262~0.743 | 0.002 | |
| 肿瘤直接相关手术 | ||||
| 无或未知 | 1.000 | |||
| 有 | 0.703 | 0.575~0.859 | <0.01 | |
| 放疗 | ||||
| 无或未知 | 1.000 | |||
| 有 | 0.736 | 0.572~0.947 | 0.017 | |
| 化疗 | ||||
| 无或未知 | 1.000 | |||
| 有 | 0.365 | 0.299~0.445 | <0.01 | |
| 治疗方案 | ||||
| 无 | 1.000 | |||
| 单纯化疗 | 0.195 | 0.150~0.253 | <0.01 | |
| 单纯放疗 | 0.266 | 0.148~0.477 | <0.01 | |
| 单纯手术 | 0.314 | 0.211~0.467 | <0.01 | |
| 化疗+放疗 | 0.172 | 0.114~0.260 | <0.01 | |
| 放疗+化疗+手术 | 0.128 | 0.077~0.213 | <0.01 | |
| 化疗+手术 | 0.155 | 0.113~0.211 | <0.01 | |
| 放疗+手术 | 0.199 | 0.103~0.383 | <0.01 | |
注:SEER数据库为监测、流行病学和最终结果数据库;a包括中国、印度、缅甸、日本、韩国、泰国;b包括美国印第安人、阿拉斯加土著人、太平洋岛民及未知种族
基于SEER数据库的ALK+间变性大细胞淋巴瘤患者训练组总生存Cox多因素分析结果
基于SEER数据库的ALK+间变性大细胞淋巴瘤患者训练组总生存Cox多因素分析结果
| 因素 | HR | 95% CI | P值 | |
|---|---|---|---|---|
| 性别 | ||||
| 女 | 1.000 | |||
| 男 | 1.243 | 1.021~1.516 | 0.031 | |
| 初诊年龄(岁) | ||||
| ≤18 | 1.000 | |||
| >18且≤37 | 2.400 | 1.406~4.097 | 0.001 | |
| >37且≤73 | 5.821 | 3.600~9.414 | <0.01 | |
| >73 | 18.276 | 10.960~30.475 | <0.01 | |
| 种族 | ||||
| 亚洲人a | 1.000 | |||
| 黑色人种 | 1.420 | 0.850~2.372 | 0.181 | |
| 白色人种 | 0.920 | 0.570~1.484 | 0.732 | |
| 其他b | 0.857 | 0.412~1.783 | 0.680 | |
| Ann Arbor分期 | ||||
| Ⅰ | 1.000 | |||
| Ⅱ | 1.208 | 0.887~1.645 | 0.230 | |
| Ⅲ | 1.507 | 1.099~2.067 | 0.011 | |
| Ⅳ | 2.234 | 1.685~2.962 | <0.01 | |
| 全身症状 | ||||
| 无 | 1.000 | |||
| 有 | 1.312 | 1.072~1.605 | 0.008 | |
| 原发部位 | ||||
| 结内 | 1.000 | |||
| 结外 | 1.144 | 0.892~1.467 | 0.288 | |
| 皮肤 | 0.545 | 0.318~0.933 | 0.027 | |
注:SEER数据库为监测、流行病学和最终结果数据库;a包括中国、印度、缅甸、日本、韩国、泰国;b包括美国印第安人、阿拉斯加土著人、太平洋岛民及未知种族
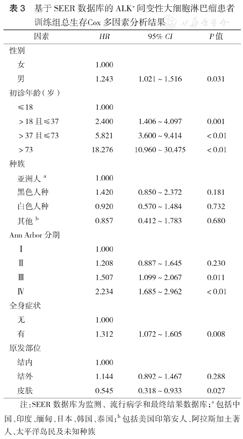
本研究构建的模型用于治疗前的OS预测,故未将治疗因素纳入模型构建。基于Cox比例风险模型多因素分析结果,在训练组中确定了5个与OS相关的因素,分别为初诊年龄、性别、Ann Arbor分期、全身症状、原发部位,据此建立的OS列线图见图3。其中年龄对OS的影响最大,之后依次为Ann Arbor分期、原发部位、全身症状、性别。每个因素的每个分级在列线图上分值:年龄≤18岁为0分,>18岁且≤37岁为30分,>37岁且≤73岁为61分,73岁为100分;Ann Arbor分期Ⅰ期为0分,Ⅱ期为6分,Ⅲ期为14分,Ⅳ期为29分;原发部位在皮肤为0分,结内为22分,结外为27分;无全身症状为0分,有全身症状为10分;女性为0分,男性为7分。将每个因素的级别分值相加,依据总分对应的OS概率便可预测患者3年、5年OS率。
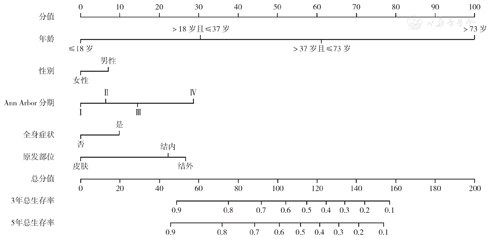

与Ann Arbor分期相比,构建的预测模型的C指数(训练组:0.726比0.597,验证组:0.777比0.639)、ROC曲线的AUC(训练组3年OS率AUC:0.758比0.620,5年OS率AUC:0.761比0.614;验证组3年OS率AUC:0.819比0.672,5年OS率AUC:0.832比0.656)均好。训练组和验证组的3年、5年OS率模型的校准曲线均显示实际结果和模型预测结果相近,即3个计算点连线均接近对角线(图4)。在验证组中,3年、5年OS率的NRI分别为0.866(95%CI 0.683~1.079)、0.922(95%CI 0.760~1.099),IDI分别为0.219和0.233(均P<0.01),表明构建的模型预测OS的准确性比Ann Arbor分期高。DCA法分析显示,在验证组中,与Ann Arbor分期比较,预测模型对3年、5年OS率可获得更大的临床净收益(图5)。
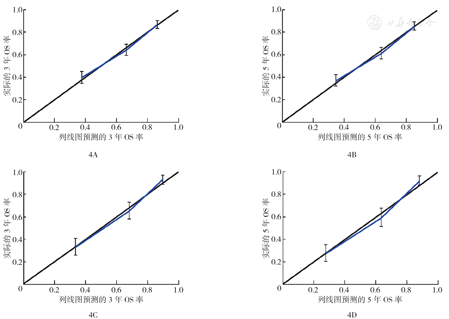

注:SEER数据库为监测、流行病学和最终结果数据库;OS为总生存
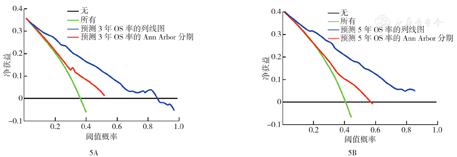

注:SEER数据库为监测、流行病学和最终结果数据库;OS为总生存
在我们的研究队列中,ALK+ ALCL患者中位年龄为49岁,比之前的研究数据(中位年龄34~41岁)稍高[7,17],年龄分组主要集中在38~73岁(53.2%),而5年OS率为60.9%,比相关文献报道(70%)稍低[18],这可能与本研究患者年龄偏大有关。此外,本研究中男性患者发病率较高,常伴有全身症状,确诊时多为晚期病变,与多个文献报道结果相近[17,19,20]。本研究中原发结内病变率低于已知的研究(结内侵犯率90%以上)[17,19,20,21],可能与部分患者结内、结外病变并存、原发部位难以确定相关。
原发皮肤ALCL通常缺乏上皮膜抗原(EMA)和ALK蛋白表达,且通常不存在t(2;5),这是区别于结内ALK+ ALCL的特征,如这些特征都存在,需高度怀疑该病变是潜在的系统性ALCL的皮肤表现[22],故本研究未将原发病灶为皮肤的病例剔除。在本研究中,超过3/4患者接受化疗。化疗是治疗淋巴瘤最常用的方法,以蒽环类药物为基础的化疗方案的5年OS率在70%以上[10,17,18,23,24]。目前针对系统性ALK+ALCL,美国国立综合癌症网络(NCCN)指南(2020.V1)[25]推荐的治疗方案为CHP+BV(环磷酰胺、多柔比星、泼尼松、布妥昔单抗)方案,一项Ⅲ期全球性、双盲、随机对照临床试验结果表明,CHP+BV方案治疗CD30+ PTCL不论在无进展生存(PFS)、OS方面,还是安全性方面,均明显优于传统CHOP方案[20]。本研究中,仅接受化疗组与化疗结合放疗组间OS差异无统计学意义,这与多项文献报道结果一致[26,27],目前对于全身化疗联合放疗的疗效是有争议的,对于年老不能耐受多疗程化疗的患者,简化化疗结合局部姑息放疗或者联合靶向治疗可能是合理的选择[10,17,18,23,24]。另外,本研究中,手术联合放化疗的OS略优于仅接受化疗者,这可能与手术的部位、肿块大小、分期、并发症急症处理等潜在因素相关。手术不是治疗淋巴瘤常规的治疗手段,需综合考虑方可执行。
在本研究基于多因素Cox分析结果构建的OS列线图中,年龄对预后的影响最大,≤18岁患者预后最好,随着年龄增加,预后越差。有研究表明,ALK+只有在40岁以下的年轻ALCL患者中才是一个预后良好的独立因素,而在40岁及以上的人群中,ALK+预后与ALK-间差异无统计学意义[7]。其次,OS列线图中Ann Arbor分期亦是影响预后的重要因素,晚期(Ⅲ、Ⅳ期)患者预后较差,这可能与肿瘤全身播散、肿瘤负荷大相关[10],目前NCCN指南(2020.V1)是根据Ann Arbor分期为ALK+ ALCL患者选择合适的治疗方案。此外,全身症状的出现会增加患者的死亡风险,这与国内一项回顾性研究结果一致[28]。本研究男女比例为1.7∶1,男性患者预后比女性差。原发部位结内、结外组间OS差异无统计学意义,但一项PTCL研究结果显示,胃肠道和胸膜受累患者预后最差,而头颈部黏膜、乳腺病变者预后较好[26]。本研究中原发皮肤者预后较好,可能与早期病变较为局限有关[29,30,31],但需警惕其发展为全身性疾病的潜在可能。
在评估模型方面,C指数、ROC曲线和校准曲线均提示我们构建的模型预测准确性较高,与Ann Arbor分期相比,IDI及NRI结果也进一步证实了这一点,而且DCA显示我们的模型比Ann Arbor分期拥有较大的临床净收益。
我们的研究也存在一些局限因素。首先,SEER数据库化疗数据不尽详细,未能提供具体的化疗方案。其次,SEER数据库缺少可能与预后相关的因素,如乳酸脱氢酶水平、体能状况评分等。最后,构建的模型外部验证数据来源于SEER数据库,选取其他机构的数据进行外部验证或许更为重要。
总之,我们建立了一个比Ann Arbor分期更有效的OS预测模型,可帮助患者及医生了解ALK+ ALCL预后情况,以采取有效的干预措施。同时,我们也期待多中心、更大的前瞻性研究来证实我们的发现。
所有作者均声明不存在利益冲突



























