
利妥昔单抗上市20多年以来,在临床实践中疗效和安全性良好。美国食品药品管理局(FDA)于2012年批准了利妥昔单抗的静脉快速输注用于第2个及后续疗程。目前,利妥昔单抗90 min静脉快速输注方案已在国外成熟应用,美国国立综合癌症网络(NCCN)指南中也推荐第1个疗程利妥昔单抗输注未出现输注反应的患者,后续疗程可进行利妥昔单抗90 min静脉快速输注。我国也有研究数据证实了利妥昔单抗90 min静脉快速输注方案的安全性和耐受性。因此,基于国内外循证医学证据,为了提高患者的就诊质量以及节约医疗成本,本专家共识推荐,对于首次输注未发生明显不良反应的患者,后续疗程可使用利妥昔单抗90 min静脉快速输注方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
利妥昔单抗是一种靶向CD20的单克隆抗体,能显著改善CD20阳性非霍奇金淋巴瘤(NHL)患者的预后。该药上市20多年来,在临床实践中疗效和安全性良好,主要的不良反应为输注相关反应。按照标准的输注速度,患者第1次输注时间为4~6 h,以后疗程的输注时间为3~4 h[1]。长时间输注造成了患者的长时间等待,影响了患者的就医体验和生命质量,且治疗成本也相应增加[2]。
2012年10月19日美国食品药品管理局(FDA)基于一项Ⅲ期单臂的开放标签研究(RATE研究)批准了利妥昔单抗(商品名:美罗华)的静脉快速输注(90 min)用于第2个及后续疗程[3]。利妥昔单抗静脉快速输注首次报道于2001年,一项研究纳入了33例慢性淋巴细胞白血病(CLL)患者,首次探索利妥昔单抗静脉快速输注方案的疗效和安全性,其中23例患者从第3剂开始使用利妥昔单抗60 min静脉快速输注,结果显示出良好的安全性和耐受性[4]。随后陆续有关于利妥昔单抗静脉快速输注的研究被报道,包括诱导治疗和维持治疗,输注时间主要包括60 min和90 min两种形式,后者更为常见[4,5,6,7,8,9,10,11,12,13,14]。RATE研究结果显示,363例B-NHL(包括弥漫大B细胞淋巴瘤和滤泡性淋巴瘤)患者在免疫化疗第1个疗程耐受良好的前提下,第2个及后续疗程接受利妥昔单抗90 min静脉快速输注,其中303例患者完成了完整的6个或8个疗程;在第2个疗程中,3~4级输注相关反应发生率为1.1%;在第2个至第8个疗程中,3~4级输注相关反应发生率为2.8%[1]。除了诱导治疗使用静脉快速输注外,也有维持治疗采用静脉快速输注的相关报道,150例B-NHL患者在免疫化疗第2个疗程开始接受利妥昔单抗静脉快速输注,其中56例患者接受利妥昔单抗维持治疗的静脉快速输注,诱导治疗及维持治疗中均未观察到3~4级输注相关反应[15]。
目前,我国关于利妥昔单抗静脉快速输注的研究较少。中山大学肿瘤防治中心于2015年发表了首个中国人群利妥昔单抗静脉快速输注的研究,177例淋巴瘤患者在第2个及后续疗程接受了90 min利妥昔单抗静脉快速输注,其中2例患者出现了3~4级输注相关反应[16]。另外,北京协和医院血液科报道了利妥昔单抗60 min静脉快速输注方案的安全性,总体不良反应发生率为4.2%,其中3级不良反应占10%,未出现4级及以上不良反应[17]。
不管是诱导治疗还是维持治疗,不同研究均显示出利妥昔单抗静脉快速输注的良好耐受性。静脉快速输注能缩短输注时间和门诊访视时间,减少对医疗资源的占用[18,19]。利妥昔单抗90 min静脉快速输注方案在国外已成熟应用,美国国立综合癌症网络(NCCN)指南推荐第1个疗程利妥昔单抗输注未出现输注反应的患者,后续疗程可进行利妥昔单抗静脉快速输注[20]。我国也有研究证实了利妥昔单抗90 min静脉快速输注方案的安全性和耐受性。因此,基于国内外循证医学证据,为了提高患者的就诊质量以及节约医疗成本,本专家共识推荐,对于首次输注未发生明显不良反应的患者,后续疗程可使用利妥昔单抗90 min静脉快速输注方案。
每次输注利妥昔单抗前应预先使用解热镇痛药物(如对乙酰氨基酚)和抗组胺药物(如苯海拉明)。对于90 min静脉快速输注方案,治疗方案中的糖皮质激素应在输注利妥昔单抗前使用。
第1次输注:利妥昔单抗标准剂量375 mg/m2,推荐起始输注速度为50 mg/h;如果无输注反应,可每30 min增加50 mg/h,直至最大速度400 mg/h。后续输注:利妥昔单抗标准剂量375 mg/m2,起始输注速度可为100 mg/h,每30 min增加100 mg/h,直至最大速度400 mg/h。
第1次输注:利妥昔单抗标准剂量375 mg/m2,推荐起始输注速度为50 mg/h;如果无输注反应,可每30 min增加50 mg/h,直至最大速度400 mg/h。后续输注:利妥昔单抗标准剂量375 mg/m2。参照美国FDA说明书,利妥昔单抗配置浓度为1~4 mg/ml[3]。按照体表面积计算患者所需利妥昔单抗剂量,可将其溶于250 ml 0.9% NaCl溶液中[21]。起始30 min以一定速度输注20%配制好的利妥昔单抗溶液,接下来60 min以一定速度输注剩余80%配制好的利妥昔单抗溶液(总输注时间为90 min)[3]。
NHL患者在利妥昔单抗第1个疗程标准输注治疗中未出现3~4级输注相关不良反应时,在后续疗程中,可接受利妥昔单抗的静脉快速输注。
(1)第1个疗程治疗的B-NHL患者;(2)第1个疗程利妥昔单抗标准输注出现3~4级输注相关不良反应的B-NHL患者;(3)心、肺、肾等脏器功能不全的患者;(4)高肿瘤负荷患者:巨大肿块(长径>7 cm)和(或)高循环淋巴细胞计数(>5 000/mm3)的患者[3];(5)年老体弱或其他不适合静脉快速输注的患者。
在大多数B-NHL患者中,首次利妥昔单抗输注期间可能发生的输注相关反应包括发热、发冷、畏寒、恶心、瘙痒、血管性水肿、低血压、头痛、支气管痉挛、荨麻疹、皮疹、呕吐、肌痛、头晕或高血压等,也有发生致命严重输注反应的报道。依据2017年11月27日美国国家癌症研究所(NCI)发布的常见不良事件评价标准(CTCAE)5.0版对输注相关反应的严重程度进行分级,其中,1级:反应短暂且轻微,无需中断输液,无需治疗;2级:需要中断治疗或输液且迅速予以对症治疗(如应用抗组胺药、非甾体抗炎药等),需要不长于24 h的预防用药;3级:状况处理延迟[如未立即对症状予以对症治疗和(或)短暂中断输液],初始症状改善后又复发,需要住院治疗的临床后遗症;4级:危及生命,需要紧急治疗;5级:死亡。
患者输注利妥昔单抗前进行预防用药,静脉快速输注过程中的监护要求与标准输注相同。输注相关反应通常在第1次输注开始后30~120 min内发生,根据严重程度选择干预措施,可减慢或中断利妥昔单抗输注并予以支持治疗(如应用抗组胺药物、糖皮质激素、肾上腺素、支气管扩张剂)。当症状完全缓解以后,可以减慢50%的速度重新开始输注治疗(如从100 mg/h降低到50 mg/h)。大部分发生非致命性输注反应的患者都能完成整个疗程的利妥昔单抗治疗。症状和体征完全缓解后,患者继续接受治疗很少再次发生严重输注相关反应。对于心肺功能不全以及循环淋巴细胞计数高(≥ 25 000/mm3)的患者需密切监测。
利妥昔单抗静脉快速输注的流程总结见图1。
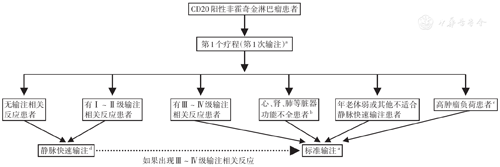

注:a利妥昔单抗标准剂量375 mg/m2给药,推荐起始输注速度为50 mg/h,如果无输注反应,可每30 min增加50 mg/h,直至最大速度400 mg/h;b既往有心血管疾病史或肺部疾病史患者;c巨大肿块(长径>7 cm)和(或)高循环淋巴细胞计数(>5 000/mm3)患者;d利妥昔单抗标准剂量375 mg/m2,按照体表面积计算患者所需剂量,溶于250 ml 0.9% NaCl溶液中,起始30 min内以一定速度输注20%配制好的利妥昔单抗溶液,接下来的60 min以一定速度输注剩余80%配制好的利妥昔单抗溶液,总输注时间90 min(即起始30 min输注50ml配制好的利妥昔单抗溶液,接下来60 min输注剩余200 ml配制好的利妥昔单抗溶液)
执笔 黄慧强、杨海燕、许景艳、吴俣、高岩
主审专家 马军、朱军、石远凯、吴德沛、黄晓军、姜文奇、冯继锋、邱录贵、黄慧强
顾问专家 管忠震
专家组成员(按姓氏笔画排序) 卜庆(广西医科大学附属第一医院)、马军(哈尔滨血液病肿瘤研究所)、双跃荣(江西省肿瘤医院)、白鸥(吉林大学白求恩第一医院)、代喜平(广东省中医院)、冯继锋(江苏省肿瘤医院)、石远凯(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院 北京协和医学院肿瘤医院)、刘丽宏(河北医科大学第四医院)、许景艳(南京鼓楼医院)、朱军(北京大学肿瘤医院)、岑洪(广西医科大学附属肿瘤医院)、邱录贵(中国医学科学院 北京协和医学院血液学研究所 血液病医院)、沈建箴(福建医科大学附属协和医院)、宋玉琴(北京大学肿瘤医院)、苏丽萍(山西省肿瘤医院)、吴剑秋(江苏省肿瘤医院)、吴俣(四川大学华西医院)、吴德沛(苏州大学附属第一医院)、肖建(中山大学附属第六医院)、杨海燕(浙江省肿瘤医院)、杨顺娥(新疆维吾尔自治区肿瘤医院)、杨威(中国医科大学附属盛京医院)、杨瑜(福建省肿瘤医院)、张会来(天津市肿瘤医院)、张利玲(华中科技大学同济医学院附属协和医院)、张健(南方医科大学珠江医院)、张薇(中国医学科学院 北京协和医学院 北京协和医院)、邹立群(四川大学华西医院)、周政涛(广东省清远市人民医院)、周辉(湖南省肿瘤医院)、姜文奇(中山大学肿瘤防治中心)、赵莹(广东省佛山市第一人民医院)、高岩(中山大学肿瘤防治中心)、郭晔(同济大学附属东方医院)、聂波(昆明医科大学附属第一医院)、钱文斌(浙江大学医学院附属第一医院)、徐卫(南京医科大学第一附属医院 江苏省人民医院)、徐兵(厦门大学附属第一医院)、曹军宁(复旦大学附属肿瘤医院)、崔国惠(华中科技大学同济医学院附属协和医院)、黄慧强(中山大学肿瘤防治中心)、黄锦雄(广西壮族自治区柳州市人民医院)、黄晓军(北京大学人民医院)、黄韵红(贵州省肿瘤医院)、梁月雄(广东省肇庆市第一人民医院)、梁蓉(空军军医大学西京医院)、董敏(桂林医学院附属医院)、景红梅(北京大学第三医院)、彭志刚(广西医科大学附属第一医院)、曾辉(暨南大学附属第一医院)、蓝海(广州中医药大学顺德医院)、管忠震(中山大学肿瘤防治中心)
所有作者均声明不存在利益冲突



























本文中执笔者由“黄慧强、杨海燕、许景艳、吴俣、高岩”更正为:“黄慧强、张薇、杨海燕、许景艳、吴俣、高岩”。更正的同时表示歉意!