
提高对急性髓系白血病(AML)合并肺栓塞的认识。
回顾性分析广东省东莞市人民医院1例初发AML合并肺栓塞患者的临床资料,并进行相关文献复习。
该例患者行肺动脉CT血管造影(CTA)等相关检查明确诊断为初发AML合并肺栓塞,患者血小板减少时使用新型抗凝剂利伐沙班治疗,治疗2个月时复查未见肺栓塞影像学表现,效果较好。
初发AML合并肺栓塞病情凶险,当高度怀疑时应尽早行肺动脉CTA检查进一步明确诊断。对于合并血小板减少的患者,使用利伐沙班作为抗凝方案疗效满意,可能是一种较好的临床选择。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性白血病是恶性血液肿瘤中常见类型。随着造血干细胞移植技术的成熟及靶向药物的出现,部分患者可能获得长期生存,但仍有相当一部分患者在诊治过程中因并发症或肿瘤复发而死亡。导致死亡的原因除肿瘤复发外,感染及出血也是重要原因,而医师对于合并急性肺栓塞等静脉血栓栓塞症(VTE)情况则关注较少。对于初发急性白血病合并急性肺栓塞国内外仅有少数病例报道。广东省东莞市人民医院收治的1例初发急性髓系白血病合并急性肺栓塞患者使用利伐沙班取得较好的临床效果,现报道如下。
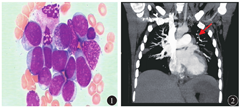
患者,女性,29岁,因头晕、乏力伴面色苍白10余天入住广东省东莞市人民医院血液科。患者急诊血常规示:白细胞计数325×109/L,血小板计数21×109/L,血红蛋白61 g/L,幼稚细胞占0.80。入院查体:体温37.8 ℃,脉搏100次/min,贫血貌,皮肤黏膜未见明显出血点,颈部可触及肿大淋巴结;胸骨压痛明显;双肺呼吸音稍粗,未闻及干、湿啰音;余查体无特殊;既往史、个人史、月经婚育史、家族史均无明显异常。骨髓涂片示:AML骨髓象可见原始粒细胞约占0.775(图1);骨髓染色体核型正常;AML预后突变基因(初级)示:FLT3-ITD阳性、CEBPA-N端转录酶阳性,其余均阴性。患者确诊为AML(非M3型,FLT3-ITD阳性,高危组)[1]。患者入院后予大量补液、羟基脲降白细胞、白细胞单采等积极对症支持治疗。入院第3天突发胸痛、气促,伴呼吸困难,血氧下降至80%。血压110/70 mmHg(1 mmHg=0.133 kPa),心率115次/min,双肺呼吸音粗,双肺可闻及少许散在湿啰音;心脏、腹部查体无特殊。患者急性胸痛合并血氧降低,立即予心电监护、吸氧。凝血功能D-二聚体16.89 μg/mL;血气分析示:氧分压56.5 mmHg,肺泡动脉氧分压差48.3,二氧化碳分压正常。双下肢血管检查:左侧腓静脉静脉血栓形成,余未见异常;肺动脉CT血管造影(CTA)示:右肺下叶肺动脉分支栓塞(图2);B型利钠肽(BNP)、心肌酶、心肌标志物大致正常。结合患者病情,诊断AML合并肺栓塞、左侧腓静脉血栓明确,肺栓塞风险评分(PESI)为Ⅲ级或中危,存在高危因素[2,3];但患者血小板计数低(21×109/L),向患者及家属交代病情及诊治方案后,抗凝方案先选用利伐沙班(20 mg,口服,1次/d),持续应用;同时予吸氧、积极抗感染等治疗后患者胸痛等症状较前好转,在吸氧情况下血氧可维持在95%以上。针对急性白血病方面的治疗:白细胞计数下降至50×109/L以下时予标准IA方案[4](伊达比星10 mg/m2,1次/d,第1至第3天;阿糖胞苷0.1 g,2次/d,第1天至第7天)化疗,常规予升白细胞、成分输血、抗感染治疗后好转出院。出院1周后再次入院,复查肺动脉CTA及下肢血管彩色超声仍提示血栓,持续予利伐沙班抗凝治疗;入院后复查骨髓等检查提示完全缓解,常规予第2个疗程IA方案化疗。患者第3次入院时(距离肺栓塞确诊时间约2个月),复查肺动脉CTA及下肢血管彩色超声提示未见明显异常,已未见血栓形成,持续应用利伐沙班抗凝治疗。后续选用中大剂量阿糖胞苷(阿糖胞苷6 g,第1天至第3天)巩固化疗。随访至截稿前,患者接受第6个疗程中大剂量阿糖胞苷巩固化疗,距离肺栓塞确诊时间约6个月,白血病复查提示持续完全缓解;患者无气促、呼吸困难、胸痛等临床表现,复查肺动脉CTA及双下肢血管彩色超声均未见血栓形成。

急性白血病患者死亡的主因为感染和出血,在其诊治过程中,一般对出血比较重视,而对血栓形成或血栓栓塞关注较少,但恶性血液病患者合并血栓形成发生率不低[5]。2009年Ku等[6]指出急性白血病的血栓栓塞并发症和部分实体瘤发生的血栓栓塞性疾病的概率大致相仿,需要引起重视。
由于急性白血病合并肺栓塞相关报道极为少见,目前对于其发生的危险因素并不清楚。对于肿瘤合并肺栓塞的危险因素[2,3],除了肿瘤本身是其高危因素外,化疗及应用促红细胞生成素等肿瘤相关治疗也会增加VTE风险。感染(特别是呼吸系统感染、泌尿系感染或人类免疫缺陷病毒感染)是VTE的常见诱发因素;输血也可能增加VTE的风险。其他因素如卧床>3 d、久坐不动、老龄、静脉曲张、中心静脉置管、使用激素等也可能是其发生的危险因素。肺栓塞是内科急重症之一,肺栓塞多因素分析显示,肿瘤使急性肺栓塞患者30 d死亡、休克或急性肺栓塞复发的风险增加3倍。血栓栓塞性疾病电子登记库(RIETE)注册研究显示,肿瘤和非肿瘤急性肺栓塞患者3个月全因死亡率分别为26.4%和4.1%,肿瘤是全因死亡率和急性肺栓塞相关死亡率最强的独立危险因素[7]。由此可见,肿瘤合并肺栓塞其危险度更高,预后更差,若不及时有效处理,可能导致患者死亡。
此例患者为初发AML合并肺栓塞,结合患者病史,急性白血病应为肺栓塞的主要病因:初诊时白细胞计数(325×109/L)显著升高。考虑本例患者发生肺栓塞的可能机制:一方面白血病细胞增多造成血黏滞度增加,血流通过血管的速度减慢,易发生血管栓塞;另一方面白血病细胞的代谢产物可在血液中堆积,造成血管进一步收缩,加重组织缺血、缺氧[4]。该患者发病时有低热,肺部CT提示肺部感染,感染的诊断是明确的。依据Castelli等[8]的报道,感染可增加血栓事件的发生;Ubukata等[9]报道1例头颈部多重感染导致肺栓塞形成。因而,感染也可能是其形成肺栓塞的一个重要因素。血小板是白色血栓的主要成分,是一期凝血的重要成分,但本例患者血小板明显减少并未能阻止VTE的发生。国内外较多的文献已报道,肿瘤细胞可表达多种促凝物质(PCA),其中已经明确的促凝物有组织因子(TF)和癌促凝物(CP),其中TF可激活外源性凝血途径,在血栓形成中起重要作用[10]。文献[11]报道,在急性白血病患者中,血清TF水平表达增加,可导致血栓形成。结合本例患者凝血功能显著异常(主要是纤维蛋白原及D-二聚体明显升高),考虑凝血功能异常也可能参与了血栓的形成。由此可见,高白细胞、感染、凝血功能异常等均可能参与了患者肺栓塞的形成,其是由多种因素综合导致的,而血小板的减少并不能阻止血栓的形成,在临床中值得我们高度重视。
在无抗凝治疗禁忌证的情况下,一旦患者确诊肿瘤合并肺栓塞,应立即启动抗凝治疗;有效的抗栓治疗是防治血栓栓塞症致残、致死的最重要手段,其主要并发症是出血。但合并血小板减少患者的抗凝或溶栓治疗出血风险会显著增加,不良事件发生率可增加至34%[3]。因此血小板减少症合并VTE患者在治疗上存在相互矛盾。对于此类患者如何选择抗凝剂类型、剂量及使用持续时间,目前尚无统一治疗指南指导临床。新型口服抗凝药(NOAC)不仅可用于非瓣膜性心房颤动的抗凝治疗及骨科术后预防静脉血栓,也广泛用于肺栓塞的抗凝治疗,为肺栓塞的诊治提供了一种可能更优的选择,特别是对于使用常规抗凝剂后有较大出血风险的患者[12,13,14]。大规模的研究证实NOAC用于肺栓塞的抗凝治疗效果不劣于华法林,且在长期治疗中主要出血并发症发生率低于华法林组[2]。利伐沙班为一种新型的口服抗凝药,本例患者治疗2个月后复查肺动脉CTA及下肢血管彩色超声显示栓塞已消失,提示治疗效果理想,未发生出血等相关并发症。
总之,对于初发的AML,若突发胸痛、气促、呼吸困难等症状时,要高度警惕合并肺栓塞的可能,应积极完善肺动脉CTA等相关检查。对于合并血小板减少而不宜使用低分子肝素治疗的患者,新型口服抗凝剂利伐沙班不失为较好的临床选择。
所有作者均声明不存在利益冲突



























