
探讨miRNA-618(miR-618)对急性单核细胞白血病THP-1细胞增殖和凋亡的影响。
采用实时荧光定量聚合酶链反应(PCR)检测miR-618在THP-1细胞和健康人外周血分离的单核细胞中的相对表达量。构建过表达miR-618质粒载体,以空载体作为阴性对照,将二者分别转染THP-1细胞,设定为miR-618过表达组和阴性对照组。采用CCK-8法和流式细胞术分别检测各组THP-1细胞增殖和凋亡情况。采用TargetScan软件预测miR-618靶基因,通过荧光素酶报告基因实验对其进行验证。采用蛋白质印迹法检测miR-618过表达组或阴性对照组的THP-1细胞和健康人外周血单核细胞中预测的miR-618靶基因蛋白表达的水平。
PCR结果显示,与健康人外周血分离的单核细胞相比,THP-1细胞中miR-618表达量低(P<0.05)。CCK-8法检测结果显示,与阴性对照组比较,miR-618过表达组THP-1细胞增殖能力降低(转染0、24、48、72 h细胞吸光度值:0.20±0.03比0.20±0.03、0.28±0.02比0.35±0.03、0.34±0.03比0.43±0.04、0.39±0.02比0.53±0.05,均P<0.05),细胞晚期凋亡率升高[(27.1±0.1)%比(14.9±0.1)%,t=2.13,P=0.03]。TargetScan软件预测miR-618靶基因为ARPP19。荧光素酶报告基因实验结果显示,转染野生型ARPP19基因质粒+ miR-618基因质粒组的THP-1细胞相对荧光素酶活性均高于空白对照组和转染野生型ARPP19基因质粒+ miR-618空载质粒组(0.170±0.003比0.100±0.004、0.100±0.001,均P<0.05)。蛋白质印迹法检测结果显示,miR-618过表达组THP-1细胞ARPP19蛋白表达水平低于阴性对照组,而两组健康人外周血单核细胞中ARPP19蛋白表达水平相近。
miR-618可能通过抑制急性单核细胞白血病THP-1细胞ARPP19的表达而抑制细胞增殖、促进细胞凋亡。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是由多种因素引起的造血系统恶性疾病,常伴随分化受阻、增殖异常、遗传学异常等[1]。尽管化疗后有40%~60% AML患者获得缓解,但仍有近60%的患者缓解后复发[2]。微RNA(miRNA)能调控细胞增殖、发育、分化和凋亡等[3],其直接与mRNA上的顺式元件相互作用,对靶转录本的稳定性和转录翻译产生负向或正向的调节作用[4]。随着AML发病率及病死率逐年升高[2],寻找调控新靶点成为AML诊断和治疗的新思路。我们前期分析筛选了一些在AML中差异表达的miRNA,本实验即对其中的miRNA-618(miR-618)对急性单核细胞白血病THP-1细胞的影响及可能机制进行研究,为AML患者的诊断、治疗提供思路。
急性单核细胞白血病细胞株THP-1购自上海中国科学院细胞库,分离的健康人外周血单核细胞取自山西省肿瘤医院样本库。LipoFiter转染试剂购自美国Life Technology公司,蛋白质印迹法相关抗体、荧光素酶报告基因实验试剂盒购自英国Abcam公司,miR-618模拟物购自北京瑞博泰克公司,胎牛血清、RPMI 1640培养液购自美国Invitrogen公司,RNA提取及反转录试剂盒购自日本TaKaRa公司,CCK-8试剂盒购自日本同仁化学研究所,Annexin V和PI染色液购自北京索莱宝科技有限公司。miRNA相关质粒、突变型3'UTR ARPP19探针及聚合酶链反应(PCR)引物设计由上海生工生物工程公司完成。PTC-100 PCR仪、iQ5 Real Time PCR系统、电泳仪购自美国Bio-Rad公司,CytoFLEX C6流式细胞仪购自美国Beckman Coulter公司,CO2培养箱购自美国Esco公司,-80 ℃冰柜、NANODROP 2000紫外分光光度计购自美国Thermo公司。
THP-1细胞用含10%胎牛血清的RPMI 1640高糖培养液,于37 ℃、5% CO2恒温培养箱中培养。构建载有miR-618基因的质粒,以空载体质粒作为阴性对照,将二者分别转染THP-1细胞或健康人外周血单核细胞,设定为miR-618过表达组和阴性对照组。步骤如下:在转染前一天将细胞转到6孔板,用10%胎牛血清RPMI 1640培养液培养。细胞融合度达到75%~85%时,采用LipoFiter试剂转染,将细胞置于不含胎牛血清的RPMI 1640培养液中,于37 ℃、5% CO2恒温培养箱中培养36~48 h,更换为新鲜的含10%胎牛血清的RPMI 1640培养液培养。
采用TRIzol法提取细胞总RNA,用紫外分光光度计测定RNA浓度和纯度,测定260 nm与280 nm处吸光度(A)比值在1.80~2.00。应用反转录试剂盒合成cDNA。以cDNA为模板,进行实时荧光定量PCR扩增。以GAPDH为内参基因。miR-618正向引物:5′-TG CTCTTGTTCACAGCCAAA-3′,反向引物:5′-GGTGAT GCCAATAACCCATC-3′;GAPDH正向引物:5′-ACCA CAGTCCATGCCATCAC-3′,反向引物:5′-TCCACCACCCTGTTGCTGTA-3′;反应体积为20 μl;反应条件:94 ℃ 10 s;56 ℃ 10 s,72 ℃ 15 s,共55个循环;94 ℃ 12 s,64~94 ℃生成熔解曲线。扩增设3个复孔。mRNA相对表达量以2-ΔΔCt计算。
取96孔板,加入各组细胞悬液100 μl/孔[(3~5)×103个细胞],培养0、24、48、72 h,加入10 μl CCK-8试剂,培养3 h,用酶标仪测定450 nm处A值,以此值为细胞增殖水平。
将转染24~36 h的细胞重悬于100 μl磷酸盐缓冲液(PBS)中,分别加入荧光标记的Annexin V和PI染色液,室温避光15 min,应用流式细胞仪检测细胞凋亡情况。
采用TargetScan软件预测miR-618靶基因。转染前一天,将THP-1细胞或健康人外周血单核细胞按照2×105/孔接种于24孔板,用前述转染方法将载有miR-618基因或空载质粒和载有野生型或突变型预测基因3'UTR的质粒共转染THP-1细胞或健康人外周血单核细胞;以未经干预的细胞作为空白对照组,以转染载有突变型ARPP19基因质粒的细胞作为实验对照。转染36 h后收集细胞,PBS清洗2~3次,裂解细胞,将10 μl细胞裂解液加入96孔板中,加入荧光素酶底物,采用酶标仪检测萤火虫和海参荧光强度,以二者荧光强度比值为相对荧光素酶活性。实验重复3次。
用细胞裂解液提取总蛋白,BCA法测定蛋白浓度。SDS-PAGE分离蛋白样品,每孔样品20 μg;将蛋白转印到PVDF膜上,用5%脱脂牛奶于室温下封闭2 h。加入兔抗ARPP19一抗,反应12 h,加入抗兔二抗,室温反应2 h。DAB染色,分析蛋白表达水平。
采用SPSS 16.0软件进行统计学分析。计量资料符合正态分布,方差齐,以均数±标准差( ±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。以P<0.05为差异有统计学意义。
±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。以P<0.05为差异有统计学意义。
PCR检测结果显示,miR-618在健康人外周血单核细胞中相对表达量为0.93±0.02,在THP-1细胞中为0.36±0.08,差异有统计学意义(t=1.94,P=0.01)。
PCR检测结果显示,转染后,阴性对照组THP-1细胞miR-618基因相对表达量为1.00±0.04,转染miR-618模拟物的THP-1细胞miR-618相对表达量为1 034.00± 72.00,差异有统计学意义(t=2.91,P=0.001),表明THP-1细胞miR-618成功过表达。CCK-8法检测结果显示,转染后随着培养时间延长,miR-618过表达组THP-1细胞增殖水平较阴性对照组逐渐降低,转染24、48、72 h时,两组间细胞增殖水平差异均有统计学意义(均P<0.05),提示miR-618能抑制THP-1细胞增殖(表1)。
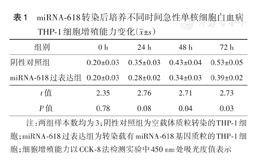
miRNA-618转染后培养不同时间急性单核细胞白血病THP-1细胞增殖能力变化( ±s)
±s)
miRNA-618转染后培养不同时间急性单核细胞白血病THP-1细胞增殖能力变化( ±s)
±s)
| 组别 | 0 h | 24 h | 48 h | 72 h |
|---|---|---|---|---|
| 阴性对照组 | 0.20±0.03 | 0.35±0.03 | 0.43±0.04 | 0.53±0.05 |
| miRNA-618过表达组 | 0.20±0.03 | 0.28±0.02 | 0.34±0.03 | 0.39±0.02 |
| t值 | 2.35 | 2.76 | 2.71 | 2.73 |
| P值 | 0.78 | 0.08 | 0.04 | 0.03 |
注:两组样本数均为3;阴性对照组为空载体质粒转染的THP-1细胞;miRNA-618过表达组为转染载有miRNA-618基因质粒的THP-1细胞;细胞增殖能力以CCK-8法检测实验中450 nm处吸光度值表示
流式细胞术检测结果显示,转染24 h后,miR-618过表达组THP-1细胞晚期凋亡率高于阴性对照组[(27.1±0.1)%比(14.9±0.1)%],差异有统计学意义(t=2.13,P=0.03),提示miR-618能够促进THP-1细胞的晚期凋亡(图1)。
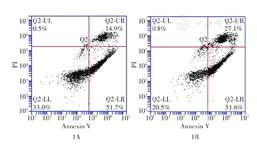

注:阴性对照组为空载体质粒转染的THP-1细胞;miRNA-618过表达组为转染载有miRNA-618基因质粒的THP-1细胞
经TargetScan软件分析,预测miR-618靶基因为ARPP19(图2)。荧光素酶报告实验显示,在THP-1细胞中,转染载有野生型ARPP19基因质粒+载有miR-618基因质粒组的相对荧光素酶活性高于空白对照组和转染载有野生型ARPP19基因质粒+miR-618空载质粒组,差异有统计学意义(P=0.03)(表2),提示miR-618能结合ARPP19基因3'UTR,进而影响荧光活性;在健康人外周血单核细胞中,转染载有野生型ARPP19基因质粒+载有miR-618基因质粒组与空白对照组和转染载有野生型ARPP19基因质粒+miR-618空载质粒组间的相对荧光素酶活性差异均无统计学意义(均P>0.05)(表2)。无论THP-1细胞还是健康人外周血单核细胞,转染载有突变型ARPP19基因质粒+载有miR-618基因质粒组与空白对照组和转染载有突变型ARPP19基因质粒+miR-618空载质粒组间的相对荧光素酶活性差异均无统计学意义(均P>0.05)(表2),提示miR-618不能结合突变型ARPP19基因3'UTR,结合位点突变完全。
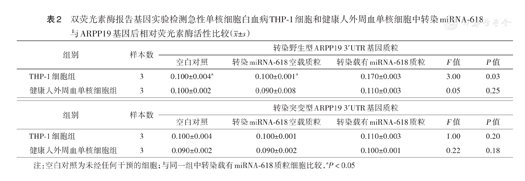
双荧光素酶报告基因实验检测急性单核细胞白血病THP-1细胞和健康人外周血单核细胞中转染miRNA-618与ARPP19基因后相对荧光素酶活性比较( ±s)
±s)
双荧光素酶报告基因实验检测急性单核细胞白血病THP-1细胞和健康人外周血单核细胞中转染miRNA-618与ARPP19基因后相对荧光素酶活性比较( ±s)
±s)
| 组别 | 样本数 | 转染野生型ARPP19 3′UTR基因质粒 | ||||
|---|---|---|---|---|---|---|
| 空白对照 | 转染miRNA-618空载质粒 | 转染载有miRNA-618质粒 | F值 | P值 | ||
| THP-1细胞组 | 3 | 0.100±0.004a | 0.100±0.001a | 0.170±0.003 | 3.00 | 0.03 |
| 健康人外周血单核细胞组 | 3 | 0.100±0.002 | 0.090±0.008 | 0.110±0.003 | 0.05 | 0.25 |
| 组别 | 样本数 | 转染突变型ARPP19 3′UTR基因质粒 | ||||
|---|---|---|---|---|---|---|
| 空白对照 | 转染miRNA-618空载质粒 | 转染载有miRNA-618质粒 | F值 | P值 | ||
| THP-1细胞组 | 3 | 0.100±0.004 | 0.100±0.001 | 0.110±0.003 | 1.00 | 0.20 |
| 健康人外周血单核细胞组 | 3 | 0.090±0.002 | 0.090±0.002 | 0.100±0.001 | 0.22 | 0.18 |
注:空白对照为未经任何干预的细胞;与同一组中转染载有miRNA-618质粒细胞比较,aP<0.05
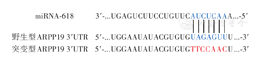
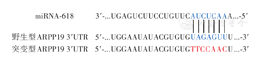
蛋白质印迹法检测结果显示,miR-618过表达组THP-1细胞ARPP19蛋白表达水平低于阴性对照组,而miR-618过表达组健康人外周血单核细胞ARPP19蛋白表达水平与阴性对照组相似(图3)。提示miR-618能负向调控THP-1细胞ARPP19表达。
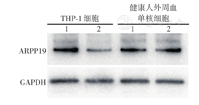

注:1为转染空载质粒组;2为转染载有miRNA-618基因质粒组
在细胞多级、多向的分化过程中,细胞中也有一系列复杂而精细的调控事件发生,当正常造血分化中的调控发生异常时,常导致血液系统肿瘤的发生。有大量临床证据表明miRNA参与一些肿瘤的恶性转化,如miRNA-155p通过上调核因子κB(NF-κB)、bcl-2的表达抑制AML细胞凋亡[5],而miRNA-34a/b在老年AML患者中低表达,且其高表达与患者良好的临床表现相关[6]。本实验通过PCR法检测发现,相对于健康人外周血单核细胞,THP-1细胞中miR-618的表达水平下调,我们推测miR-618可能作为抑癌基因在THP-1细胞中起调控作用。
研究发现,miR-618在胃癌中通过靶向环状RNA(circRNA)-CCDC66和释放bcl-2来抑制细胞凋亡[7],通过下调肿瘤生长因子β2(TGF-β2)抑制胃癌细胞迁移[8]。而miR-618低表达与骨肉瘤患者的临床分期和远处转移相关。在体外,外源性miR-618表达显著抑制骨肉瘤细胞增殖、迁移、侵袭和诱导凋亡[9]。在前列腺癌中miR-618作为癌基因发挥作用,与前列腺癌病理状态相关[10]。在实体瘤中一些miRNA很可能是临床早期诊断、疗效判断的潜在标志物。为了进一步验证miR-618在AML细胞增殖及凋亡中的作用,我们在THP-1细胞中转染了miR-618基因,结果显示,过表达miR-618能抑制THP-1细胞的增殖,诱导细胞凋亡。本研究的结果与大部分关于miR-618低表达的研究结论一致,本研究中miR-618与其他基因间相互关系的内容尚鲜见报道。本研究显示,miR-618在THP-1细胞中表达下调,并参与了THP-1细胞增殖抑制和凋亡延缓过程,可能是通过抑制ARPP19基因表达实现的。ARPP19是ENSA家族的成员,已被证明能够促进肿瘤细胞的G2/M期转换和有丝分裂[11]。ARPP19过表达与许多肿瘤(如胶质瘤和肝细胞癌)的进展有关[12,13],其在AML中能促进细胞的存活和myc、CDK1等癌相关蛋白的表达[14]。本实验通过研究miR-618对THP-1细胞的作用,为miR-618的临床靶向治疗提供了一定的体外实验依据。
总之,本研究结果表明,miR-618在THP-1细胞中低表达,并具有一定的功能,可能与AML的进展相关。我们后期将通过AML患者外周血细胞进一步对其进行研究,并继续探讨miR-618对THP-1细胞的影响。
所有作者均声明不存在利益冲突



























