
探讨基于维奈托克的治疗方案对t(11;14)复发难治多发性骨髓瘤(RRMM)患者的治疗效果。
回顾性分析海军军医大学长征医院2019年6月收治的1例接受基于维奈托克治疗方案的t(11;14)RRMM患者资料,并进行相关文献复习。
该t(11;14)RRMM患者经三线治疗进展后,予以选择性bcl-2抑制剂维奈托克联合达雷妥尤单抗、地塞米松治疗,疾病达到部分缓解,且一度血象恢复,美国东部肿瘤协作组(ECOG)体能状态评分由3分下降至1分,生命质量明显改善。
t(11;14)RRMM患者可从基于维奈托克的治疗中获益,未来尚需对维奈托克治疗多发性骨髓瘤的安全性、敏感性等进行深入探索。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(MM)是一种恶性浆细胞疾病[1],尽管蛋白酶体抑制剂和免疫调节剂等新药的应用延长了MM患者的生存时间,但几乎所有患者最终会发生耐药、疾病进展甚至死亡[2]。如何整合新药进行个体化靶向精准治疗是肿瘤治疗的创新性和革命性的理念,也是提高疗效的终极目标之一。鉴于二代测序、单细胞测序技术普遍开展受限,荧光原位杂交(FISH)检测染色体异常仍是当前评估疾病危险度分层及寻找靶向治疗靶点的重要方法。根据2014年国际骨髓瘤工作组(IMWG)和2018年美国梅奥中心mSMART 3.0标准中基于FISH结果的预后分层,将t(11;14)(q13;q32)划为细胞遗传学标准危险改变[3,4],但此类患者存在高度异质性,部分患者的疗效及预后差于其他标准危险患者[5,6,7,8,9]。本文报道1例存在t(11;14)的复发难治多发性骨髓瘤(RRMM)患者经三线治疗进展后予bcl-2抑制剂维奈托克联合达雷妥尤单抗、地塞米松治疗,疗效达到部分缓解(PR),并复习相关文献,为此类患者后续治疗提供借鉴。
患者,男性,57岁,因左侧胸肋部疼痛伴球蛋白增高就诊。患者2017年6月、11月遭受碰撞后发生左侧第4、5肋骨骨折,2017年12月14日体检时发现IgG 35.1 g/L,血免疫固定电泳IgG-κ型,M蛋白20.77 g/L。PET-CT示左侧第4、5肋骨骨质异常、代谢增高。骨髓细胞学检查示幼稚+成熟浆细胞0.375,FISH示:IgH重排阳性,t(11;14)阳性,17P-、13q-、1q21+均为阴性,于外院诊断为MM,IgG-κ型,DS ⅢA期,ISSⅠ期,R-ISSⅠ期。2018年1月5日起予VRD方案诱导治疗4个疗程,3个疗程后M蛋白降至2.65 g/L,最佳疗效PR。5月31日患者因肺部感染暂停化疗,随访M蛋白逐渐上升,外院考虑疾病进展。7月30日起调整为IRD方案治疗2个疗程。2018年9月复查M蛋白3.61 g/L,IgG 7.39 g/L,评估2个疗程疗效为疾病稳定(SD)。10月6日行自体外周血造血干细胞移植,移植后1个月复查M蛋白3.84 g/L,骨髓穿刺示浆细胞比例0.04,骨髓活组织检查示造血细胞三系增生基本在正常范围下限,见少数浆细胞。随访血小板计数维持于(60~70)×109/L,评估移植后疗效为SD。12月7日起予伊沙佐米单药维持治疗3个疗程。2019年2月复查M蛋白7.84 g/L,IgG 16.80 g/L,骨髓细胞学检查示幼稚+成熟浆细胞0.12,骨髓细胞免疫分型示单克隆浆细胞为6.88%。为提高疗效,于3月17日起调整为IRCD方案治疗2个疗程,过程中出现3级骨髓抑制(血小板计数最低30×109/L,白细胞计数最低2.18×109/L),均予对症处理后改善。2019年5月下旬复查M蛋白(9.79 g/L)等指标,评估疾病第2次进展。
2019年6月下旬患者再次出现左前胸疼痛,于2019年6月24日收入我科。患者被搀扶入院,前胸疼痛明显,一般情况差,生活仅能部分自理,美国东部肿瘤协作组(ECOG)体能状态评分3分。入院后全面评估疾病:免疫固定电泳IgG-κ型,M蛋白13.50 g/L,IgG 20.40 g/L,24 h尿κ 2 035 mg,血清游离轻链(sFLC):κ 1 158.00 mg/L,λ 1.62 mg/L,κ/λ 714.815。血常规及生化:白细胞计数3.5×109/L,血小板计数76×109/L,血红蛋白122 g/L,清蛋白44.6 g/L,β2微球蛋白2.15 mg/L,肌酐79 μmol/L,血钙2.28 mmol/L,乳酸脱氢酶188 U/L;骨髓细胞学示幼稚浆细胞+成熟浆细胞0.295,巨核系数目正常伴成熟障碍。骨髓活组织检查示造血细胞三系数目减少,细胞形态、分布未见异常,浆细胞增多,约占0.20,增生浆细胞κ呈限制性表达。PET-CT提示全身多处骨质破坏,左侧部分肋骨代谢增高,左侧第7肋骨病理性骨折。FISH示:t(11;14)阳性和1q21扩增阳性(拷贝数3)。诊断为MM,IgG-κ型,DS ⅢA期,ISSⅠ期,R-ISS Ⅰ期。结合既往病史与用药情况,7月11日起予DRD(达雷妥尤单抗16 mg/kg每周1次,来那度胺10 mg第1天至第21天,地塞米松20 mg每周2次)方案治疗,用药期间出现白细胞计数、血小板计数下降及胃肠道、呼吸道感染。1周后停用来那度胺。2019年8月25日复查M蛋白16.20 g/L,IgG 31.70 g/L,24 h尿κ 3 800 mg,sFLC:κ 2 429.00 mg/L,λ 0.75 mg/L,κ/λ 3 238.667,血红蛋白58 g/L。评估疾病第3次进展。
综合国内外文献,建议联合靶向精准治疗,患者治疗意愿强烈,主动要求自购维奈托克。根据病情及耐受性,排除禁忌后,于8月27日予VenDD方案(达雷妥尤单抗16 mg/kg每周1次,地塞米松20 mg每周2次,维奈托克800 mg每天1次),根据血象调整用药间隔时间。10月4日患者因造血细胞三系降低、发热入院,查白细胞计数2.3×109/L,血红蛋白41 g/L,血小板计数24×109/L,IgG 19.50 g/L,sFLC:κ 627.85 mg/L,λ 6.41 mg/L,κ/λ 98.002;病毒检测:人巨细胞病毒DNA阳性;痰培养:克柔念珠菌。结合sFLC及IgG结果,评估原发病病情稳定;造血细胞三系降低考虑与移植后骨髓增殖能力减低,化疗后骨髓抑制、感染相关。暂停第4次达雷妥尤单抗,加强对症抗感染治疗。11月5日门诊复查白细胞计数2.5×109/L,血红蛋白61 g/L,血小板计数50×109/L,M蛋白7.87 g/L,sFLC:κ 786.51 mg/L,λ 5.10 mg/L,κ/λ 154.218,尽管患者因骨髓抑制及感染间断用药,但经过1个疗程VenDD方案治疗后疗效达到PR,患者骨痛症状缓解,ECOG评分1分。11月15日继续予第2个疗程VenDD方案治疗,院外监测白细胞计数维持于(2.2~2.8)×109/L,血红蛋白维持于95~97 g/L,血小板计数波动于(21~45)×109/L,辅以对症支持治疗。12月27日复查M蛋白6.50 g/L,IgG 13.70 g/L,24 h尿κ 200 mg,血红蛋白99 g/L,评估2个疗程疗效为PR。2020年1月10日开始第3个疗程同方案治疗,次日因发热、肺部感染再次停药,经抗感染治疗好转后离院,后续根据血象院外自行口服维奈托克及地塞米松。2020年2月患者因腹主动脉瘤至外院行手术治疗,2月25日复查M蛋白14.10 g/L,IgG 28.15 g/L,提示疾病第4次进展,术后患者发生出血、感染,最终死亡。患者治疗过程中M蛋白水平变化见图1。
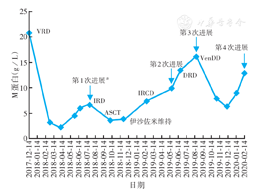

注:VRD方案为硼替佐米+来那度胺+地塞米松;IRD方案为伊沙佐米+来那度胺+地塞米松;ASCT为自体外周血造血干细胞移植;IRCD方案为伊沙佐米+来那度胺+地塞米松+环磷酰胺;DRD方案为达雷妥尤单抗+来那度胺+地塞米松;VenDD方案为维奈托克+达雷妥尤单抗+地塞米松;a患者起病诊治经过均为外院资料,M蛋白绝对值上升接近5 g/L,尽管外院尿轻链资料缺失,综合当时病情,考虑为疾病第1次进展
本例为中老年男性t(11;14)RRMM患者,起始治疗予VRD方案,因感染暂停期间出现疾病进展,无进展生存(PFS)时间7.5个月。二线治疗予IRD方案序贯自体移植,移植后长期处于骨髓抑制状态,最佳疗效SD,后伊沙佐米维持治疗效果欠佳,调整为IRCD方案2个疗程后出现第2次进展,PFS2时间为10个月。收入我院后三线方案调整为达雷妥尤单抗、来那度胺联合地塞米松治疗,但因骨髓抑制、反复感染停用来那度胺,1个疗程后出现疾病第3次进展,PFS3时间仅为3个月。2年内患者出现3次疾病进展,首次PFS时间仅7.5个月,从疗效已提示为高危群体,预后差,且蛋白酶体抑制剂、免疫调节剂、抗CD38单抗均出现耐药,治疗非常棘手。因患者强烈要求自购国外新药,结合其具有t(11;14)的细胞遗传学特征,四线治疗选择基于维奈托克的治疗方案,2个疗程疗效PR,第3个疗程因感染不规律用药,6.2个月后出现第4次疾病进展。最终因腹主动脉瘤术后出现出血、感染死亡。
t(11;14)是MM中最常见的IgH易位,在15%~24%的初诊患者中均可检测到。携带t(11;14)的MM患者具有特殊的细胞生物学和临床特征。除bcl-2表达升高、髓细胞白血病因子1(Mcl-1)表达降低外[10],t(11;14)不仅导致浆细胞中cyclin D1和CD20表达上调[11],亦与淋巴浆细胞形态和循环浆细胞数量增加有关[12],且IgM、IgD、不分泌型和轻链型MM的发病率较高[7]。尽管在欧洲肿瘤内科学会(ESMO)、美国国立综合癌症网络(NCCN)最新指南中,t(11;14)MM患者仍被认为属于标准预后危险分层,但近期相关回顾性研究显示t(11;14)的预后意义尚存在争议[5,6,7,8,9]。维奈托克是一种选择性bcl-2抑制剂,在慢性淋巴细胞白血病、急性髓系白血病和非霍奇金淋巴瘤等多种血液恶性肿瘤中具有良好的抗肿瘤活性[13,14,15]。尽管在MM诊断时bcl-2并非常规检测指标,但t(11;14)染色体易位导致bcl-2表达上调,是维奈托克治疗MM的潜在靶点。体外数据显示在人骨髓瘤细胞系(HMCL)和原代MM样本中,t(11;14)阳性的细胞对维奈托克高度敏感,这与bcl-2/Mcl-1 mRNA较高相关[16]。
目前维奈托克已在RRMM的Ⅰ~Ⅱ期临床试验中取得初步疗效[17,18,19,20,21,22](表1)。Kumar等[17]针对RRMM患者使用维奈托克单药治疗的Ⅰ期研究显示,日剂量1 200 mg的维奈托克单药方案是安全可耐受的,对t(11;14)RRMM患者,维奈托克单药治疗有效。而维奈托克的联合治疗取得了更好的治疗反应率和反应深度。维奈托克与卡非佐米、地塞米松联合治疗效果显著,总反应率(ORR)为78%,其中56%患者取得了非常好的部分缓解(VGPR)或更好疗效;维奈托克联合硼替佐米、地塞米松的ORR为67%,42%患者达到了VGPR或以上的疗效;维奈托克与地塞米松的Ⅰ期试验ORR为65%,Ⅱ期试验ORR为45%[18,19,20]。此外,评估维奈托克与伊沙佐米(NCT03399539)、抗CD38单抗(NCT03314181)联合治疗效果和安全性的临床试验亦在进行中。尽管上述报道展现了维奈托克广阔的应用前景,然而随访时间都较短。BELLINI试验为首项比较维奈托克与安慰剂联合硼替佐米和地塞米松治疗RRMM安全性及有效性的Ⅲ期随机研究,中位随访18.7个月后,维奈托克组ORR为82%,安慰剂组为68%。但接受维奈托克治疗的患者死亡风险增加,大多数患者的死亡与疾病进展有关,在突发死亡中,维奈托克组与感染相关的死亡率较高。值得注意的是,尽管维奈托克组总生存率下降,其中t(11;14)亚组的PFS和总生存均有改善[21]。这表明t(11;14)MM患者可能受益于维奈托克,但如何在更广泛的MM患者中寻找到维奈托克受益群体有待进一步探索。
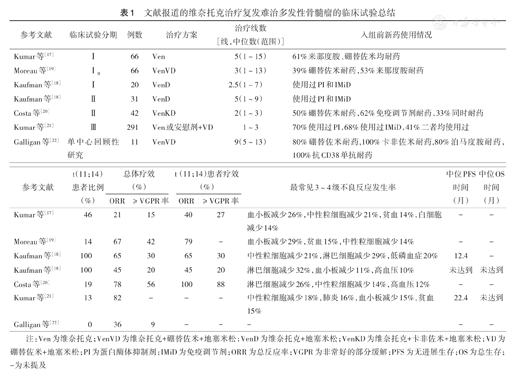
文献报道的维奈托克治疗复发难治多发性骨髓瘤的临床试验总结
文献报道的维奈托克治疗复发难治多发性骨髓瘤的临床试验总结
| 参考文献 | 临床试验分期 | 例数 | 治疗方案 | 治疗线数[线,中位数(范围)] | 入组前新药使用情况 |
|---|---|---|---|---|---|
| Kumar等[17] | Ⅰ | 66 | Ven | 5(1~15) | 61%来那度胺、硼替佐米均耐药 |
| Moreau等[19] | ⅠB | 66 | VenVD | 3(1~13) | 39%硼替佐米耐药,53%来那度胺耐药 |
| Kaufman等[18] | Ⅰ | 20 | VenD | 2.5(1~7) | 使用过PI和IMiD |
| Kaufman等[18] | Ⅱ | 31 | VenD | 5(1~9) | 使用过PI和IMiD |
| Costa等[20] | Ⅱ | 42 | VenKD | 2(1~3) | 50%硼替佐米耐药,62%免疫调节剂耐药,33%同时耐药 |
| Kumar等[21] | Ⅲ | 291 | Ven或安慰剂+VD | 1~3 | 70%使用过PI,68%使用过IMiD,41%二者均使用过 |
| Galligan等[22] | 单中心回顾性研究 | 11 | VenVD | 9(5~13) | 80%硼替佐米耐药,100%卡非佐米耐药,80%泊马度胺耐药,100%抗CD38单抗耐药 |
| 参考文献 | t(11;14)患者比例(%) | 总体疗效(%) | t(11;14)患者疗效(%) | 最常见3~4级不良反应发生率 | 中位PFS时间(月) | 中位OS时间(月) | ||
|---|---|---|---|---|---|---|---|---|
| ORR | ≥ VGPR率 | ORR | ≥ VGPR率 | |||||
| Kumar等[17] | 46 | 21 | 15 | 40 | 27 | 血小板减少26%,中性粒细胞减少21%,贫血14%,白细胞减少14% | - | - |
| Moreau等[19] | 14 | 67 | 42 | 79 | - | 血小板减少29%,贫血15%,中性粒细胞减少14% | - | - |
| Kaufman等[18] | 100 | 65 | 30 | 65 | 30 | 中性粒细胞减少21%,淋巴细胞减少29%,低磷血症20% | 12.4 | - |
| Kaufman等[18] | 100 | 45 | 20 | 45 | 20 | 淋巴细胞减少32%,血小板减少11%,高血压10% | 未达到 | 未达到 |
| Costa等[20] | 19 | 78 | 56 | 100 | 88 | 淋巴细胞减少26%,中性粒细胞减少14%,高血压12% | - | - |
| Kumar等[21] | 13 | 82 | - | - | - | 中性粒细胞减少18%,肺炎16%,血小板减少15%,贫血15% | 22.4 | 未达到 |
| Galligan等[22] | 0 | 36 | 9 | - | - | - | - | - |
注:Ven为维奈托克;VenVD为维奈托克+硼替佐米+地塞米松;VenD为维奈托克+地塞米松;VenKD为维奈托克+卡非佐米+地塞米松;VD为硼替佐米+地塞米松;PI为蛋白酶体抑制剂;IMiD为免疫调节剂;ORR为总反应率;VGPR为非常好的部分缓解;PFS为无进展生存;OS为总生存;-为未提及
本例t(11;14)RRMM患者整个病程中经多线方案治疗,最佳疗效未达VGPR,中位PFS时间短,且因移植后骨髓增殖能力减低,无法耐受强化疗为主的治疗方案。因达雷妥尤单抗在与多种药物协同使用时可通过免疫介导反应、免疫调节效应和诱导凋亡等不同机制,发挥直接或间接的抗肿瘤活性,并且亦有报道显示维奈托克联合抗CD38单抗治疗浆细胞白血病有效[23],故最终选择维奈托克联合达雷妥尤单抗、地塞米松治疗。患者1个疗程后再次获得PR,并且一度血象恢复,ECOG评分由3分下降至1分,生命质量明显改善。后患者因感染暂停第3个疗程抗CD38单抗的使用,且未能规律应用维奈托克,这与随后疾病再次进展可能相关。本例患者治疗线数多,且移植后骨髓抑制未恢复,抵抗力极低,而维奈托克的使用亦增加了感染发生的概率[21],尽管在治疗过程中定期给予丙种球蛋白提高免疫力,但效果欠佳,患者仍因反复感染影响治疗进程。因此,维奈托克治疗RRMM患者时如何防治感染是未来研究的重点之一。
既往报道t(11;14)合并TP53缺失的患者预后差[7],本例患者尽管无TP53缺失,但未行基因测序,不能明确是否合并TP53基因突变。该患者起病为ISSⅠ期、R-ISSⅠ期,应属于预后良好分期,但实际疗效、病程及预后均不佳,并且在复发后FISH出现1q21扩增这一高危遗传学改变[3],提示其骨髓瘤细胞存在较大异质性、克隆演变能力强,亦不能除外维奈托克使用后出现新的耐药克隆。这种特殊患者的不良预后原因还需深入探究。
总之,维奈托克治疗t(11;14)RRMM患者还需要更多的临床研究和更长时间的随访。进一步深入研究维奈托克在MM中抑制bcl-2的分子机制及其对克隆演化的影响,有助于在MM群体中识别出对维奈托克敏感的亚群及寻找靶点,以增加耐药MM对维奈托克的敏感性[19,24,25,26,27]。MM目前仍为不可治愈的血液恶性肿瘤,个体化医疗的进步、bcl-2靶向治疗的开展,将为MM治疗提供新的思路。
所有作者均声明不存在利益冲突



























