
探讨异基因造血干细胞移植(allo-HSCT)对治疗相关性白血病(TRL)的临床效果。
回顾性分析2012年4月至2020年2月于航天中心医院接受allo-HSCT的14例TRL患者的临床资料,分析其疗效及生存情况。
14例患者中,男性5例,女性9例;中位年龄35岁(12~59岁);急性髓系白血病12例,慢性淋巴细胞白血病/小细胞淋巴瘤1例,急性淋巴细胞白血病1例。移植时4例骨髓完全缓解,3例骨髓部分缓解,其余7例均未缓解。亲缘全相合移植5例,单倍型移植9例,均采用清髓性预处理方案。14例患者均顺利植活,中位粒细胞植活时间为16 d(10~24 d),中位血小板植活时间为13 d(10~34 d)。7例发生Ⅰ~Ⅱ级急性移植物抗宿主病(GVHD),6例发生慢性GVHD,2例发生Ⅲ级肠道GVHD。中位随访时间32个月(4~97个月),14例患者中5例死亡。
allo-HSCT可以改善TRL患者的预后,提高长期生存率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在原发性疾病(包括恶性肿瘤和良性疾病)放疗和(或)化疗后发生的白血病称为治疗相关性白血病(TRL),主要是放化疗损伤正常造血干细胞及免疫细胞而导致基因突变后发病,可发生在患者的任何年龄段。TRL占全部白血病的10%~20%,预后不良[1]。我们分析了接受异基因造血干细胞移植(allo-HSCT)治疗的14例TRL患者,评价allo-HSCT治疗TRL的效果及安全性。
回顾性分析2012年4月至2020年2月在我科接受allo-HSCT的14例TRL患者的临床资料,其中男性5例,女性9例,中位年龄35岁(12~59岁)。所有患者诊断均符合世界卫生组织(WHO)诊断标准;采用造血干细胞移植合并疾病指数(HCT-CI)评估移植前合并疾病。本研究符合《赫尔辛基宣言》的相关要求,所有患者均已签署知情同意书。
14例患者移植前均行PET-CT评估,若起病时有髓外病灶或移植前有髓外累及,均采用全身照射(TBI)为基础的预处理方案,无髓外病变患者采用白消安(BU)为基础的预处理方案。亲缘全相合移植5例,单倍型移植9例,均采用清髓性预处理方案。14例患者回输干细胞均为骨髓血+外周血来源干细胞。
14名供者均接受粒细胞集落刺激因子(G-CSF)5~10 μg·kg-1·d-1×5 d,第4天采集骨髓血,第5天采集外周血干细胞,输注的中位单个核细胞(MNC)数为9.0×108/kg[(8.0~11.3)×108/kg],中位CD34+细胞数为4.3×106/kg[(2.0~5.2)×106/kg]。
GVHD的诊断分级参照文献[2,3]。急性GVHD的预防采用环孢素联合短程甲氨蝶呤。环孢素1.25 mg·kg-1·d-1,-9天至+28天,肠道功能正常时改为口服,每周检测环孢素浓度,维持环孢素谷浓度150~250 μg/L;甲氨蝶呤15 mg·m-2·d-1,+1天,10 mg·m-2·d-1,+3天、+5天、+11天;单倍体移植分别加用抗人T细胞兔免疫球蛋白5 mg·kg-1·d-1×4 d。根据患者情况进行给药剂量的调整和减停,当出现Ⅱ级以上急性GVHD时,加用甲泼尼龙,疗效欠佳时调整基础免疫抑制剂为他克莫司,或联合给予抗CD25单克隆抗体、抗胸腺细胞球蛋白、间充质干细胞、芦可替尼等治疗。
中性粒细胞植入定义为中性粒细胞计数>0.5×109/L连续3 d,血小板植入定义为血小板计数>20×109/L连续7 d且脱离血小板输注。移植后供受者嵌合体状态根据性别采用性染色体分析(荧光原位杂交法)或患者CD3+淋巴细胞短串联重复序列(STR)-DNA进行分析。
采用电话和查阅门诊、住院病历的方式获得随访资料。总生存(OS)时间定义为干细胞回输至死亡或随访截止的时间;无病生存(DFS)时间定义为干细胞回输至疾病复发、死亡或随访截止时间。
采用SPSS 23.0软件进行统计学处理。计量资料不符合正态分布,用中位数(范围)表示。生存分析采用Kaplan-Meier法。
14例患者原发病的类型:急性早幼粒细胞白血病[急性髓系白血病(AML)-M3]2例,子宫绒毛膜癌2例,骨肉瘤2例,急性淋巴细胞白血病(ALL)1例,乳腺癌1例,结肠癌1例,子宫颈癌1例,混合型畸胎瘤1例,侵袭性葡萄胎1例,肝癌1例,霍奇金淋巴瘤(HL)1例。原发病的治疗:白血病和妇科肿瘤患者均接受化疗,其他实体瘤患者均接受手术及化疗,淋巴瘤患者均接受放化疗及自体干细胞移植(表1)。
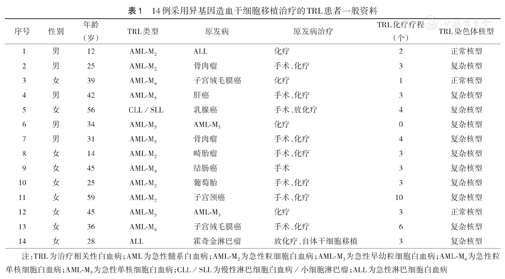
14例采用异基因造血干细胞移植治疗的TRL患者一般资料
14例采用异基因造血干细胞移植治疗的TRL患者一般资料
| 序号 | 性别 | 年龄(岁) | TRL类型 | 原发病 | 原发病治疗 | TRL化疗疗程(个) | TRL染色体核型 |
|---|---|---|---|---|---|---|---|
| 1 | 男 | 12 | AML-M2 | ALL | 化疗 | 2 | 正常核型 |
| 2 | 男 | 25 | AML-M2 | 骨肉瘤 | 手术、化疗 | 3 | 复杂核型 |
| 3 | 女 | 39 | AML-M4 | 子宫绒毛膜癌 | 化疗 | 1 | 正常核型 |
| 4 | 男 | 42 | AML-M5 | 肝癌 | 手术、化疗 | 3 | 复杂核型 |
| 5 | 女 | 56 | CLL/SLL | 乳腺癌 | 手术、放化疗 | 4 | 复杂核型 |
| 6 | 男 | 34 | AML-M5 | AML-M3 | 化疗 | 0 | 复杂核型 |
| 7 | 男 | 31 | AML-M5 | 骨肉瘤 | 手术、化疗 | 4 | 复杂核型 |
| 8 | 女 | 14 | AML-M2 | 畸胎瘤 | 手术、化疗 | 3 | 复杂核型 |
| 9 | 女 | 45 | AML-M4 | 结肠癌 | 手术 | 3 | 复杂核型 |
| 10 | 女 | 25 | AML-M2 | 葡萄胎 | 手术、化疗 | 3 | 复杂核型 |
| 11 | 女 | 59 | AML-M2 | 子宫颈癌 | 手术、化疗 | 10 | 复杂核型 |
| 12 | 女 | 45 | AML-M5 | AML-M3 | 化疗 | 3 | 正常核型 |
| 13 | 女 | 36 | AML-M4 | 子宫绒毛膜癌 | 手术、化疗 | 6 | 复杂核型 |
| 14 | 女 | 28 | ALL | 霍奇金淋巴瘤 | 放化疗、自体干细胞移植 | 3 | 复杂核型 |
注:TRL为治疗相关性白血病;AML为急性髓系白血病;AML-M2为急性粒细胞白血病;AML-M3为急性早幼粒细胞白血病;AML-M4为急性粒单核细胞白血病;AML-M5为急性单核细胞白血病;CLL/SLL为慢性淋巴细胞白血病/小细胞淋巴瘤;ALL为急性淋巴细胞白血病
14例患者均顺利植活,中位中性粒细胞植活时间16 d(10~24 d),中位血小板植活时间13 d(10~34 d)。移植28 d后植活鉴定示,14例患者均达到完全缓解(CR),13例DNA检测证实均为100%供者细胞嵌合,1例慢性淋巴细胞白血病/小细胞淋巴瘤(CLL/SLL)患者微小残留病(MRD)阳性:0.9%异常B细胞,DNA检测证实供者来源细胞占96.8%。
9例发生急性GVHD,其中Ⅰ~Ⅱ级7例,Ⅲ级2例(均为肠道GVHD),患者生存时间均>100 d;6例发生慢性GVHD,其中5例为广泛型,1例为局限型。
14例患者中,5例发生巨细胞病毒血症,给予更昔洛韦或磷甲酸钠联合或不联合静脉丙种球蛋白治疗,5例患者病毒血症均转阴,无EB病毒感染者。4例患者合并肺部感染,其中3例经抗生素治疗治愈,1例移植后4年余合并肺部感染,治疗无效死亡。3例患者合并出血性膀胱炎(1级),经碱化、水化治疗好转。1例患者在中性粒细胞植活后合并急性脑梗死,介入治疗手术后恢复良好。2例患者合并移植物功能不良(PGF)。1例患者合并肝窦静脉阻塞综合征(VOD),经减低免疫抑制剂剂量、输注血浆、间断给予小剂量低分子肝素治疗后治愈(表2)。
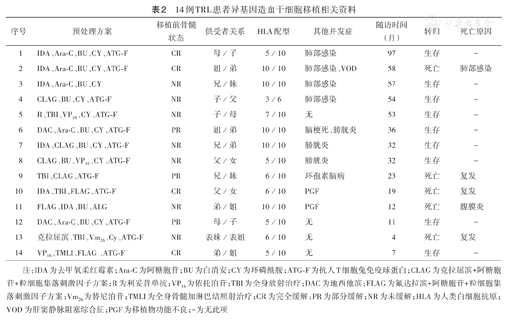
14例TRL患者异基因造血干细胞移植相关资料
14例TRL患者异基因造血干细胞移植相关资料
| 序号 | 预处理方案 | 移植前骨髓状态 | 供受者关系 | HLA配型 | 其他并发症 | 随访时间(月) | 转归 | 死亡原因 |
|---|---|---|---|---|---|---|---|---|
| 1 | IDA、Ara-C、BU、CY、ATG-F | CR | 母/子 | 5/10 | 肺部感染 | 97 | 生存 | - |
| 2 | IDA、Ara-C、BU、CY、ATG-F | CR | 姐/弟 | 10/10 | 肺部感染、VOD | 58 | 死亡 | 肺部感染 |
| 3 | IDA、Ara-C、BU、CY | NR | 兄/妹 | 10/10 | 肺部感染 | 57 | 生存 | - |
| 4 | CLAG、BU、CY、ATG-F | NR | 子/父 | 3/6 | 肺部感染 | 54 | 生存 | - |
| 5 | R、TBI、VP16、CY、ATG-F | NR | 子/母 | 7/10 | 无 | 53 | 生存 | - |
| 6 | DAC、Ara-C、BU、CY、ATG-F | PR | 姐/弟 | 10/10 | 脑梗死、膀胱炎 | 36 | 生存 | - |
| 7 | IDA、CLAG、BU、CY、ATG-F | NR | 兄/弟 | 10/10 | 膀胱炎 | 32 | 生存 | - |
| 8 | CLAG、BU、VP16、CY、ATG-F | NR | 父/女 | 5/10 | 膀胱炎 | 32 | 生存 | - |
| 9 | TBI、CLAG、ATG-F | PR | 兄/妹 | 6/10 | 环孢素脑病 | 23 | 死亡 | 复发 |
| 10 | IDA、TBI、FLAG、ATG-F | CR | 父/女 | 6/10 | PGF | 19 | 死亡 | 复发 |
| 11 | FLAG、IDA、BU、ALG | NR | 弟/姐 | 10/10 | PGF | 12 | 死亡 | 腹膜炎 |
| 12 | DAC、Ara-C、BU、CY、ATG-F | PR | 母/子 | 5/10 | 无 | 11 | 生存 | - |
| 13 | 克拉屈滨、TBI、Vm26、Cy、ATG-F | NR | 表妹/表姐 | 6/10 | 无 | 4 | 死亡 | 复发 |
| 14 | VP16、TMLI、FLAG、ATG-F | CR | 弟/姐 | 5/10 | 无 | 7 | 生存 | - |
注:IDA为去甲氧柔红霉素;Ara-C为阿糖胞苷;BU为白消安;CY为环磷酰胺;ATG-F为抗人T细胞兔免疫球蛋白;CLAG为克拉屈滨+阿糖胞苷+粒细胞集落刺激因子方案;R为利妥昔单抗;VP16为依托泊苷;TBI为全身放射治疗;DAC为地西他滨;FLAG为氟达拉滨+阿糖胞苷+粒细胞集落刺激因子方案;Vm26为替尼泊苷;TMLI为全身骨髓加淋巴结照射治疗;CR为完全缓解;PR为部分缓解;NR为未缓解;HLA为人类白细胞抗原;VOD为肝窦静脉阻塞综合征;PGF为移植物功能不良;-为无此项
截至2020年6月,中位随访32个月(4~97个月)。移植后3个月内无死亡;至随访结束,14例患者中,死亡5例,生存9例,生存患者中1例为带瘤生存状态,余均为DFS(表2)。14例患者的2年OS率为67.5%,DFS率为59.1%。5例死亡患者中,3例死于原发病复发,2例死于移植相关合并疾病(1例死于肺部感染;1例死于胆结石嵌顿,术后胆汁性腹膜炎)。1例患者伴FLT3-ITD基因突变,移植70 d后出现基因转阳,给予皮下注射白细胞介素2(IL-2),增加供者细胞的移植物抗白血病效应(GVL)后,基因转阴,移植32个月后复查发现骨髓全面复发,至截稿前口服索拉非尼治疗中,为带瘤生存状态。1例CLL/SLL患者植活鉴定MRD 0.9%异常B细胞,DNA检测结果显示供者来源细胞占96.8%,早期停免疫抑制剂,出现Ⅰ级GVHD,复查骨髓穿刺MRD仍升高,行CD19阴性嵌合抗原受体T细胞输注,获得长期缓解,至截稿前骨髓穿刺及PET-CT检查均为缓解状态。
随着医疗技术的发展,肿瘤患者的治疗方案不断改进,长期生存患者比例不断升高,作为远期并发症的TRL也越来越受到重视[4]。患者一旦发生TRL后生存期较短,治疗效果较差,其中位OS时间比原发性白血病患者短,目前国内关于TRL治疗尚鲜见大宗的病例报道。TRL的原发病以乳腺癌最多见,其次为淋巴瘤,生殖系统肿瘤治疗后继发白血病的患者也占一定比例[5]。本研究中原发肿瘤以血液系统及女性生殖系统肿瘤为主,与文献报道有偏差,原因可能为病例数少。
流行病学调查发现TRL的发生可能与患者治疗原发病时应用细胞毒药物或接受放射线治疗有关[6,7,8],但病因尚未完全明确,研究较多的可致TRL的化疗药物有烷化剂和DNA拓扑异构酶抑制剂[9]。但采用细胞毒药物治疗的患者只有部分会发生TRL,这可能与遗传易感性有关[10,11]。76%~90%的TRL患者有克隆性染色体核型异常[12]。本研究中,14例患者中有11例合并染色体核型异常,与文献报道相似。对于TRL的治疗,目前尚未发现最佳治疗方案,现有的治疗方式推荐主要来自临床经验和有限的回顾性研究分析,研究结果在各医疗机构间和临床医生间有很大的差异,一般参考原发白血病的治疗方案。
一些研究建议根据细胞遗传学危险度分层进行治疗[13,14]。对于发病时细胞核型较好的患者推荐化疗,如染色体核型t(15;17)、t(8;21)及inv(16);对于体能状态差、年龄大、核型差的患者建议尝试新药治疗;对于能够耐受移植的患者建议尽早行造血干细胞移植。研究发现,TRL常规化疗效果较差,中位OS时间仅6个月[15]。有研究建议患者一经诊断,应在早期阶段寻找allo-HSCT的人类白细胞抗原(HLA)相合供者,尽早行造血干细胞移植[16]。本组患者大部分有复杂染色体核型,常规化疗未获得形态学CR,提示预后不佳,但患者HCT-CI评分低、有合适的干细胞供者,因而选择行allo-HSCT。
造血干细胞移植为推荐的治疗TRL方法之一[17],目前主要用于体能良好、细胞遗传学中高等风险患者。Anderson等[16]的一项回顾性研究表明TRL早期诊断和造血干细胞移植治疗可以降低非复发死亡率,并可延长DFS时间,且未进行诱导缓解治疗即行造血干细胞移植的患者同对照组相比,差异无统计学意义。意大利一项研究显示,接受移植的TRL患者中位OS时间为58.8个月,未移植TRL患者中位OS时间明显缩短,为12.1个月[14],所以对这类患者早期行allo-HSCT是最佳治疗策略。
在本组资料中,14例患者行allo-HSCT前,骨髓CR患者只有4例,1例移植后19个月因髓外复发死亡,1例因广泛性慢性GVHD、合并肺部感染于移植后58个月死亡;其余10例为挽救性造血干细胞移植,其中有2例移植后因骨髓全面复发死亡,1例因胆囊结石嵌顿,胆囊手术合并疾病死亡,1例为带瘤生存状态,余均为DFS。14例患者2年OS率67.5%,DFS率59.1%。欧洲骨髓移植登记处(EBMT)和国际血液和移植研究中心(CIBMTR)分别对allo-HSCT治疗TRL进行回顾性分析。EBMT报道3年DFS率为33%,OS率为35%;CIBMTR报道5年DFS率为21%,OS率为22%[18,19]。
本组患者治疗效果优于文献报道的可能原因为:(1)本组患者数量少,至随访截止时间有50%患者随访时间不足3年,可能对统计结果产生影响;(2)患者行allo-HSCT时年龄不大,中位年龄为35岁,造血干细胞移植前化疗次数少,脏器功能储备可,体能状态好;(3)采用了个体化的预处理方案[20],根据每例患者实际情况制定预处理方案,尽量做到预处理期间清髓的同时把肿瘤细胞降至最低,移植前评估患者原发病的治疗及TRL起病时情况,若有髓外病变或移植前所有化疗方案均耐药的患者选择以TBI或全身骨髓加淋巴结照射为主的方案;若患者无髓外病变,选择BU为主的方案,并选择性地加用脂溶性强、能较好透过血脑屏障的药物,如大剂量阿糖胞苷、替尼泊苷等,降低移植后复发的概率;(4)移植后早期减停免疫抑制剂,增加供者细胞的GVL效应;其中对于1例植活鉴定即出现MRD阳性的患者,我们通过减停免疫抑制剂等治疗,效果不佳,行CD19阴性嵌合抗原受体T细胞输注后获得再次缓解,DFS时间超过50个月,提示新的靶向治疗药物及治疗方式的出现,可改善此类患者的预后。本研究病例数较少,结论需通过增加病例数、延长随访时间或多中心联合研究进一步验证。
所有作者均声明不存在利益冲突



























