
探讨polatuzumab vedotin(pola)治疗复发难治弥漫大B细胞淋巴瘤(DLBCL)患者的效果和安全性。
回顾性分析2016年5月江苏省肿瘤医院收治的1例多次接受治疗的DLBCL患者的临床资料,并进行文献复习。
该患者为57岁男性,2016年5月诊断为DLBCL,从2016年6月起接受包括抗CD20单抗联合化疗、仅化疗以及嵌合抗原受体T细胞(CAR-T)等在内的四线治疗,但治疗后均复发或进展。于2019年12月起接受pola联合利妥昔单抗6个疗程治疗,治疗过程中无非预期不良反应。治疗结束后临床疗效评价为完全缓解。随访截至2021年1月,患者无进展生存时间超过13个月。
pola在复发难治DLBCL患者的治疗中初步显示了良好的有效性和安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是发病率最高的淋巴瘤亚型[1]。DLBCL一线治疗的5年总生存(OS)率为60%~70%,近50%患者治疗后复发[2]。复发难治DLBCL患者接受二线治疗后的中位OS时间为9.7个月,接受三线治疗患者的中位OS时间仅为6.3个月[3]。为探索复发难治DLBCL患者的治疗方案,使更多的复发难治DLBCL患者获益,我们参加了国内同情用药项目(临床试验注册号:NCT 04624893),该项目旨在为多线治疗(含标准一线治疗及至少两线以上解救治疗)失败且不适合接受自体造血干细胞移植(ASCT)的DLBCL患者免费提供含polatuzumab vedotin(pola)的治疗。现对我院收治的1例DLBCL患者接受pola同情用药的治疗情况进行报道,并进行文献复习。
患者,男性,57岁。2016年5月无明显诱因出现左侧颈部、双侧腹股沟肿物,肿块逐渐增大,无B症状。CT检查:两侧颈部、两侧锁骨上、纵隔及腋窝、两侧盆壁、腹股沟区多发淋巴结肿大。肘关节磁共振检查:双侧肘窝散在弥散受限轻、中度强化结节,结合病史考虑受累及肿大淋巴结。病理及免疫组织化学结果:c-myc、bcl-6 10%阳性,CD20、LCA+++,CD3、CD5背景T细胞阳性,cyclin D1、CD10阴性,Ki-67阳性指数50%,bcl-2 80%+++,MUM1 50%+++,CD21滤泡树突细胞网状阳性。诊断为DLBCL,非生发中心B细胞(non-GCB)。
患者于2016年6月20日至10月10日接受6个周期R-CHOP方案治疗,具体为利妥昔单抗686 mg第1天,环磷酰胺1.4 g第2天,盐酸多柔比星92 mg第2天,长春新碱2 mg第2天,泼尼松100 mg第2天至第6天。治疗结束后评估疗效为不确定的完全缓解(CRu)。2017年11月1日疾病进展(PD),2017年12月至2018年3月行ICE方案治疗6个周期,具体为依托泊苷0.17 g第1天至第3天,卡铂0.47 g第2天,异环磷酰胺8.4 g第2天,疗效评估CR。2018年8月PET-CT检查示病情复发,颈、胸、腹、盆部多发淋巴结较前增大,多处氟代脱氧葡萄糖(FDG)代谢增高。后予EPOCH方案治疗4个疗程,最终疗效评估为部分缓解(PR)。因经济情况受限,在获得缓解后,未接受ASCT。2019年7月18日复查颈、胸、腹CT及PET-CT均提示PD。随后参加JWCAR029[CD19靶向嵌合抗原受体T细胞(CAR-T)注射]研究,于2019年8月29日行CAR-T治疗。2019年11月14日PET-CT提示PD(图1)。发病以来,患者一般状况良好,饮食正常,睡眠正常,大小便正常。既往体健,高血压病史3年余。
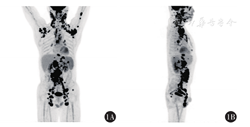

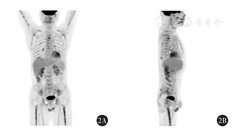
患者于2019年12月自愿参加pola的同情用药项目,决定给予pola联合利妥昔单抗治疗。治疗前诊断分期为DLBCL,non-GCB型,ⅢA期,美国东部肿瘤协作组(ECOG)评分1分。2019年12月11日给予利妥昔单抗+ pola治疗,利妥昔单抗700 mg静脉滴注第1天,pola 125 mg静脉滴注第2天90 min,每3周重复。第1个疗程利妥昔单抗输注过程中出现了畏寒和发热的首次输注反应症状,对症处理后缓解;pola输注过程顺利。随后进行后续5个疗程相同方案的治疗,至2020年4月10日治疗结束,患者无发热、盗汗、呼吸困难、体质量减轻、呕吐、胸痛或腹痛等不良事件发生。治疗2个疗程复查CT,与2019年11月14日CT检查结果比较,两侧颈血管鞘区、颈后三角、两侧颌下、须下、两侧颈根部、两侧锁骨上、两侧腋窝、纵隔、腹腔及腹膜后、两侧盆壁、腹股沟多发稍大淋巴结,较前明显缩小,中期疗效评价为PR。2020年5月治疗结束后疗效评价示,PET-CT结果与基线比较,原各处病灶淋巴结体积均明显减小,FDG代谢明显减低,且不高于正常值,临床疗效评价为CR(图2)。2020年9月及2021年1月增强CT结果均显示未见复发,至截稿前患者无进展生存时间已超过13个月。

50%的复发难治DLBCL患者因为年龄大、合并疾病多、无法接受挽救治疗或效果不佳等因素无法行ASCT[2,4]。其他治疗选择包括含吉西他滨的治疗方案联合或不联合利妥昔单抗、苯达莫司汀联合或不联合利妥昔单抗、来那度胺联合或不联合利妥昔单抗等[5]。目前,CD19 CAR-T疗法已被批准用于三线或以上的治疗,但常缺乏有效的桥接治疗,且CAR-T治疗因不良反应相对较大、成本高、治疗机会有限和需要专门的治疗中心而受限[6,7]。因此对于那些不适合移植的复发难治DLBCL患者,包括ASCT治疗失败的患者,仍然存在大量未满足的医疗需求。
pola是靶向CD79b的抗体偶联物(ADC),能与细胞表面抗原CD79b结合,触发内化,将偶联的强效微管破坏药物MMAE直接递送入肿瘤细胞中。而96%的B细胞肿瘤表达CD79b分子,这就决定了pola对几乎所有的B细胞淋巴瘤均有一定的疗效[8,9]。
pola的Ⅰ期和Ⅱ期研究已经验证了pola联合利妥昔单抗的疗效和安全性。其中初步的Ⅰ期研究显示了pola单药治疗复发难治非霍奇金淋巴瘤的临床活性和可接受的安全性[10]。随后进行的Ⅱ期ROMULUS研究进一步证实用利妥昔单抗联合pola治疗复发难治DLBCL患者,安全性与pola单药治疗无明显差异。群体药代动力学分析结果表明,利妥昔单抗与pola联合用药似乎使抗体结合MMAE暴露量增加,并使未结合MMAE暴露量降低[11]。此外,GO29365研究最新结果显示,在随机对照的两组中,pola联合苯达莫司汀和利妥昔单抗(pola-BR)组患者的CR率显著高于BR组(40.0%比17.5%,P=0.026)。pola-BR组的中位OS时间显著改善(20.4个月比12.4个月),死亡风险降低58%(HR=0.42,95%CI 0.24~0.75,P=0.002)。pola-BR组3~4级贫血、中性粒细胞减少症和血小板减少症的发生率均高于BR组[12]。因此,pola联合抗CD20单抗和(或)其他药物是有效的临床治疗方案。
本例患者不仅接受过一线R-CHOP方案治疗,而且接受过包括CAR-T疗法在内的共四线治疗,虽然都取得了CR或PR的疗效,但缓解期普遍较短,随后均出现复发或进展,甚至在pola治疗前的CAR-T治疗结束后3个月左右即再次复发或进展。
患者接受的pola联合利妥昔单抗治疗是第五线治疗,耐受性良好,给药过程中和给药结束后均未出现严重或非预期的不良反应。患者在治疗中期疗效评价为PR,治疗结束时获CR,随访至截稿日未见复发,已经超过了多线治疗DLBCL患者的平均无进展生存(PFS)和OS时间,因此含pola的治疗方案对于本例患者安全有效,我们将继续进行其后续生存随访。
本例患者参加的pola治疗方案是中国大陆首个同情用药项目,且是该项目自2019年11月启动以来首例入组的患者,也是目前随访时间最长的患者。该项目后续接受pola和利妥昔单抗联合用药的其他患者还在治疗周期中或进入了随访期,其有效性和安全性数据我们会进一步关注。
总之,pola的临床应用为复发难治DLBCL患者提供了新的治疗选择,同时也需要更多的病例观察以及更长的随访时间,为真实世界中pola的临床用药提供参考。
所有作者均声明不存在利益冲突































