
探讨R2-CHOP(来那度胺+利妥昔单抗+环磷酰胺+长春地辛+表柔比星+地塞米松)方案治疗肠切除弥漫大B细胞淋巴瘤(DLBCL)的效果及安全性。
回顾性分析江苏省泰兴市人民医院2020年11月收治的1例小肠DLBCL患者治疗经过,并复习相关文献。
该患者为原发性小肠DLBCL,接受R2-CHOP方案和R2-ECHOP(R2-CHOP+依托泊苷)方案化疗各1个疗程后,疗效良好,颈部、肺门及纵隔淋巴结缩小,其余淋巴结未见增大,且未出现严重不良反应。
R2-CHOP方案是非生发中心型c-myc阳性DLBCL的有效治疗方案,可提高缓解率、总生存率,延长无进展生存期,且无明显不良反应。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)约占所有淋巴瘤的30%[1],其中伴c-myc和bcl-2或bcl-6基因易位重排的双重打击淋巴瘤(同时存在3种基因易位则称为三次打击淋巴瘤)预后更差[2]。胃肠道是结外淋巴瘤最常累及的部位,占结外非霍奇金淋巴瘤(NHL)的5%~20%[3]。DLBCL累及的肠道病变恶性程度很高。R2-CHOP(来那度胺+利妥昔单抗+环磷酰胺+长春地辛+表柔比星+地塞米松)方案作为DLBCL的新型治疗方案已经在临床上使用,但是在肠道肿瘤中的应用鲜见报道。我们以此方案治疗了1例小肠DLBCL,现报道如下。
患者,女性,53岁,因确诊淋巴瘤2个月余入院。患者2020年10月出现上腹部不适伴发热。外院查PET-CT示:回肠末端及回盲部淋巴瘤,氟代脱氧葡萄糖(FDG)高代谢,伴左侧肺门、锁骨、右侧上颈部、纵隔及腹腔、盆腔多发淋巴结受浸,脾脏多发浸润灶,口咽左侧壁及舌根浸润不除外,全身骨骼FDG代谢欠均匀,双侧肾上腺增生可能,盆腔积液。肠镜病理结果示:DLBCL,非生发中心型。免疫组织化学示:CD20、CD79a、bcl-2、MUM1、bcl-6均阳性,cyclin D1、CD10、CD2、CD3、CD5、CD4、CD8、CD30、CD56均阴性,Ki-67阳性指数约90%,EBER阴性。骨髓象示:骨髓增生活跃,未见淋巴瘤细胞浸润。外院行肿瘤切除并小肠造瘘,术后病理(回肠部肿瘤、大网膜肿瘤)提示DLBCL。免疫组织化学及荧光原位杂交示:肿瘤细胞CD20、bcl-6、MUM1、MNDA均阳性,bcl-2阳性(90%),c-myc阳性(约60%),CD5部分阳性,CD3、CD10、cyclin D1、CD30、CD23、AE1/AE3均阴性,Ki-67阳性指数约90%。EBER阴性;滤泡树突细胞,CD21阳性。患者未在外院化疗,2020年11月2日转至我院。入院查体:贫血貌,全身浅表淋巴结未触及肿大;心肺听诊无异常;腹软,下腹部见小肠造瘘口,肝脾肋缘下未触及,双下肢无水肿;病理反射未引出。实验室检查示:红细胞计数1.6×1012/L,血红蛋白(Hb)50 g/L,白细胞计数(WBC)3.72×109/L,血小板计数(Plt)96×109/L。凝血酶原时间17.4 s,纤维蛋白原3.62 g/L,D-二聚体601 ng/ml。
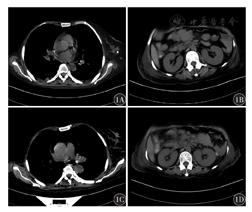
患者既往有高血压病史8年,血压最高达160/100 mmHg(1 mmHg=0.133 kPa);脑梗死半年,左侧肢体活动稍不便。诊断为DLBCL,Ann Arbor分期Ⅲ期B组,非生发中心型,三次打击淋巴瘤;重度贫血;高血压3级(极高危);脑梗死后遗症。2020年11月5日接受1个疗程R2-CHOP方案治疗,具体为来那度胺25 mg,每日口服,第1天至第14天;利妥昔单抗375 mg/m2,静脉注射,第0天;环磷酰胺750 mg/m2,静脉注射,第1天;表柔比星70 mg/m2,静脉注射,第1天;长春地辛4 mg,静脉注射,第1天;地塞米松15 mg,静脉注射,第1天至第5天。服用来那度胺10 d后Plt降至33×109/L,WBC降至0.49×109/L,遂停用。2020年11月22日胸部CT示:双肺条索影,双侧胸膜增厚,右侧乳腺组织缺如;左乳钙化灶(图1A);全腹部CT示:回肠部肿瘤切除并小肠造瘘术后改变,腹盆腔多发占位,腹腔脂肪间隙模糊,胆囊炎,脾脏低密度灶,腹腔小淋巴结(图1B)。2020年11月24日行1个疗程R2-ECHOP(R2-CHOP方案+依托泊苷)方案化疗,加依托泊苷100 mg/m2,静脉注射,第1天至第3天。8 d后Plt降至19×109/L,WBC为1.06×109/L,再次停用来那度胺。2020年12月21日胸部CT示:两肺下叶炎性改变,右肺新增小结节,双侧胸膜增厚,右肺胸腔少量积液,心包积液,右侧乳腺组织缺如;左乳钙化灶,甲状腺左叶钙化灶(图1C);全腹部CT示:腹盆腔多发占位伴局部渗出,胆囊炎,脾脏低密度灶,胰头增大,盆腔少量积液(图1D)。化疗期间患者出现骨髓抑制,予输注红细胞、血小板、粒细胞集落刺激因子(G-CSF)、血小板生成素(TPO)等对症处理。2次化疗后,患者颈部、肺门及纵隔淋巴结缩小,其余各处淋巴结未见增大。

DLBCL是最常见的NHL,根据肿瘤细胞起源分为生发中心型和非生发中心型。手术切除肿瘤后化疗是当前公认的治疗手段。随着利妥昔单抗的广泛应用,R-CHOP(利妥昔单抗、环磷酰胺、长春新碱、多柔比星和泼尼松)方案逐渐成为DLBCL的一线疗法,但是非生发中心型患者几乎不能通过这种疗法获得治愈[4]。R2-CHOP方案是目前治疗非生发中心型DLBCL的最佳方案。美国的一项Ⅱ期临床试验结果显示,接受R2-CHOP方案治疗的非生发中心型DLBCL患者2年无进展生存(PFS)率为60%,优于接受传统R-CHOP方案治疗患者的28%[5]。研究发现,来那度胺可下调c-myc及其靶基因,从而为c-myc阳性DLBCL患者提供新的治疗选择。一项针对c-myc阳性DLBCL的前瞻性试验显示,R2-CHOP方案的总生存(OS)率和2年无事件生存(EFS)率分别达73%和63%[6]。
Yang等[7]报道了1例接受了5个疗程来那度胺联合利妥昔单抗治疗的颈前部、腹部和小腿多灶性DLBCL患者,化疗后原淋巴瘤病灶迅速萎缩。Tomuleasa等[8]也证实了来那度胺联合利妥昔单抗在对R-CHOP方案无反应的颈部复发性DLBCL患者中的作用价值,患者达到完全代谢缓解,6个月内无复发。还有研究报道了发生于颈部、扁桃体和肺部的DLBCL,患者分别接受6、3个疗程的R2-CHOP方案治疗,复查发现病灶均消失[9,10]。国内也有研究以R2为基础的化疗方案治疗原发于胃窦、复发于颈部和原发于中枢神经系统的DLBCL,效果良好[11,12]。
血液学反应是R2-CHOP方案最常见的不良反应,包括中性粒细胞计数、WBC、Plt、Hb减少等。疼痛、皮疹、乏力、肺炎是常见的非血液学不良反应。目前研究表明R2-CHOP方案安全性良好,较少引起严重的不良反应。
总之,本例为原发于小肠回盲部的非生发中心型三次打击淋巴瘤,接受2个疗程R2-CHOP方案化疗后未见淋巴结增大,疗效良好。患者耐受性良好,未发生严重不良事件。R2-CHOP方案是目前治疗非生发中心型合并c-myc阳性DLBCL的有效方案,希望进一步开展关于R2-CHOP方案的前瞻性试验,以为临床应用提供更多依据。
所有作者均声明不存在利益冲突



























