Bruton酪氨酸激酶(BTK)抑制剂作为小分子靶向药物,目前已经被批准用于慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、套细胞淋巴瘤和华氏巨球蛋白血症等的治疗。奥布替尼是首创新药,于2020年12月25日获批上市,其在临床实践中的应用数据尚待完善。为了进一步规范奥布替尼在B细胞淋巴瘤中的临床应用,专家组成员结合BTK抑制剂的应用现状及已经公布的奥布替尼相关研究数据,制定了该临床应用指导原则,供临床医生参考使用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
以伊布替尼为代表的Bruton酪氨酸激酶(BTK)抑制剂为B细胞淋巴瘤的治疗带来了突破性进展,但现有BTK抑制剂存在脱靶效应导致的安全性差、靶点抑制不稳定、不完全等临床未解决的问题。我国首创了新型BTK抑制剂奥布替尼,其分子结构进一步优化,具有更小的空间夹角、更少的铰链区H键结合位点,去除了手性中心,提高了激酶选择性,对BTK以外的靶点作用极低,临床研究中未发生3级及以上心房颤动,3级及以上出血和腹泻等因脱靶效应导致的不良反应发生率低,耐受性好,由不良反应导致的停药患者比例仅为4.7%~7.5%[1]。奥布替尼通过固体分散体制剂技术,提高了药物的溶解性,保障药物在150 mg/次、1次/d的治疗剂量下,对患者外周血单核细胞(PBMC)BTK靶点24 h内接近100%持续抑制,BTK靶点占有率个体差异小,有效地避免了因靶点占有率个体差异导致的部分患者疗效不佳现象。与其他已上市BTK抑制剂相比,奥布替尼治疗复发难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)时,缓解得更早,效果更佳[中位随访25.6个月,患者总有效率(ORR)达93.8%,完全缓解(CR)/伴骨髓恢复不完全的完全缓解(CRi)率达21.3%][2];奥布替尼治疗复发难治套细胞淋巴瘤(MCL)的缓解效果亦较佳[中位随访23.2个月,患者ORR达87.9%,CR/不确定的完全缓解(CRu)率达37.3%][3]。
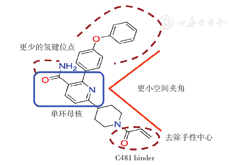
作为新型不可逆共价结合的BTK抑制剂,奥布替尼在第一代BTK抑制剂基础上进行了结构优化,其具有更小的空间夹角,三维结构与BTK活性中心更匹配,提高了BTK的激酶抑制性和选择性;其采用单环母核,减少了铰链区H键结合位点,降低与其他激酶结合的可能,去除手性中心,减少空间构象(图1),从而避免与其他激酶的相互结合,提高了激酶选择性。结构的优化保证了奥布替尼具有最佳激酶选择性,降低了脱靶效应,使奥布替尼拥有更好的疗效和安全性。

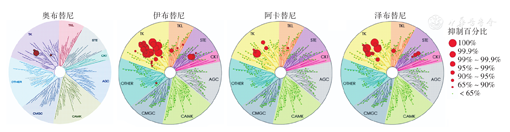
应用KINOMEscan平台测定显示,奥布替尼有更精准的激酶选择性。在对456种激酶的选择性检测中,1 µmol/L奥布替尼仅对BTK的抑制作用超过90%,对其他激酶没有明显抑制作用(图2)[4,5],提示奥布替尼靶区更集中,对其他非目标靶点抑制作用小,拥有最佳激酶选择性。
奥布替尼的制备采用独特的固体分散体制剂技术,提高了溶解性,具有更好的生物利用度和线性药代动力学数据,150 mg/次、1次/d的给药剂量下,血药浓度快速达峰,口服给药吸收的中位达峰时间(Tmax)约为2 h,峰浓度(Cmax)瞬时达到1 200 ng/ml,迅速结合体内BTK靶点至饱和,BTK占有率个体间差异小,且持续24 h。奥布替尼在健康受试者及CLL/SLL、MCL患者中药代动力学未见明显差异,连续服药无明显药物蓄积,也未观察到具有临床意义的食物效应。奥布替尼与人血浆蛋白的可逆结合率为93.5%。
Xu等[2]开展了奥布替尼治疗复发难治CLL/SLL患者的疗效、安全性及耐受性的开放性、多中心Ⅱ期关键性临床研究。共纳入80例患者,中位年龄60岁(范围:36~78岁),基线美国东部肿瘤协作组(ECOG)评分主要为0分或1分(分别占57.5%和36.3%)。87.5%患者为CLL,12.5%患者为SLL;45%的受试者接受过二线及以上治疗。CLL患者均为Binet分期的B期或C期,70%为Rai分期的Ⅲ~Ⅳ期;SLL患者均为Ann Arbor分期的Ⅲ~Ⅳ期。42.5%患者淋巴结长径超过5 cm,13.8%患者淋巴结长径超过10 cm。23.8%患者11q缺失,15.0%患者17p缺失,22.5%患者TP53突变,41.3%患者IGHV未突变。
截至2021年1月16日,80例患者中位随访25.6个月,研究者评估的ORR达93.8%,CR/CRi率达21.3%,部分缓解(PR)率达61.3%,伴淋巴细胞增多的部分缓解(PR-L)率达11.3%。其相同随访时间内的CR/CRi率较其他BTK抑制剂更高,中位起效时间为1.87个月。不同细胞遗传学高危亚组患者ORR如下:17p del者达100.0%,TP53突变者达100.0%,11q Del者为94.7%,IGHV未突变者为93.9%。中位无进展生存(PFS)及总生存(OS)均未达到(表1)。
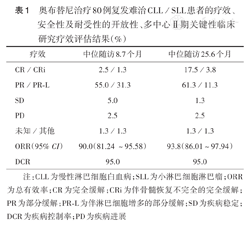
奥布替尼治疗80例复发难治CLL/SLL患者的疗效、安全性及耐受性的开放性、多中心Ⅱ期关键性临床研究疗效评估结果(%)
奥布替尼治疗80例复发难治CLL/SLL患者的疗效、安全性及耐受性的开放性、多中心Ⅱ期关键性临床研究疗效评估结果(%)
| 疗效 | 中位随访8.7个月 | 中位随访25.6个月 |
|---|---|---|
| CR/CRi | 2.5/1.3 | 17.5/3.8 |
| PR/PR-L | 55.0/31.3 | 61.3/11.3 |
| SD | 5.0 | 1.3 |
| PD | 2.5 | 2.5 |
| 未知/其他 | 1.3/1.3 | 1.3/1.3 |
| ORR(95%CI) | 90.0(81.24~95.58) | 93.8(86.01~97.94) |
| DCR | 95.0 | 95.0 |
注:CLL为慢性淋巴细胞白血病;SLL为小淋巴细胞淋巴瘤;ORR为总有效率;CR为完全缓解;CRi为伴骨髓恢复不完全的完全缓解;PR为部分缓解;PR-L为伴淋巴细胞增多的部分缓解;SD为疾病稳定;DCR为疾病控制率;PD为疾病进展
我国研究者开展了奥布替尼治疗复发难治MCL患者的疗效和安全性的开放性、多中心Ⅱ期关键性临床研究[3]。共纳入106例患者,中位年龄为62岁(范围:37~73岁),基线ECOG评分主要为0分或1~2分(分别占46.2%和53.8%),Ⅲ~Ⅳ期患者占94.4%;淋巴结长径≥10 cm的患者占10.4%,40.6%的患者骨髓受侵。54.7%的患者接受过二线及以上治疗,88.7%的患者既往接受过抗CD20单抗治疗。其中20例患者接受奥布替尼100 mg/次、2次/d治疗,86例患者接受奥布替尼150 mg/次、1次/d治疗。
截至2020年12月31日,研究者对99例患者进行了疗效评估,中位随访23.2个月时,CT评估的ORR为87.9%,CR/CRu率为37.3%,中位缓解持续时间(DOR)和PFS时间均为25.7个月(表2)。
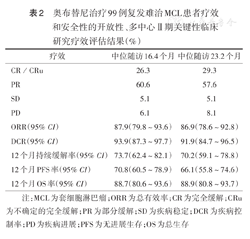
奥布替尼治疗99例复发难治MCL患者疗效和安全性的开放性、多中心Ⅱ期关键性临床研究疗效评估结果(%)
奥布替尼治疗99例复发难治MCL患者疗效和安全性的开放性、多中心Ⅱ期关键性临床研究疗效评估结果(%)
| 疗效 | 中位随访16.4个月 | 中位随访23.2个月 |
|---|---|---|
| CR/CRu | 26.3 | 29.3 |
| PR | 60.6 | 57.6 |
| SD | 5.1 | 5.1 |
| PD | 6.1 | 8.1 |
| ORR(95%CI) | 87.9(79.8~93.6) | 86.9(78.6~92.8) |
| DCR(95%CI) | 93.9(87.3~97.7) | 91.9(84.7~96.5) |
| 12个月持续缓解率(95%CI) | 73.7(62.4~82.1) | 70.2(59.1~78.8) |
| 12个月PFS率(95%CI) | 70.8(60.5~78.9) | 66.1(55.8~74.6) |
| 12个月OS率(95%CI) | 88.7(80.6~93.6) | 88.9(80.8~93.7) |
注:MCL为套细胞淋巴瘤;ORR为总有效率;CR为完全缓解;CRu为不确定的完全缓解;PR为部分缓解;SD为疾病稳定;DCR为疾病控制率;PD为疾病进展;PFS为无进展生存;OS为总生存
奥布替尼在我国已被获批用于治疗既往至少接受过1种治疗的成年人CLL/SLL和既往至少接受过1种治疗的成年人MCL。可在饭前或饭后口服奥布替尼,推荐剂量为150 mg/次(50 mg/片,3片),1次/d,直至疾病进展或出现不可耐受的不良反应;每天的用药时间应尽量固定,用水送服整片药片,不可掰开、压碎或咀嚼药片。若未在计划时间服用奥布替尼,应在距下次用药至少8 h的前提下尽快服用,第二天继续在正常计划时间服药,不要额外服用奥布替尼弥补漏服剂量[1]。
目前尚未开展正式的奥布替尼药物相互作用临床研究。美国食品药品管理局(FDA)指出,奥布替尼联用细胞色素P450 3A4(CYP3A4)抑制剂或诱导剂时应当谨慎,应避免与重度和中度CYP3A4抑制剂或诱导剂联用(表3)。

细胞色素P450 3A4(CYP3A4)的抑制剂和诱导剂
细胞色素P450 3A4(CYP3A4)的抑制剂和诱导剂
| CYP3A相关制剂 | 重度 | 中度 | 轻度 |
|---|---|---|---|
| 抑制剂 | 波西普韦、克拉霉素、考尼伐坦、葡萄柚汁、茚地那韦、伊曲康唑、酮康唑、洛匹那韦、奈法唑酮、奈非那韦、泊沙康唑、利托那韦、沙奎那韦、特拉匹韦、泰利霉素、伏立康唑 | 安普那韦、阿瑞匹坦、阿扎那韦、环丙沙星、克唑替尼、达芦那韦、利托那韦、地尔硫卓、红霉素、氟康唑 | 阿普唑仑、胺碘酮、氨氯地平、阿托伐他汀、西洛地唑、比卡鲁胺片、西咪替丁、环孢霉素、氟西汀,氟伏沙明、银杏、白毛茛,异烟肼、拉帕替尼、尼洛替尼、口服避孕药帕唑帕尼、雷尼替丁、雷诺嗪、替拉那韦、替格瑞洛、齐留通 |
| 诱导剂 | 阿伐麦布、卡马西平、苯妥英、利福平、圣约翰草 | 波生坦、依法韦伦、依曲韦林、莫达非尼、萘夫西林 | 氨普奈韦、阿瑞匹坦、莫达非尼、吡格列酮、泼尼松、卢非酰胺、维莫非尼 |
奥布替尼在特殊人群中的用药注意事项见表4。

奥布替尼在特殊人群中用药的注意事项
奥布替尼在特殊人群中用药的注意事项
| 特殊人群 | 用药注意事项 |
|---|---|
| 肝功能不全 | 奥布替尼主要在肝脏中通过细胞色素P450 3A4代谢,轻度肝功能不全患者不必进行剂量调整,中度肝功能不全患者需在医师指导下慎用并严密监测肝功能,重度肝功能不全患者禁用 |
| 肾功能不全 | 轻度肾功能不全患者不建议进行剂量调整,中、重度肾功能不全患者需在医师指导下慎用并严密监测肾功能 |
| 老年及儿童 | 老年患者无需进行剂量调整,奥布替尼在儿童患者中的安全性和有效性尚未进行研究 |
奥布替尼安全性的总结来自5项单药治疗B细胞恶性肿瘤的临床试验,共有304例患者接受奥布替尼150 mg/d及以上剂量连续给药治疗。最新公布的安全性数据汇总结果显示,所有患者中仅有1例发生了1次一过性1级心房颤动,没有观察到≥3级心房颤动[6];仅有1例(0.4%)发生了≥3级腹泻;仅有1例(0.4%)复发难治MCL患者发生了第二原发肿瘤。大多数不良事件发生在早期治疗期间,不良事件的发生率在治疗后期降低。
特别关注的相关不良反应发生情况、处理方法及其剂量调整分别见表5和表6。

奥布替尼相关不良反应发生情况及处理方法
奥布替尼相关不良反应发生情况及处理方法
| 不良反应 | 发生情况 | 处理方法 |
|---|---|---|
| 心房颤动 | 未观察到任何3级及以上心律失常 | - |
| 腹泻 | 目前只有1例(0.4%)出现了≥3级腹泻 | - |
| 出血 | 奥布替尼临床研究中仅1.6%的患者发生了≥ 3级出血事件 | 出现≥3级的出血或任何级别的颅内出血时,应终止治疗;服药期间需要手术的患者,应根据手术类型和出血风险对风险获益进行评估;建议在术前至少3 d和术后至少7 d暂停奥布替尼的使用 |
| 感染 | 12.8%的患者发生了≥ 3级感染,其中常见的是感染性肺炎(6.3%) | 对于用药前有严重感染的患者,需在感染得到有效控制后再开始服用奥布替尼;对于机会性感染风险增加的患者,应考虑根据标准治疗进行预防;在治疗期间应监测和评估患者是否出现发热或其他感染的症状和体征,并给予相应治疗;当发生≥ 3级感染时,应暂停奥布替尼的使用,直至感染得到有效控制 |
| 高血压 | 接受奥布替尼治疗的B细胞恶性肿瘤患者中,8.6%发生高血压,2.6%发生≥ 3级高血压 | 患者接受奥布替尼治疗期间,如果出现血压升高,建议密切监测,并咨询相关治疗领域具有专业经验的医生;对于有高血压病史的患者,在接受奥布替尼治疗时,应密切监测血压,严格遵医嘱接受或调整抗高血压治疗方案 |
| 第二原发恶性肿瘤 | 仅有0.7%的患者发生第二原发恶性肿瘤,包括急性髓系白血病(0.3%)和直肠癌复发(0.3%),且经研究者判断可能与药物无关 | - |
| 血细胞减少症 | 18.4%的患者曾发生≥ 3级血细胞减少症,其中常见的是中性粒细胞减少症(11.8%)、血小板减少症(8.6%)、贫血(5.6%)和白细胞减少症(3.9%) | 治疗期间需密切监测全血细胞数,如发生血细胞减少,可根据临床需求进行治疗,给予升血小板药物和粒细胞集落刺激因子升白细胞 |
注:-为无此项
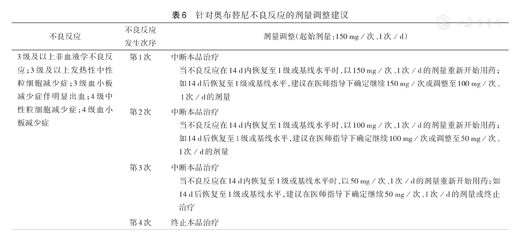
针对奥布替尼不良反应的剂量调整建议
针对奥布替尼不良反应的剂量调整建议
| 不良反应 | 不良反应发生次序 | 剂量调整(起始剂量:150 mg/次、1次/d) | |
|---|---|---|---|
| 3级及以上非血液学不良反应;3级及以上发热性中性粒细胞减少症;3级血小板减少症伴明显出血;4级中性粒细胞减少症;4级血小板减少症 | 第1次 | 中断本品治疗 | |
| 当不良反应在14 d内恢复至1级或基线水平时,以150 mg/次、1次/d的剂量重新开始用药;如14 d后恢复至1级或基线水平,建议在医师指导下确定继续150 mg/次或调整至100 mg/次、1次/d的剂量 | |||
| 第2次 | 中断本品治疗 | ||
| 当不良反应在14 d内恢复至1级或基线水平时,以100 mg/次、1次/d的剂量重新开始用药;如14 d后恢复至1级或基线水平,建议在医师指导下确定继续100 mg/次或调整至50 mg/次、1次/d的剂量 | |||
| 第3次 | 中断本品治疗 | ||
| 当不良反应在14 d内恢复至1级或基线水平时,以50 mg/次、1次/d的剂量重新开始用药;如14 d后恢复至1级或基线水平,建议在医师指导下确定继续50 mg/次、1次/d的剂量或终止治疗 | |||
| 第4次 | 终止本品治疗 | ||
随着癌症治疗临床实践的快速发展,目前上市的抗肿瘤药物尚不能完全满足肿瘤患者的用药需求,药品说明书也往往滞后于临床实践。特殊情况下抗肿瘤药物的使用权应当仅限于三级医院授权的具有高级专业技术职称的医师,并充分遵循患者知情同意的原则,同时应当做好用药监测和跟踪观察。为更好地满足患者临床用药需求,正在开展以下奥布替尼相关临床研究,以积累临床用药经验。
在美国开展了一项奥布替尼治疗B细胞恶性肿瘤安全性和有效性的Ⅰ期临床试验(ICP-CL-00107)。该试验评估不同剂量组(100 mg/次、1次/d及150 mg/次、1次/d)B细胞恶性肿瘤患者应用奥布替尼的安全性、耐受性、有效性和药代动力学特性。2019年5月美国FDA批准开展奥布替尼Ⅰ期临床试验研究。截至2020年12月,7家研究中心参与该研究,12例受试者接受了奥布替尼治疗,其中3例受试者进入低剂量组(100 mg/次、1次/d),9例受试者进入了高剂量组(150 mg/次、1次/d),最早的受试者已经随访13个治疗周期(1个治疗周期为28 d),在全部受试者中未发现剂量限制毒性。此项试验仍在进行之中,整个试验预计在2022年完成。
一项随机Ⅱ期临床试验结果显示,在≥65岁的患者中,伊布替尼+R-CHOP方案相关意外毒性的增加导致了R-CHOP方案暴露减少,这可能是导致伊布替尼+R-CHOP方案治疗失败的原因;亚组分析显示伊布替尼+R-CHOP方案可能改善<60岁及双表达的非生发中心B细胞(GCB)型DLBCL患者的生存[7],2021版中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南推荐包括BTK抑制剂、嵌合抗原受体T细胞(CAR-T)在内的新型药物用于治疗复发难治DLBCL患者[8]。
目前正在开展的一项奥布替尼联合重组人源化Ⅱ型抗CD20单抗MIL-62注射液治疗复发难治CD20+ B细胞淋巴瘤的临床研究也在进行中。MIL-62注射液单药在Ⅰ、Ⅱ期临床试验中均显示了良好的安全性和疗效,联合用药有望为复发难治B细胞淋巴瘤患者提供更好的治疗选择。目前,BTK抑制剂单药或联合方案治疗DLBCL的数据有限,期待临床开展更多的研究,积累更多经验。
临床前研究显示奥布替尼可通过血脑屏障。一项开放性、多中心、Ⅱ期临床研究(ICP-CL-00106)正在进行中,其旨在评价奥布替尼治疗复发难治原发或继发CNSL的初步疗效及安全性。探索性评价奥布替尼在受试者外周血和脑脊液中的药代动力学特征初步结果显示,在各BTK抑制剂给药剂量下,奥布替尼的脑脊液浓度较伊布替尼的脑脊液浓度高[9,10]。
2021版CSCO淋巴瘤诊疗指南指出,对于复发难治CNSL患者,可以将BTK抑制剂±化疗(2B类)作为治疗选择[8]。
一项评价奥布替尼治疗复发难治MZL患者安全性和有效性的多中心、开放性Ⅱ期临床研究(ICP-CL-00104)正在进行中。初步研究结果显示,奥布替尼有较好的疗效、安全性和耐受性。
一项评价奥布替尼治疗复发难治WM安全性和有效性的多中心、开放性临床试验(ICP-CL-00105)正在进行中。初步结果显示奥布替尼具有良好的疗效与安全性。
奥布替尼在患者体内24 h内可接近100%稳定持久地抑制BTK靶点,个体间变异度小,并且具有更高的激酶选择性,脱靶效应少,安全性高。临床研究中未发生3级及以上心房颤动,3级及以上出血和腹泻等因脱靶效应导致的不良事件发生率低。作为新型的BTK抑制剂,奥布替尼为B细胞淋巴瘤临床治疗提供了新的选择。
执笔 马军、朱军、赵东陆
审阅 沈志祥
专家组成员(按姓氏汉语拼音字母排序)白鸥(吉林大学第一医院)、蔡清清(中山大学肿瘤防治中心)、曹军宁(复旦大学附属肿瘤医院)、黄慧强(中山大学肿瘤防治中心)、纪春岩(山东大学齐鲁医院)、金洁(浙江大学医学院附属第一医院)、李建勇(江苏省人民医院)、刘爱春(哈尔滨医科大学附属肿瘤医院)、马军(哈尔滨血液病肿瘤研究所)、牛挺(四川大学华西医院)、邱录贵(中国医学科学院血液病医院)、宋永平(郑州大学附属肿瘤医院)、宋玉琴(北京大学肿瘤医院)、吴德沛(苏州大学附属第一医院)、徐卫(江苏省人民医院)、张明智(郑州大学附属第一医院)、张会来(天津市肿瘤医院)、张延清(哈尔滨医科大学附属第二医院)、赵东陆(哈尔滨血液病肿瘤研究所)、赵维莅(上海交通大学医学院附属瑞金医院)、朱军(北京大学肿瘤医院)
所有作者均声明不存在利益冲突