
探讨预后营养指数(PNI)及临床特征对弥漫大B细胞淋巴瘤(DLBCL)患者预后的影响。
回顾性分析2014年11月至2018年12月徐州医科大学附属医院收治的236例DLBCL患者临床资料。采用X-Tile软件和限制立方样条(RCS)确定PNI、年龄、血红蛋白的最佳截断值;采用Cox比例风险回归模型进行单因素和多因素生存分析;Kaplan-Meier法分析患者总生存(OS)情况,并进行log-rank检验。
236例患者中共115例(48.7%)死亡,中位OS时间32个月。患者3年OS率46%,5年OS率36%。PNI的最佳截断值为49,PNI和DLBCL预后不良风险之间表现为显著的非线性关系(χ2=34.64,P<0.01);剂量-反应关系分析表明,随着PNI的变化,预后不良风险的关联强度呈非线性下降。年龄的最佳截断值为63岁,年龄与DLBCL预后不良风险的关联强度呈非线性上升趋势(χ2=14.86,P=0.022)。使用X-Tile软件计算血红蛋白的最佳截断值为93 g/L和129 g/L。多因素分析结果显示,PNI、中枢神经系统是否受累、肝脏是否受累、年龄、血红蛋白、国际预后指数(IPI)评分、是否有大包块是DLBCL患者OS独立影响因素(均P<0.05)。生发中心B细胞(GCB)型、bcl-2阳性、bcl-6阳性患者中,PNI<49和PNI≥49患者3年OS率差异均有统计学意义(均P<0.05)。
PNI在DLBCL患者预后评估中具有一定的价值,PNI≥49提示患者预后良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是最常见的成年人非霍奇金淋巴瘤(NHL)亚型,占所有NHL 30%~40%[1],具有高度异质性和侵袭性,约40%患者因难治、复发而不能治愈[2]。研究表明,部分实验室检查指标和生物学标志物与DLBCL患者的预后有关[3,4,5,6]。基于血清清蛋白水平和淋巴细胞数量的预后营养指数(PNI)是反映机体营养状况和全身炎症的指标,与恶性肿瘤的预后有一定相关性[7]。PNI可用于评估外科手术风险、预测手术患者的营养及免疫状况[8],也可应用于评估NK/T细胞淋巴瘤、滤泡性淋巴瘤、肺癌等患者的预后不良风险[9,10,11]。目前关于PNI与DLBCL患者预后的相关研究较少,本研究探讨PNI以及患者临床特征对DLBCL预后的影响。
纳入标准:(1)初诊患者;(2)病理诊断明确;(3)有完整的临床资料和随访数据。排除标准:(1)伴有不同程度影响患者淋巴细胞水平和清蛋白水平的疾病,如肝炎、肝硬化、慢性肾脏疾病等;(2)伴有其他肿瘤相关疾病;(3)特殊类型的DLBCL(原发胃肠大B细胞淋巴瘤、原发中枢神经系统和原发睾丸大B细胞淋巴瘤以及原发纵隔大B细胞淋巴瘤)。根据纳入、排除标准,收集2014年11月至2018年12月徐州医科大学附属医院确诊的236例初诊DLBCL患者临床资料。所有患者均经两名病理医生共同确诊,且符合世界卫生组织(WHO)2017版淋巴造血系统肿瘤分类标准。本研究符合2013年修订的《赫尔辛基宣言》的要求,患者及家属均知情同意。
收集患者的临床资料,包括年龄、性别、美国东部肿瘤协作组(ECOG)体力状态(PS)评分、Ann Arbor分期、B症状、清蛋白、淋巴细胞计数、血小板计数、红细胞计数、血红蛋白、乳酸脱氢酶(LDH)以及骨髓和肝、脾受累等情况,同时收集患者免疫组织化学分析结果。计算PNI。
PNI=血清清蛋白(g/L)+5×血淋巴细胞计数(×109/L)[12]
通过查阅患者的住院病历和拨打电话对患者的生存情况进行随访。总生存(OS)时间为患者从确诊至因任何原因死亡或末次随访的时间。随访截止日期为2020年5月1日,中位随访时间33.5个月(29.0~38.0个月)。
236例患者中男性116例,女性120例;中位年龄63岁(10~91岁);Ann Arbor分期Ⅲ~Ⅳ期91例(38.6%),Ⅰ~Ⅱ期145例(61.4%);ECOG PS评分≥2分50例(21.2%),<2分186例(79.8%);IPI评分≥3分70例(29.7%),<3分166例(70.3%);生发中心B细胞(GCB)型85例(36.0%),非生发中心B细胞(non-GCB)型151例(64.0%);有B症状29例(12.3%);有大包块8例(3.4%)。
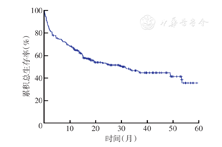
至随访结束,236例患者中115例(48.7%)死亡。患者中位OS时间为32个月,3年OS率为46%,5年OS率为36%(图1)。

使用RCS模型(3结点)模拟PNI、年龄与DLBCL预后不良风险之间的关系。PNI的cut-off值为49,PNI和DLBCL预后不良风险之间表现为显著的非线性关系(χ2=34.64,P<0.01);剂量-反应关系分析表明,随着PNI的变化,预后不良风险的关联强度呈非线性下降(图2A)。年龄的cut-off值为63岁,年龄与DLBCL预后不良风险的关联强度呈非线性上升趋势(χ2=14.86,P=0.022),当年龄≥63岁时,风险比逐渐升高(图2B)。使用X-Tile软件计算血红蛋白的cut-off值为93 g/L和129 g/L,χ2取得最大值28.06和13.10(P<0.01)。
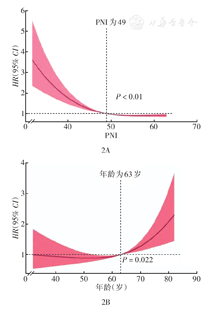

注:RCS为限制立方样条;PNI为预后营养指数;DLBCL为弥漫大B细胞淋巴瘤
单因素Cox回归分析结果显示,PNI、年龄、血红蛋白、IPI、Ann Arbor分期、ECOG PS评分、β2微球蛋白(β2-MG)、LDH、肝脏是否受累、中枢神经系统是否受累、bcl-2、铁蛋白、是否有大包块是DLBCL患者OS的影响因素(均P<0.05)。对单因素分析中有意义的指标进行多因素Cox回归分析,最终共有7个变量进入多因素Cox比例风险回归模型中,结果显示PNI、中枢神经系统是否受累、肝脏是否受累、血红蛋白、IPI评分、年龄、是否有大包块是DLBCL患者OS的独立影响因素(均P<0.05)(表1)。
DLBCL患者总生存多因素Cox比例风险回归分析结果
DLBCL患者总生存多因素Cox比例风险回归分析结果
| 变量 | HR(95%CI) | P值 |
|---|---|---|
| PNI(≥ 49比<49) | 0.635(0.424~0.953) | 0.028 |
| 中枢神经系统受累(是比否) | 3.098(1.821~5.270) | <0.01 |
| 肝脏受累(是比否) | 2.371(1.184~4.748) | 0.015 |
| 血红蛋白a | 0.596(0.423~0.838) | 0.003 |
| IPI评分(0~1分比≥ 2分) | 1.361(1.042~1.776) | 0.023 |
| 年龄(≥ 63岁比<63岁) | 1.586(1.049~2.399) | 0.029 |
| 大包块(是比否) | 2.412(1.017~5.720) | 0.046 |
注:DLBCL为弥漫大B细胞淋巴瘤;PNI为预后营养指数;IPI为国际预后指数;a为连续变量
85例GCB型患者中,PNI<49和PNI≥49患者3年OS率分别为31%和70%,差异有统计学意义(P<0.01);151例non-GCB型患者中,PNI<49和PNI≥49患者3年OS率分别为28%和51%,差异无统计学意义(P=0.086)。163例bcl-2阳性患者中,PNI<49和PNI≥49患者3年OS率分别为27%和52%,差异有统计学意义(P<0.01);73例bcl-2阴性患者中,PNI<49和PNI≥49患者3年OS率分别为51%和74%,差异无统计学意义(P=0.110)。201例bcl-6阳性患者中,PNI<49和PNI≥49患者3年OS率分别为30%和59%,差异有统计学意义(P<0.01);35例bcl-6阴性患者中,PNI<49和PNI≥49患者3年OS率分别为25%和48%,差异无统计学意义(P=0.066)(图3)。
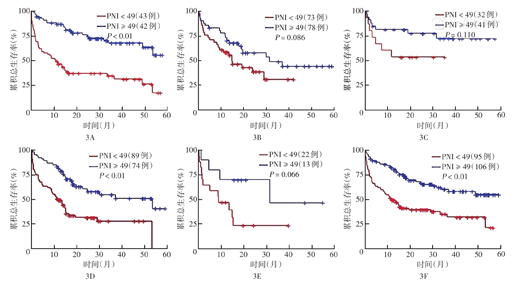

注:DLBCL为弥漫大B细胞淋巴瘤;PNI为预后营养指数;GCB型为生发中心B细胞型;non-GCB型为非生发中心B细胞型;采用限制立方样条模型模拟PNI的最佳截断值为49
IPI、经年龄校正的国际预后指数(aa-IPI)、改良国际预后指数(NCCN-IPI)等是目前临床上用于DLBCL预后分层的主要指标。在利妥昔单抗联合化疗时代,IPI区分不同风险群体(如中高危及高危组)的预后能力下降[15]。比IPI更加精细化的NCCN-IPI,对于DLBCL患者具有更好的预后分层能力,但是它只基于患者的临床特征来评估预后,且对老年DLBCL患者的预后分层具有局限性[16]。本研究结果提示,初诊时的PNI计算方法简便易行,能对部分亚组患者的预后进行分层,在一定程度上可作为DLBCL患者可靠的临床预后指标。
机体的营养状态与免疫功能密切相关,营养状态在一定程度上可影响机体的免疫功能,导致免疫功能失调,从而促进肿瘤的增殖和进展[17]。Onodera等[12]提出由血清清蛋白水平和外周血淋巴细胞数量计算所得的PNI,可作为一种新的、客观的营养评估指标。它最初被用来评估胃肠道肿瘤患者的营养状况和手术风险,现已被广泛认为与某些实体恶性肿瘤和血液系统恶性肿瘤患者的预后具有相关性[18,19]。本研究结果表明,初诊时PNI是DLBCL患者OS的独立影响因素(HR=0.635,95%CI 0.424~0.953,P=0.028),且PNI≤49患者通常预后不良。这与Zhou等[7]的回顾性分析结果相似。低PNI是DLBCL患者无病生存(EFS)和OS的独立影响因素,低PNI组患者IPI评分较高、完全缓解(CR)率较低(均P<0.05)。与以往研究结果不同[19,20],本研究使用RCS软件计算PNI的cut-off值为49,Go等[21]的研究计算PNI的cut-off值为40。进一步的分析显示,使用本研究的cut-off值时,PNI能使患者的分层更加准确(P<0.01)。
本研究236例患者中位年龄63岁,3年OS率46%,这与多数研究结果相一致。本研究单因素分析显示初诊时的PNI、年龄、血红蛋白、IPI、Ann Arbor分期、ECOG PS评分、β2-MG、LDH、肝脏是否受累、中枢神经系统是否受累、bcl-2、铁蛋白、是否有大包块是DLBCL患者预后的影响因素(P<0.05)。多因素分析显示,PNI、中枢神经系统是否受累、血红蛋白、肝脏是否受累、IPI、年龄、是否有大包块为DLBCL预后的独立影响因素(P<0.05)。Ann Arbor分期、ECOG PS评分等在单因素分析中对预后有影响,但多因素分析中并非独立的预后因素,与既往相关研究的多因素分析结果不符,这可能与不同患者的临床特征不同有关。同时,本研究结果显示PNI、年龄与DLBCL预后不良风险之间呈非线性效应。当PNI≥49时,DLBCL患者的预后不良风险比呈非线性下降;当年龄≥63岁时,DLBCL患者的预后不良风险比逐渐升高。表明低PNI和年龄较大的患者预后不良风险可能会增加。本研究也探讨了PNI在部分亚组中的预后价值,结果发现PNI能区分患者的不同预后结局。在GCB型、bcl-2阳性以及bcl-6阳性患者中,PNI≥49的患者比PNI<49的患者具有更好的OS(均P<0.01)。总之,在DLBCL治疗新时代,我们应该将临床特征与免疫组织化学指标结合,才能更准确地判断患者的生存预后结局。
本研究的优点在于:(1)排除了某些特殊类型的DLBCL及其他肿瘤相关疾病,在一定程度上避免了患者接受预处理对预后产生的影响;(2)收集和调整了大多数潜在的预后因素,一定程度上避免了研究结果的偏差和缺陷;(3)使用RCS计算出PNI cut-off值,同时通过亚组分析证明PNI可对GCB组、bcl-2阳性组和bcl-6阳性组患者进行精准分层。但是本研究样本量相对较少,且属于单中心的回顾性研究,结论还需要大量前瞻性研究加以验证。
综上所述,基于血清清蛋白和淋巴细胞计数计算的PNI对预测DLBCL患者预后具有一定价值,由于PNI较易获取且收集方便,因此在一定程度上有助于临床医师的临床决策。未来还需大量前瞻性的多中心研究证实这一结论,从而为淋巴瘤的个体化诊断和治疗提供更为有用的指导。
所有作者均声明不存在利益冲突































