
探讨初治急性髓系白血病(AML)患者诱导化疗后外周血淋巴细胞和单核细胞比值(LMR)在疗效评估及预后判断中的价值。
回顾性分析山东省菏泽市立医院2015年1月至2020年1月收治的诱导化疗后1周血涂片初步镜检未见白血病细胞的初治AML(非急性早幼粒细胞白血病)患者的临床资料。应用受试者工作特征(ROC)曲线确定完成全部诱导化疗后1周LMR预测患者完全缓解(CR)的最佳临界值,并依据此值将患者分为低LMR组(LMR<最佳临界值)和高LMR组(LMR≥最佳临界值),比较两组患者临床特征和实验室检测指标的差异及两组疗效、复发及生存情况。
63例患者入组。完成全部诱导化疗后1周中位LMR为3.64(0.13~88.01),诱导化疗1个疗程后达CR 51例(81.0%),2个疗程后达CR 54例(85.7%),最终CR患者56例(88.9%)。经ROC曲线分析,确定LMR最佳临界值为1.515。低LMR组和高LMR组分别有20例和43例。两组间年龄、性别、血红蛋白、骨髓原始细胞比例、白细胞计数、血小板计数、乳酸脱氢酶水平差异均无统计学意义(均P>0.05)。低LMR组和高LMR组1个疗程后CR率分别为65.0%(13/20)、88.4%(38/43),差异有统计学意义(χ2=4.836,P=0.028)。低LMR组1个疗程达CR的13例患者中复发3例,高LMR组1个疗程达CR的38例患者中复发2例;低LMR组和高LMR组两组3年RFS率分别为64%、80%,差异无统计学意义(χ2=2.897,P=0.089);3年OS率分别为84%、80%,差异无统计学意义(χ2=0.136,P=0.712)。
对于完成诱导化疗后1周血涂片镜检未见有核细胞的初治AML患者,LMR可能用于评估疗效和复发情况。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尽管目前白血病在化疗及靶向治疗方面取得了显著进展,但疾病的复发仍很常见。影响急性髓系白血病(AML)患者预后的因素包括发病年龄、初诊时白细胞计数(WBC)和细胞形态学、免疫学、细胞遗传学及分子生物学特征等。其中WT1是从Wilms瘤细胞染色体11p13分离出来的一种抑癌基因,在AML患者中多高表达,对疗效评估及微小残留病监测有重要作用[1]。机体炎性反应和免疫状态的变化也能影响肿瘤患者预后,外周血淋巴细胞与单核细胞比值(LMR)可反映由炎性细胞和炎性因子组成的肿瘤微环境状态。LMR增高的实体肿瘤和血液肿瘤患者对治疗反应差,可影响患者无病生存期和总生存(OS)期[2,3]。有研究发现,初治AML患者诱导化疗后第14天骨髓检查结果能反映个体对化疗的敏感性,预测诱导治疗效果及长期生存[4,5]。本研究综合以上AML患者的预后影响因素,分析化疗后LMR在AML疗效评估及预后判断中的价值,以期为AML患者的精准医疗提供帮助。
回顾性分析2015年1月至2020年1月于我科住院治疗的且诱导化疗后1周血涂片初步镜检200个有核细胞中未见白血病细胞的初治AML(非急性早幼粒细胞白血病)患者临床病理资料。所有患者经MICM确诊,诊断标准参照2016版世界卫生组织(WHO)造血和淋巴组织肿瘤分类标准[6],危组度分层参照欧洲白血病网络(ELN)AML危险度分层体系,分为预后良好组、预后中等组和预后不良组[7]。本研究患者均知情同意,符合2013年修订的《赫尔辛基宣言》要求。
>60岁患者以重组人粒细胞集落刺激因子、阿糖胞苷、阿柔比星或高三尖杉酯碱(CAG或HAG方案)为主进行诱导化疗。其余患者均接受标准剂量阿糖胞苷联合蒽环类为基础的常规诱导化疗方案;完全缓解(CR)后根据ELN危险度分组,选择不同治疗方案,其中,预后良好组进行巩固化疗;预后不良组或预后中等组有合适供者的建议行异基因造血干细胞移植,无移植条件者进行巩固化疗。巩固化疗方案为DA(柔红霉素联合阿糖胞苷)、AA(阿柔比星联合阿糖胞苷)、HA(高三尖杉酯碱联合阿糖胞苷)方案,或中、大剂量阿糖胞苷等。
依据所收集的血常规资料中经XN-9000全自动模块式血液分析仪(日本希森美康株式会社)分类结果的淋巴细胞计数和单核细胞计数,计算完成全部诱导化疗后1周的LMR。
疗效评估标准参考文献[8]。OS时间为AML确诊至任何原因引起死亡或末次随访的时间。无复发生存(RFS)时间为从形态学未见白血病细胞(即CR)至AML复发、任何原因引起死亡或末次随访的时间。随访时间截至2020年6月1日,中位随访时间11个月(1~38个月)。
采用SPSS 21.0软件进行统计分析。计量资料若符合正态分布,以均数±标准差( ±s)表示,两组比较采用t检验;若不符合正态分布,采用中位数(四分位数间距)表示,两组比较采用Mann-WhitneyU检验。计数资料比较采用χ2检验。采用受试者工作特征(ROC)曲线确定初治AML患者预测CR的完成全部诱导化疗后1周的LMR最佳临界值,依据此临界值将患者分为低LMR组(LMR<最佳临界值)和高LMR组(LMR≥最佳临界值)。生存分析采用Kaplan-Meier法,并行log-rank检验。P<0.05为差异有统计学意义。
±s)表示,两组比较采用t检验;若不符合正态分布,采用中位数(四分位数间距)表示,两组比较采用Mann-WhitneyU检验。计数资料比较采用χ2检验。采用受试者工作特征(ROC)曲线确定初治AML患者预测CR的完成全部诱导化疗后1周的LMR最佳临界值,依据此临界值将患者分为低LMR组(LMR<最佳临界值)和高LMR组(LMR≥最佳临界值)。生存分析采用Kaplan-Meier法,并行log-rank检验。P<0.05为差异有统计学意义。
最终收集63例符合要求的初治AML患者,其中男性34例,女性29例;中位年龄49岁(17~77岁);按照WHO分型:非特殊类型AML 51例(M2 15例,M4 6例,M5 27例,M6 1例,未分型2例),AML伴t(8;21)10例,AML伴inv(16)2例。ELN危险度分组:预后良好7例,预后中等52例,预后不良4例。初治时,外周血中位WBC 19.18×109/L[(0.67~325.41)×109/L],中位血红蛋白65 g/L(22~115 g/L),中位血小板计数(Plt)39×109/L[(7~447)×109/L],中位乳酸脱氢酶(LDH)364 U/L(104~2 556 U/L),中位骨髓原始细胞比例0.41(0.21~0.97);中位WT1 751.69(87.46~7 051.94)。完成全部诱导化疗后1周,外周血中位WBC 1.71×109/L[(0.11~9.29)×109/L],中位血红蛋白71 g/L[(26~113)g/L],中位Plt 16×109/L[(1~302)× 109/L],中位淋巴细胞计数0.79×109/L[(0.08~3.22)×109/L],中位单核细胞计数0.12×109/L[(0.01~1.96)×109/L],中位中性粒细胞计数0.30×109/L[(0.01~5.18)×109/L],中位LMR 3.64(0.13~88.01)。诱导化疗1个疗程后中位WT1水平为15.02(0.51~90.7)。
LMR预测CR的ROC曲线下面积为0.920(95%CI 1.169~4.081,P<0.01)。根据约登指数最大值(0.712),确定LMR最佳临界值为1.515。依据此值分组后,低LMR组20例,高LMR组43例。低LMR组中位LMR 0.68(0.13~1.49);年龄≥60岁5例(25.0%);预后良好1例(5.0%),预后中等16例(80.0%),预后不良3例(15.0%)。高LMR组中位LMR 8.02(1.56~88.01);年龄≥ 60岁11例(25.6%);预后良好6例(14.0%),预后中等36例(83.7%),预后不良1例(2.3%)。两组患者初诊时临床特征及实验室检测指标比较,差异均无统计学意义(均P>0.05)(表1)。
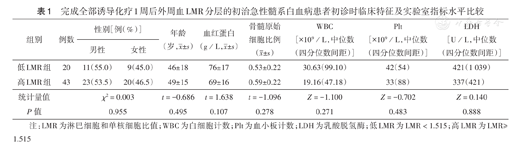
完成全部诱导化疗1周后外周血LMR分层的初治急性髓系白血病患者初诊时临床特征及实验室指标水平比较
完成全部诱导化疗1周后外周血LMR分层的初治急性髓系白血病患者初诊时临床特征及实验室指标水平比较
| 组别 | 例数 | 性别[例(%)] | 年龄(岁, ±s) ±s) | 血红蛋白(g/L, ±s) ±s) | 骨髓原始细胞比例( ±s) ±s) | WBC[×109/L,中位数(四分位数间距)] | Plt[×109/L,中位数(四分位数间距)] | LDH[U/L,中位数(四分位数间距)] | |
|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | ||||||||
| 低LMR组 | 20 | 11(55.0) | 9(45.0) | 46±18 | 76±17 | 0.53±0.22 | 30.63(99.10) | 42(54) | 421(1 039) |
| 高LMR组 | 43 | 23(53.5) | 20(46.5) | 49±15 | 69±16 | 0.59±0.22 | 19.16(47.18) | 33(88) | 337(421) |
| 统计量值 | χ2=0.003 | t=-0.686 | t=1.638 | t=-1.096 | Z=-1.100 | Z=-0.702 | Z=0.140 | ||
| P值 | 0.955 | 0.495 | 0.107 | 0.278 | 0.271 | 0.483 | 0.888 | ||
注:LMR为淋巴细胞和单核细胞比值;WBC为白细胞计数;Plt为血小板计数;LDH为乳酸脱氢酶;低LMR为LMR<1.515;高LMR为LMR≥1.515
低LMR组和高LMR组诱导化疗1个疗程后CR率分别为65%(13/20)、88%(38/43),差异有统计学意义(χ2=4.836,P=0.028)。两组诱导化疗后WT1基因表达水平下降>1个数量级患者CR率和RFS率均升高(χ2=5.891,P=0.015;χ2=4.168,P=0.041)。
5例患者CR后未行巩固治疗;51例巩固化疗患者中,2例行异基因造血干细胞移植。63例患者中,诱导化疗1个疗程后达CR 51例(81.0%),2个疗程后达CR 54例(85.7%),最终CR患者56例(88.9%)。
诱导化疗1个疗程后达CR的51例患者中复发5例。低LMR组达CR的13例患者中复发3例,高LMR组达CR的38例患者中复发2例。高LMR组和低LMR组3年RFS率分别为80%、64%,差异无统计学意义(χ2=2.897,P=0.089);3年OS率分别为80%、84%,差异无统计学意义(χ2=0.136,P=0.712)(图1)。
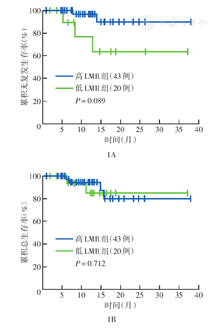

注:LMR为淋巴细胞和单核细胞比值;低LMR为LMR<1.515;高LMR为LMR≥1.515
虽然约80% AML患者经过标准诱导治疗可获得CR,而且随着分子水平研究的不断深入,更多更好的靶向治疗药物相继问世,使得AML患者的生存期有所延长,然而大部分患者最终仍可能因疾病进展而死亡,提示AML的进展存在其他机制。机体炎性反应及免疫状态的变化与肿瘤的发生、发展密切相关,并影响肿瘤患者的预后[9]。作为机体免疫系统重要组成部分的淋巴细胞,在抑制肿瘤细胞的增殖和迁移中起到了重要作用。外周血淋巴细胞能反映患者对肿瘤细胞的免疫监视能力,淋巴细胞减少,宿主淋巴细胞依赖性抗肿瘤反应减弱,会影响患者预后,增加疾病复发风险[10]。单核细胞计数的升高与肿瘤患者预后不良有关,这可能与单核细胞为骨髓源性抑制细胞相关,在各种免疫逃逸和肿瘤进展中单核细胞扮演着重要的角色。同时,单核细胞通过巨噬细胞释放的血管内皮生长因子等可以促进肿瘤生长和血管生成[11]。外周血单核细胞在一定程度上反映肿瘤细胞存活的微环境。LMR是评估肿瘤患者自身免疫状态的有效指标,有文献报道了LMR与血液肿瘤预后的关系,但主要为骨髓瘤和淋巴瘤[2,3],关于LMR与AML疗效及预后的研究较少。
AML患者诱导化疗第14天的骨髓幼稚细胞比例能反映个体对化疗的敏感性,是CR、RFS及OS的独立影响因素[12,13]。Ollila等[14]研究认为AML患者在诱导化疗后第14天进行骨髓检查不仅可以预测诱导化疗效果及长期生存情况,而且可据此调整化疗计划,改善患者的疗效及预后。目前虽然国外多有相关报道,但国内数据有限,且鲜见采用外周血进行评估的报道。
WT1用于监测AML患者微小残留病(MRD),尤其是在无特异核型者中已得到广泛认可,文献[15]报道化疗前后WT1表达量下降的速率可能与预后相关。
如果AML患者诱导化疗后外周血涂片镜检仍可见白血病细胞,全自动分析仪可能将该类幼稚细胞归类于单核细胞,导致外周血单核细胞计数增高,故本研究对63例AML患者完成全部诱导化疗后1周外周血涂片镜检未见白血病细胞患者的外周血淋巴细胞与单核细胞进行计数,并计算LMR。根据ROC曲线得到预测CR的诱导化疗后1周LMR的最佳临界值为1.515,分析显示低LMR组患者1个疗程后CR率低于高LMR组(P=0.028)。提示化疗后1周检测外周血LMR可能初步预测诱导化疗效果。
本研究结果显示高LMR组与低LMR组患者RFS和OS差异无统计学意,考虑可能与病例数少、两组均预后中等者居多及随访时间短有关。两组化疗后WT1基因表达水平较治疗前下降>1个数量级患者CR率、RFS率升高(均P<0.05),与相关研究报道一致[15],进一步证实AML患者化疗前后WT1表达的变化除了可以监测MRD外,其早期下降水平可用于疗效评估及预后判断。
总之,本研究结果显示,对于化疗后1周血涂片镜检未见白血病细胞患者,以外周血LMR 1.515为临界值可能有助于对化疗效果进行评估。但本研究病例数有限,需今后扩大样本量进一步研究。
所有作者均声明不存在利益冲突



























