
探讨血管免疫母细胞性T细胞淋巴瘤(AITL)并发EB病毒(EBV)阳性弥漫大B细胞淋巴瘤(DLBCL)患者的临床病理特征、治疗及预后。
回顾性分析解放军总医院第五医学中心2例AITL并发EBV阳性DLBCL患者的临床资料,并进行文献复习。
例1为混合淋巴瘤(CL)患者,以低热伴全身浅表淋巴结肿大起病,右侧腋窝肿物活组织检查示AITL并发EBV阳性DLBCL,予以8个周期化疗后达不确定的完全缓解;后续应用西达本胺维持治疗,仍生存中。例2为不一致性淋巴瘤(DL)患者,以皮下结节起病,后出现浅表淋巴结进行性肿大;皮下结节病理检查诊断为DLBCL,右腹股沟淋巴结病理检查诊断为AITL;接受7个周期化疗,因合并噬血细胞综合征而死亡。
AITL合并EBV阳性DLBCL罕见,临床症状主要以AITL的表现为主,存在T细胞及B细胞免疫表型特征,预后差,治疗方案主要依据预后较差的淋巴瘤进行选择。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
同时发生于同一解剖部位并能清楚区分两种或两种以上不同类型的淋巴瘤为混合淋巴瘤(CL),其可能来自同一个克隆,也可能起源于单个器官或组织[1];当不同类型淋巴瘤发生于不同解剖部位时,称为不一致性淋巴瘤(DL)[2]。CL和DL都很少见,而B细胞和T细胞的CL或DL更为罕见。我们报道2例血管免疫母细胞性T细胞淋巴瘤(AILT)并发EB病毒(EBV)相关的弥漫大B细胞淋巴瘤(DLBCL)患者,并进行文献复习。
例1,男性,59岁。2016年9月初出现低热伴全身浅表淋巴结肿大,11月中旬间断高热(最高体温40.3 ℃),EBV阳性(核酸定量6.305×103 IU/ml)。12月1日PET-CT检查示:(1)横膈上下多发代谢活性增高的淋巴结[最大标准摄取值(SUVmax)8.9],符合淋巴瘤表现;(2)鼻咽右后壁结节样高代谢灶(SUVmax4.1),考虑淋巴瘤浸润可能性大;(3)双侧扁桃体(SUVmax4.9)、脾(SUVmax3.6)及骨髓(SUVmax2.7)代谢活性弥漫性增高。左侧腋窝肿物活组织病理检查示:淋巴结非霍奇金淋巴瘤,AILT并发EBV阳性DLBCL。免疫组织化学检查示:CD5、bcl-6、MUM-1、PD-1、CD10、CD4、CD8均阳性,PAX、BOB-1、OCT-2部分阳性,CD30灶状阳性,CD21紊乱的滤泡网阳性,CD20大细胞阳性,bcl-2、cyclinD1、CXCL-13、EMA均阴性,CD10、CD3为阳性/阴性,Ki-67阳性指数>50%。EBER原位杂交检测示EBER阳性>200个/高倍视野(HPF)。骨髓病理检查未见明显异常。免疫球蛋白克隆性重排检测示4管单克隆性重排,T细胞受体(TCR)检测示3管呈单克隆性重排。疾病分期:ⅢB期,国际预后指数(IPI)评分:2分。应用CHOPE(环磷酰胺、表柔吡星、长春新碱、依托泊苷、醋酸泼尼松)方案+西达本胺治疗2个周期,达部分缓解(PR);因Ⅳ级骨髓抑制,更换为CHOP(环磷酰胺、表柔吡星、长春新碱、醋酸泼尼松)方案+西达本胺治疗2个周期,达疾病稳定(SD)。后GDP(吉西他滨、顺铂、地塞米松)方案+西达本胺治疗2个周期及DICE(异环磷酰胺、顺铂、依托泊苷、地塞米松)方案+西达本胺治疗2个周期,达不确定的完全缓解(CR)。后期应用西达本胺(30 mg/次,2次/周)间断维持治疗约1年,患者生存中。
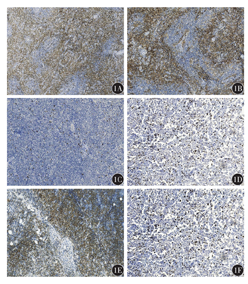
例2,男性,51岁。2017年4月初出现皮下结节,伴瘙痒,1个月后出现上下纵隔淋巴结进行性肿大。EBV阳性(核酸定量3.063×104 IU/ml)。PET-CT检查示:横膈上下各区多发代谢活性增高淋巴结(SUVmax7.6),头颈部、躯干及四肢皮下多发代谢活性增高的结节,鼻咽后壁(SUVmax5.6)、双侧扁桃体(SUVmax4.7)代谢活性增高。右腹股沟淋巴结活组织病理示:淋巴结正常结构破坏,代之以弥漫增生的中等至较大的异型淋巴细胞,部分核扭曲,胞质丰富、透明,部分较大细胞核仁明显,呈霍奇金样散在分布,背景可见散在小淋巴细胞及高内皮小静脉,散在少许嗜酸粒细胞。免疫组织化学检查示:CD1a、CD68、TIA、bcl-6均散在阳性,CD2、CD3(图1A)、CD4(图1B)、CD5、CD7、CD8均反应性细胞阳性,CD20弥漫阳性,CD30散在强弱不等阳性,S-100个别细胞阳性,CD38、PD-1、PD-L1均阳性,Ki-67阳性指数约30%,CD138、MPO、CD23、IgG4、CD56均阴性,bcl-2小淋巴细胞弱阳性,c-myc阳性20%;原位杂交检测EBER阳性>50个/HPF(图1C);特殊染色:PAS和银染均阴性。结合免疫组织化学检测结果,符合AITL。皮肤结节病理检查示:皮肤组织真皮全层至皮下灶性淋巴细胞浸润,淋巴细胞围绕血管及附属器,大部分细胞中等至较大,胞质透亮,部分核扭曲,少数较大细胞核圆形,可见核仁,呈免疫母细胞样,背景可见小淋巴样细胞及丰富的血管。免疫组织化学结果:CD3小细胞阳性,CD20弥漫阳性(图1D),MUM-1部分阳性(图1E),CD68散在阳性,CD1a个别阳性,CD30强弱不等阳性,MPO阴性,Ki-67阳性指数约70%,CD38阳性;原位杂交检测EBER阳性(图1F);特殊染色:PAS阴性。结合免疫组织化学检测结果考虑为DLBCL,Ⅳ期,IPI评分2分。应用CHOPE方案+西达本胺治疗3个周期,达PR。2017年10月18日出现发热,检查示EBV阳性(核酸定量1.374×107 IU/ml),血红蛋白和血小板两系降低、高三酰甘油(3.73 mmol/L)、高铁蛋白(12 660 μg/L)、白细胞介素2(IL-2)受体高(>7 500 U/ml)、降钙素原高(3.43 ng/ml)、超敏C-反应蛋白高(25 mg/L),考虑合并噬血细胞综合征。行R-GEMOX-PEG-ASP(利妥昔单抗、吉西他滨、奥沙利铂、培门冬酶、依托泊苷、地塞米松)方案化疗4个周期,体温恢复至正常,达CR。2018年2月10日再次高热,合并Ⅰ型呼吸衰竭,再次出现巨细胞病毒及EBV升高、贫血、血小板低、高三酰甘油、IL-2受体高;肺部CT示两肺渗出性改变,部分肺水肿不除外;纵隔部分淋巴结较前增大。经抗感染、激素等治疗后症状略好转。患者要求出院,1周后死亡。

本组2例患者病程短,进展快,分期晚,均合并EBV感染,EBER阳性,病理上符合AITL和DLBCL特征,且几乎同时诊断两种淋巴瘤,无法区别两种淋巴瘤发生先后,基于AITL一线方案进行治疗,其例1获得缓解,例2后期合并噬血细胞综合征死亡。
非霍奇金淋巴瘤中,T细胞淋巴瘤发病率远低于B细胞淋巴瘤[3],而B细胞和T细胞的CL或DL更为罕见。Xu等[4]首先提出了"复合AITL和B细胞淋巴瘤"的概念。CL占淋巴瘤总体1%~4.7%[5]。Zettl等[6]对600多例T细胞淋巴瘤患者(包括170例AITL)进行了分析,17例转化为EBV阳性大B细胞淋巴瘤,其中只有3例并发继发性EBV相关B细胞淋巴瘤。
AITL起源于生发中心T辅助细胞(TFH)[7],其病理表现为淋巴结结构破坏、多形细胞浸润、高内皮小静脉增多和树突状细胞增殖。病灶内可见小至中等大小的淋巴细胞,细胞质清晰,细胞异型性极小,同时伴有浆细胞、巨噬细胞、组织细胞和免疫母细胞等炎性细胞浸润[8]。AITL可伴EBV阳性B细胞增殖,但其并发大B细胞淋巴瘤较为罕见。我们仅文献检索到1例确诊为AITL患者骨髓中发现EBV阳性大B细胞淋巴瘤[9]。
AITL和大B细胞淋巴瘤临床表现不同。AITL通常表现为严重免疫缺陷,临床症状较重;而多数大B细胞淋巴瘤患者,特别是DLBCL患者,通常无明显临床表现。因此当患者首次诊断DLBCL但临床症状与DLBCL无关时,必须注意有无并发AITL的可能[9]。
DL或CL是由T细胞单克隆性增生继发引起大B细胞淋巴瘤的双克隆性肿瘤,在AITL患者中可以检测到IgH基因和TCR基因克隆性重排[3]。
AITL并发DLBCL患者中,大多数存在EBV感染[3],几乎所有被EBV感染的细胞都是B细胞,其可能导致B细胞的多克隆或克隆增殖[3,5]。de Leval等[10]研究表明AITL中可能过度表达CXCL13,这是正常TFH细胞的特征,这些免疫表型有助于区分AITL与非典型副皮质增生和其他外周T细胞淋巴瘤,以及用于诊断结外传播。CXCL13是一种B细胞趋化因子[11],促进滤泡B细胞的存活和分化[7],同时EBV感染为TFH细胞激活和CXCL13产生提供了刺激信号。CXCL13可能反过来刺激B细胞进一步活化,从而产生共刺激循环,导致AITL引起EBV相关的B细胞恶性转化。EBV感染被认为在促进AITL患者DLBCL的发展中起着至关重要的作用[1]。在AITL中EBV感染的B细胞、T细胞和细胞因子之间的这种复杂的相互作用可能是不受控制的B细胞增殖和DLBCL的组织学进展的机制[12]。通常认为AITL中EBV相关的继发性B细胞淋巴瘤是从淋巴结中EBV感染的B细胞发展而来的[13],并且大多数为DLBCL,通常发生在淋巴结中或淋巴结外[14]。淋巴结中EBV负荷的增加与AITL的组织学进展有关[11]。因此,B细胞淋巴瘤的发展可能是AITL疾病进展的结果[3]。DL可能起源于多能干细胞,由于遗传易感性或事先暴露于特定的疗法或诱变剂,分化为B细胞和T细胞肿瘤等。第二种淋巴瘤的发展不仅由AITL的免疫缺陷诱导,导致病毒感染,而且还由其他因素(如化疗)引起的遗传改变和患者的背景所诱导[11,13]。
本组2例患者同时存在B细胞淋巴瘤和T细胞淋巴瘤,这是一种罕见的血液系统恶性肿瘤,治疗上存在一定难度,预后较差的淋巴瘤决定了治疗策略[15]。AITL本身预后较差,与常规T细胞淋巴瘤相比,初始化疗对CL、DL更有效,当AITL与继发性DLBCL合并结外受累时,因大多数AITL和DLBCL并发者遵循侵袭性肿瘤临床过程,通常预后不良[15]。非典型T细胞背景中EBV阳性B细胞的存在已被证明与临床分期晚和预后不良有关[16]。
AITL和DLBCL并发淋巴瘤的治疗方法包括化疗、靶向治疗、免疫调节治疗和造血干细胞移植,但尚未确定这种侵袭性疾病的标准治疗方法。在本组2例中应用CHOPE方案+西达本胺很大程度上取决于T细胞成分。AITL和DLBCL并发时,应选择在两个实体肿瘤中都具有良好活性的包含抗CD20抗体的方案。尽管利妥昔单抗对AITL中克隆性B细胞的影响仍存在争议,但确定AITL患者中克隆性B细胞的存在非常重要[9]。有研究表明利妥昔单抗在联合标准CHOP方案时可以抑制AITL的EBV阳性B免疫母细胞增殖,周围B细胞的消除可能有助于抑制AITL,改善预后[17],这支持了肿瘤T细胞和增殖的B细胞有相互作为发病机制的假说。中断这种相互作用可能是一种新的治疗策略,值得进一步研究[8]。复发和难治患者应纳入临床试验,一旦处于缓解状态,可行自体造血干细胞移植巩固治疗[15]。同时应该设计创新的诱导策略,由标准的CHOP或CHOPE方案与生物制剂相结合,以争取获得尽可能高的完全缓解率,从而使更多患者从后续外周血自体造血干细胞移植中获益,并延长其生存期[18]。此外,应尽早向化疗不敏感的患者推荐异基因造血干细胞移植[19]。
所有作者均声明不存在利益冲突































