
探讨来那度胺联合二线免疫化疗作为挽救方案治疗复发难治弥漫大B细胞淋巴瘤(DLBCL)患者的临床疗效。
回顾性分析中国科学技术大学附属第一医院2016年1月至2020年12月收治的37例自体造血干细胞移植后复发或不符合移植条件或无移植意愿、接受来那度胺联合二线免疫化疗方案治疗的复发难治DLBCL患者临床资料。其中6例为原发性中枢神经系统淋巴瘤,3例为继发性中枢神经系统淋巴瘤。评估治疗结束后的近期疗效。采用Kaplan-Meier法分析患者总生存(OS)和无进展生存(PFS),亚组间比较采用log-rank检验。
37例患者中位随访时间为20.4个月(2.7~37.0个月)。治疗结束时,所有患者的总有效率(ORR)为64.9%(24/37),完全缓解(CR)率为45.9% (17/37),24例对治疗有反应患者的中位反应持续时间(DOR)为17.7个月(3.6~33.6个月)。所有患者的中位PFS时间为11.2个月,1年PFS率为48.6%(95% CI 32.5%~64.7%)。所有患者的中位OS时间未达到,1年OS率为67.6%(95% CI 52.5%~82.7%)。在24例对治疗有反应的患者中,与7例缓解后未接受来那度胺维持治疗的患者相比,17例缓解后来那度胺维持治疗患者OS和PFS差异虽均无统计学意义(均P>0.05),但有更好的改善趋势。最常见的不良反应为嗜中性粒细胞降低,发生率为81.1%(30/37)。
来那度胺联合二线免疫化疗可能是复发难治DLBCL、尤其是中枢神经系统受累患者的有效挽救疗法。经挽救治疗达缓解的患者继续接受来那度胺维持治疗可以改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
R-CHOP(利妥昔单抗、环磷酰胺、多柔比星、长春新碱、泼尼松)方案作为一线治疗方案显著改善了新诊断弥漫大B细胞淋巴瘤(DLBCL)患者的预后[1],但仍有30%~40%的患者在治疗结束后2年内出现复发,约10%的患者发展为原发难治性疾病[2]。挽救性治疗后行自体造血干细胞移植(AHSCT)是复发难治DLBCL患者标准治疗方法,但约50%的患者在AHSCT后复发[3]。因此探讨更加有效的挽救疗法是复发难治DLBCL,尤其是不符合AHSCT条件或AHSCT后失败患者最迫切需要解决的问题。来那度胺具有多重免疫调节作用和直接肿瘤杀伤作用[4],单药或与利妥昔单抗联合治疗复发难治DLBCL安全、有效。关于来那度胺联合二线免疫化疗方案治疗复发难治DLBCL的数据较少,尤其是真实世界的情况鲜见报道。本研究探讨来那度胺联合二线免疫化疗方案治疗复发难治DLBCL患者的效果和安全性。
纳入标准:(1)经组织病理明确诊断为DLBCL,年龄≥18岁;(2)经规范R-CHOP或CHOP样方案治疗[原发性中枢神经系统淋巴瘤(PCNSL)患者经规范R-HD-MTX(利妥昔单抗、大剂量甲氨蝶呤)样方案治疗]后复发难治;(3)无其他恶性肿瘤或严重心、脑、肝肾疾病;(4)临床资料完整,均有可测量及评估的指标。回顾性分析中国科学技术大学附属第一医院血液科2016年1月至2020年12月接受来那度胺联合二线免疫化疗方案治疗的复发难治DLBCL患者的临床资料,按照2016年世界卫生组织(WHO)淋巴造血组织肿瘤分类标准明确诊断为DLBCL[5],根据纳入标准共纳入37例患者。通过住院病历系统、门诊系统收集患者性别、年龄、细胞起源、Ann-Arbor分期、B症状(发热、盗汗、体质量降低)、美国国家综合癌症网络(NCCN)国际预后指数(IPI)评分、累及结外病灶数、是否侵犯骨髓、乳酸脱氢酶(LDH)、β2-微球蛋白等指标。本研究通过中国科学技术大学附属第一医院医学研究伦理委员会审批(批准文号:2020-RE-012),豁免患者知情同意。
与来那度胺联合的二线免疫化疗方案主要包括R-Gemox(利妥昔单抗、吉西他滨、奥沙利铂)、R-GDP(利妥昔单抗、吉西他滨、地塞米松、顺铂)、R-HD-MTX方案和利妥昔单抗联合伊布替尼±化疗。来那度胺的初始剂量为25 mg/d[肌酐清除率(CrCI)为30~60 ml/min的患者初始剂量为10 mg/d],第1天至第10天口服给药,每21 d为1个周期,并根据耐受性进行剂量调整。患者需完成6~8个周期治疗,对治疗无反应或治疗过程中出现疾病进展者,根据病情更换其他治疗方案。17例获得缓解的患者在治疗结束后继续接受来那度胺维持治疗。
根据Lugano反应评价标准对患者进行近期疗效评估[6]。应用CT和(或)18F-FDG PET-CT评估治疗反应。采用磁共振成像(MRI)对中枢神经系统(CNS)状况进行评估。主要指标为总有效率(ORR),以完全缓解(CR)+部分缓解(PR)计算。次要指标为治疗后的无进展生存(PFS)、总生存(OS)、反应持续时间(DOR)和不良反应。PFS定义为从开始接受来那度胺联合二线免疫化疗至出现疾病进展或任何原因死亡或末次随访的时间,OS定义为从开始接受来那度胺联合二线免疫化疗至任何原因死亡或末次随访的时间,DOR定义为从评估为CR或PR至疾病进展或任何原因死亡的时间。不良反应根据美国国立癌症研究所常见不良事件术语标准(CTCAE)4.0评估,化疗相关不良反应分为1~4级。通过查阅住院病历或门诊病历及电话随访的方式对患者进行随访。末次随访时间为2021年12月15日。
采用SPSS 25.0软件进行统计学分析,采用GraphPad Prism 8.0软件绘制图形。计数资料以频数(%)表示,组间比较采用Fisher确切概率法。采用Kaplan-Meier法进行生存分析,亚组间比较采用log-rank检验。P<0.05为差异有统计学意义。
37例患者均为AHSCT后复发或不符合移植条件或无移植意愿者,除6例PCNSL患者在确诊后接受R-HD-MTX样方案治疗外,其余患者在确诊后均接受了R-CHOP或CHOP样方案治疗。23例(62.2%)患者接受过挽救治疗,包括3例接受AHSCT患者。10例(27.0%)患者既往接受过3线及以上方案治疗,中位既往治疗方案线数为2线(1~4线)。患者开始接受来那度胺治疗时的临床特征:中位年龄57岁(28~85岁),男性23例(62.2%);Hans分型:生发中心B细胞(GCB)型11例(29.7%),非GCB型26例(70.3%);美国东部肿瘤协作组(ECOG)体能状态评分≥2分18例(48.6%);NCCN-IPI评分4~8分25例(67.6%);Ann Arbor分期Ⅲ~Ⅳ期34例(91.9%);有B症状15例(40.5%);有结外病变33例(89.2%);CNS累及9例(24.3%),包括PCNSL 6例,继发性CNS淋巴瘤3例;骨髓累及8例(21.6%);LDH升高17例(45.9%)。由于患者在来那度胺联合治疗开始前曾接受过多种挽救治疗方案,故无论是开始一线治疗至第1次复发的时间间隔,还是从第1次复发至开始来那度胺联合治疗的时间间隔均不同(图1)。
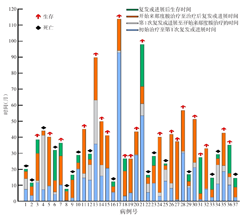

37例患者接受来那度胺联合二线免疫化疗后,17例(45.9%)达到CR,7例(18.9%)达到PR,13例(35.1%)出现早期进展,ORR为64.9%(24/37);24例对治疗有反应患者的中位DOR为17.7个月(3.6~33.6个月)。在治疗过程中,16例采用了伊布替尼联合来那度胺和利妥昔单抗±化疗的方案,含伊布替尼方案与不含伊布替尼方案治疗的患者ORR分别为62.5%(10/16)和66.7%(14/21),CR率分别为56.3%(9/16)和38.1%(8/21),两种方案的ORR和CR率差异均无统计学意义(P=1.000;P=0.331)。CNS受累和CNS未受累患者的ORR分别为66.7%(6/9)和64.3%(18/28),CR率分别为55.6%(5/9)和42.9%(12/28),ORR和CR率差异均无统计学意义(P=1.000;P=0.703)。至最后一次随访,16例(43.2%)患者因疾病进展死亡;生存的21例患者中,15例(71.4%)维持缓解状态,6例(28.6%)因疾病进展接受了不同的挽救治疗方案治疗。
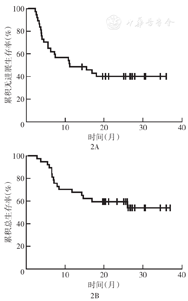
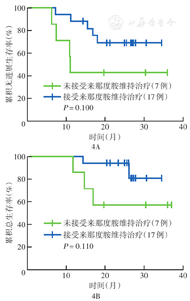
37例患者中位随访时间为20.4个月(2.7~37.0个月),所有患者的中位PFS时间为11.2个月,中位OS时间未达到;1年PFS率为48.6%(95% CI 32.5%~64.7%),1年OS率为67.6%(95% CI 52.5%~82.7%)(图2)。GCB和非GCB、是否CNS累及、治疗方案含与不含伊布替尼治疗亚组间PFS和OS差异均无统计学意义(均P>0.05)。与早期复发(确诊后<12个月复发)患者相比,晚期复发(确诊后≥12个月复发)患者PFS更优(P=0.030),但OS差异无统计学意义(P=0.110)(图3)。在24例对治疗有反应的患者中,与7例缓解后未接受来那度胺维持治疗的患者相比,17例缓解后接受来那度胺维持治疗患者OS和PFS差异虽均无统计学意义(均P>0.05),但有更好的改善趋势(图4)。

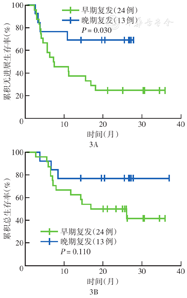

注:早期复发为确诊后<12个月复发;晚期复发为确诊后≥12个月复发

来那度胺联合二线免疫化疗期间,30例(81.0%)出现不同程度的嗜中性粒细胞降低,其中3~4级发生率为45.9%(17/37)。贫血和血小板降低发生率分别为59.4%(22/37)和51.4%(19/37),其中3~4级不良反应发生率分别为21.6%(8/37)和18.9%(7/37)。22例(59.4%)出现感染,感染部位多为肺部和泌尿系统,均伴有嗜中性粒细胞降低;1例(2.7%)因严重肺部感染而发生感染性休克和呼吸衰竭,并于不久后死亡。1例(2.7%)发生静脉血栓。1例(2.7%)出现心律失常。分别有6例(16.2%)和2例(5.4%)患者在治疗过程中出现肝功能不全和肾功能不全,其中1例(2.7%)患者在治疗5个周期后因肾功能不全而停用来那度胺,停药后肾功能逐渐恢复。所有血液学不良反应经支持治疗后均可恢复。
根据中国DLBCL诊断与治疗指南[7],复发难治DLBCL患者常用的二线治疗方案有R-DHAP(利妥昔单抗、地塞米松、顺铂、阿糖胞苷)、R-ESHAP、R-GDP、R-Gemox、R-ICE方案。但在随机研究中,尚无明确证据表明一种方案优于另一种方案[3]。两项大型的Ⅲ期随机研究显示,R-ICE与R-DHAP方案的疗效相似,R-GDP与R-DHAP方案的疗效相似[8]。因此,在本研究中将这些常用的二线治疗方案看作具有相似疗效的一组挽救治疗方案,并作为与来那度胺组合的基础。根据既往研究数据,各挽救治疗方案的ORR为63%~67%,CR率为13%~37%[9,10,11]。
本研究中,我们分析了来那度胺联合二线免疫化疗方案治疗复发难治DLBCL患者的真实世界临床数据,在既往中位治疗线数为2线的情况下,ORR为64.9%、CR率为45.9%,中位DOR为17.7个月(3.6~33.6个月)。本研究的ORR与既往报道的挽救方案相当,但与既往挽救方案13%~37%的CR率相比,本研究的CR率更高(45.9%)。两项来那度胺与二线方案联合治疗复发难治DLBCL的Ⅰ、Ⅱ期研究结果显示,ORR 73%~79%、CR率47%~60%[12,13]。本研究的缓解率要略低于这两项研究,可能因为这些Ⅰ、Ⅱ期研究纳入的多为首次复发难治且适合AHSCT的患者,而本研究中的患者大多经历了二线以上的治疗,且为移植后复发或不符合移植条件或无移植意愿。由于本研究及上述Ⅰ、Ⅱ期研究患者数均较少,因此来那度胺与二线方案联合治疗复发难治DLBCL的疗效有待在更大的Ⅲ期研究中进一步评估。
来那度胺可渗透进入脑室脑脊液中,已在复发难治PCNSL的挽救治疗和挽救治疗后的维持治疗中显示出疗效[14,15]。在一项前瞻性Ⅱ期研究中,来那度胺与利妥昔单抗联合治疗复发难治PCNSL,诱导治疗结束时得到的ORR为35.6%(95% CI 21.9%~51.2%),中位PFS和OS时间分别为7.8个月和17.7个月[15]。本研究中,6例复发难治PCNSL及3例继发性CNS受累患者接受了来那度胺联合R-HD-MTX样方案治疗,9例患者中有6例(66.7%)对治疗有反应,5例(55.6%)达到CR。有CNS受累和无CNS受累患者的PFS和OS差异均无统计学意义。提示来那度胺联合R-HD-MTX样方案可能提高了CNS受累患者的挽救治疗效果。
有临床前研究表明,来那度胺与伊布替尼联合使用时,在DLBCL模型中的活性增加[16]。此外,来那度胺与利妥昔单抗具有协同作用[17],来那度胺能够克服利妥昔单抗的耐药性[18]。一项研究报道了伊布替尼联合来那度胺和利妥昔单抗治疗复发难治DLBCL,所有患者ORR为38%(CR率24%),其中非GCB患者(ORR 65%,CR率41%)比GCB患者(ORR 29%,CR率18%)治疗反应更显著[19]。此外,伊布替尼治疗复发难治PCNSL也显示出了积极效果。在一项前瞻性Ⅱ期研究中,伊布替尼单药治疗复发难治PCNSL,ORR为52%(CR率19%)[20]。在本研究中,16例患者使用了伊布替尼联合来那度胺和利妥昔单抗±化疗的方案,使用含伊布替尼的方案与不含伊布替尼的方案治疗患者ORR分别为62.5%(CR率56.3%)和66.7%(CR率38.1%),差异无统计学意义(P>0.05),这可能与患者数较少有关。
维持治疗作为一种有效的治疗手段能够提高缓解质量、消除残留病变,从而延缓疾病进展,增加长期生存。来那度胺是一种口服活性免疫调节药物,其服药方便及毒性可控的特点使其在长期维持治疗中具有广阔的应用前景。在一项来那度胺维持治疗初治缓解DLBCL患者的试验中[21],来那度胺与安慰剂相比有明显的PFS益处(HR=0.708,95% CI 0.537~0.933,P=0.013 5),来那度胺维持治疗的2年PFS率为80%(95% CI 75%~84%)。在另一项来那度胺维持治疗复发DLBCL患者的研究中[22],1年PFS率为70%(95% CI 57%~83%),5年PFS率为(48±7)%,5年OS率为(62±7)%,表明来那度胺与持久的疾病控制相关。在本研究中,24例患者获得缓解,17例患者在缓解后继续接受来那度胺维持治疗。虽然来那度胺维持治疗与未接受维持治疗患者的PFS和OS差异均无统计学意义,但维持治疗显示出了更有利的生存预后。
本研究为单中心回顾性研究,缺乏单独使用二线免疫化疗方案的患者作为对照组,但通过与已有研究数据的对照,CR率更高。此外,本研究在亚组分析中未获得统计学差异,考虑与样本量较少有关。因此来那度胺联合二线免疫化疗的确切疗效还需在大型随机对照研究中进一步验证。
总之,来那度胺联合二线免疫化疗是复发难治DLBCL患者的有效治疗方案,尤其是对于AHSCT后复发或不符合移植条件或无移植意愿的患者。治疗达缓解后继续接受来那度胺维持治疗可以改善患者生存预后。
所有作者均声明不存在利益冲突



























