
探讨急性髓系白血病(AML)患者中FLT3-ITD突变的共存基因突变及其与部分临床参数间的相关性。
回顾性分析2012年12月至2019年8月于常州市第二人民医院和无锡市第二人民医院门诊及住院治疗的236例初发AML患者的临床资料,采用基因组DNA-聚合酶链反应(PCR)联合Sanger测序法检测FLT3-ITD突变情况;采用高通量DNA测序联合Sanger测序法检测FLT3-ITD突变患者51个肿瘤靶基因突变情况。
236例AML患者中共检出FLT3-ITD突变71例(30.1%)。97.2%(69/71)FLT3-ITD突变患者同时伴其他基因突变,其中双基因突变19例,3个基因突变24例,≥4个基因突变26例;共存突变基因中最常见的为NPM1(55例,77.5%),其他依次为DNMT3A(36例,50.7%)、TET2(9例,12.7%)、CEBPA(5例,7.0%)、IDH1(4例,5.6%)及NRAS(4例,5.6%)等。在FLT3-ITD突变患者中,与DNMT3A野生型患者相比,DNMT3A突变型患者血红蛋白水平降低(t=-2.37,P=0.020);与NPM1野生型患者相比,NPM1突变型患者血红蛋白水平升高(t=2.04,P=0.045);3个基因突变和≥ 4个基因突变患者的血小板计数高于双基因突变患者(χ2=7.72,P=0.021)。71例患者化疗后,66例可评价疗效,其中未达完全缓解(CR)的18例患者白细胞计数高于达CR的48例患者(Z=-2.74,P=0.006)。
绝大多数伴FLT3-ITD突变的AML患者有共存基因突变,共存基因的突变类型与患者临床特征有一定的相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
FLT3是第三类受体酪氨酸激酶,有两种常见突变,即内部串联重复(ITD)和酪氨酸激酶结构域的点突变,约有20%急性髓系白血病(AML)患者存在FLT3-ITD基因突变,提示预后不良[1,2]。有研究显示,FLT3-ITD突变可与DNMT3A、NPM1等其他基因突变伴随出现[2,3],但其伴随基因突变的类型及临床意义尚不明确。本研究采用基因组DNA-聚合酶链反应(PCR)检测了236例初发AML患者FLT3-ITD热点突变,进一步通过高通量DNA测序技术检测伴FLT3-ITD基因突变AML患者的51个常见髓系肿瘤基因突变情况,观察这些突变与FLT3-ITD突变的伴随发生情况,并初步探讨其临床意义。
回顾性分析2012年12月至2019年8月于常州市第二人民医院和无锡市第二人民医院门诊及住院治疗的236例初发AML患者的临床资料,其中男性120例,女性116例,中位年龄48岁(16~80岁)。所有患者均经骨髓形态学、染色体核型、白血病免疫分型及分子生物学检查确诊。本研究经常州市第二人民医院伦理委员会审核批准(批准文号:2015-C-28-01),患者及家属均知情同意并签署知情同意书。
红细胞裂解液(上海碧云天生物公司)、DNA提取试剂盒(美国Gentra公司)、TaqPCR Master Mix(北京天根生化科技公司)、离心机(美国Beckman Coulter公司)、PCR仪(美国ThermoFisher公司)、凝胶成像仪(美国Bio-Rad公司)、UV-240紫外分光光度计(日本岛津公司)。
所有患者于首诊进行骨髓穿刺时留存骨髓标本,获取骨髓单个核细胞。按照DNA提取试剂盒标准步骤抽提患者基因组DNA。根据吸光度确定患者DNA浓度,并将样品统一稀释至50 ng/μl,保存标本待测。
设计FLT3-ITD基因外显子扩增引物,进行PCR扩增,产物经10 g/L的琼脂糖凝胶电泳后,采用紫外透射仪分析图像。所有扩增产物均进行直接测序,测序由上海裕晶生物科技有限公司完成。
取所检患者样品基因组DNA 10~12 ng,采用美国ThermoFisher公司的S5系统检测以下51个基因的所有外显子突变情况:JAK2、ASXL1、ASXL2、BCOR、BCORL1、ETNK1、PTPN11、U2AF1、GATA2、NRAS、WT1、MYD88、C-KIT、TET2、FLT3、NPM1、DNMT3A、IDH1、IDH2、ZRSR2、ETV6、SH2B3、BIRC3、KRAS、SF3B1、MPL、CSF3R、CSMD1、IL7R、PAX5、EZH2、RUNX1、SRSF2、TP53、NOTCH1、STAG2、SETBP1、SETD2、CALR、PDGFRB、PIGA、PHF6、PTEN、BRAF、FBXW7、U2AF1、FAT1、PTPN11、KIT、KMT2D、CEBPA。数据读取时选择外显子上的基因突变,并去掉同义突变及多态性突变。
为防止高通量深测序技术对于大片段插入、缺失序列结果读取的局限性,参考文献[4],同时采用PCR联合Sanger测序法对NPM1基因第12号外显子及CEBPA的TAD、BZIP功能结构域进行补充检测。
抽取肝素抗凝骨髓悬液2~4 ml,采用24 h短期培养法、常规R显带技术进行常规中期核型分析,每例患者分析20个中期分裂象。细胞核型的描述根据人类细胞遗传学国际命名体制(ISCN)2006进行[5]。
采用SPSS 26.0统计学软件进行数据分析。计量资料如果服从正态分布,采用 ±s进行统计描述,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验;如果不服从正态分布,采用M(Q1,Q3)进行统计描述,组间比较采用非参数Kruskal-Wallis秩和检验。计数资料采用频数(%)表示,两组间比较采用χ2检验或校正χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
±s进行统计描述,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验;如果不服从正态分布,采用M(Q1,Q3)进行统计描述,组间比较采用非参数Kruskal-Wallis秩和检验。计数资料采用频数(%)表示,两组间比较采用χ2检验或校正χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
236例AML患者中,共检测到71例(30.1%)存在FLT3-ITD基因突变。71例FLT3-ITD突变患者中,正常核型60例,异常核型9例,未检出2例;异常核型中+8 5例,+11、复杂核型、t(15;17)、48 XY各1例。FLT3-ITD基因突变71例患者中,法、美、英协作组(FAB)亚型M5 48例,M4 9例,M2 8例,M1 3例,M0 1例,M3 1例,未分类1例。
对71例FLT3-ITD突变患者进行了51个肿瘤基因突变检测,共检测到28个基因突变与FLT3-ITD基因突变共存,共存发生率为97.2%(69/71)。71例中NPM1 55例(77.5%),DNMT3A 36例(50.7%),TET2 9例(12.7%),CEBPA 5例(7.0%),IDH1 4例(5.6%),NRAS 4例(5.6%),IDH2、RELN、PTPN11、U2AF1、NOTCH1均为3例(4.2%)。同时伴有NPM1及DNMT3A突变者共19例(26.8%)。对基因功能进行归类后发现,FLT3-ITD共存突变为转录调节因子突变68例(95.8%),DNA甲基化调节基因突变53例(74.6%),酪氨酸激酶受体基因、RAS信号转导通路相关基因、RNA剪切子突变均为7例(9.9%)。
71例FLT3-ITD突变患者中,与野生型患者相比,DNMT3A突变型患者血红蛋白水平降低(P=0.020);与野生型患者相比,NPM1突变型患者血红蛋白水平升高(P=0.045)(表1)。
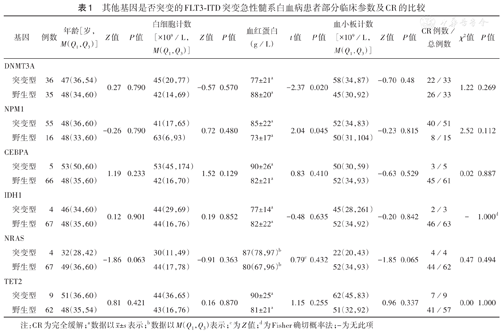
其他基因是否突变的FLT3-ITD突变急性髓系白血病患者部分临床参数及CR的比较
其他基因是否突变的FLT3-ITD突变急性髓系白血病患者部分临床参数及CR的比较
| 基因 | 例数 | 年龄[岁,M(Q1,Q3)] | Z值 | P值 | 白细胞计数[×109/L,M(Q1,Q3)] | Z值 | P值 | 血红蛋白(g/L) | t值 | P值 | 血小板计数[×109/L,M(Q1,Q3)] | Z值 | P值 | CR例数/总例数 | χ2值 | P值 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| DNMT3A | |||||||||||||||||
| 突变型 | 36 | 47(36,54) | 0.27 | 0.790 | 45(20,77) | -0.57 | 0.570 | 77±21a | -2.37 | 0.020 | 58(34,87) | -0.70 | 0.48 | 22/33 | 1.22 | 0.269 | |
| 野生型 | 35 | 48(34,60) | 42(14,69) | 88±20a | 45(30,92) | 26/33 | |||||||||||
| NPM1 | |||||||||||||||||
| 突变型 | 55 | 48(36,60) | -0.26 | 0.790 | 41(17,65) | 0.72 | 0.480 | 85±22a | 2.04 | 0.045 | 52(34,83) | -0.23 | 0.815 | 40/51 | 2.52 | 0.112 | |
| 野生型 | 16 | 48(33,60) | 63(6,93) | 73±17a | 50(31,104) | 8/15 | |||||||||||
| CEBPA | |||||||||||||||||
| 突变型 | 5 | 53(50,60) | 1.19 | 0.233 | 53(45,174) | 1.52 | 0.129 | 90±26a | 0.83 | 0.410 | 50(30,59) | -0.63 | 0.529 | 3/5 | 0.02 | 0.887 | |
| 野生型 | 66 | 48(35,60) | 42(16,70) | 82±21a | 52(34,93) | 45/61 | |||||||||||
| IDH1 | |||||||||||||||||
| 突变型 | 4 | 46(34,60) | 0.12 | 0.901 | 44(29,69) | 0.19 | 0.852 | 77±14a | -0.48 | 0.635 | 45(28,261) | -0.20 | 0.842 | 2/3 | - | 1.000d | |
| 野生型 | 67 | 48(35,60) | 44(16,76) | 82±22a | 52(34,92) | 46/63 | |||||||||||
| NRAS | |||||||||||||||||
| 突变型 | 4 | 32(28,42) | -1.86 | 0.063 | 30(11,49) | -0.91 | 0.363 | 87(78,97)b | 0.79c | 0.432 | 22(20,43) | -1.85 | 0.065 | 4/4 | 0.47 | 0.494 | |
| 野生型 | 67 | 49(36,60) | 44(17,78) | 80(67,96)b | 52(34,93) | 44/62 | |||||||||||
| TET2 | |||||||||||||||||
| 突变型 | 9 | 51(36,60) | 0.81 | 0.421 | 44(36,65) | 0.16 | 0.870 | 90±25a | 1.15 | 0.255 | 62(45,83) | 0.96 | 0.337 | 7/9 | 0.00 | 1.000 | |
| 野生型 | 62 | 48(35,54) | 43(16,76) | 81±21a | 51(32,92) | 41/57 | |||||||||||
注:CR为完全缓解;a数据以 ±s表示;b数据以M(Q1,Q3)表示;c为Z值;d为Fisher确切概率法;-为无此项
±s表示;b数据以M(Q1,Q3)表示;c为Z值;d为Fisher确切概率法;-为无此项
71例FLT3-ITD突变患者中,仅FLT3-ITD单基因突变2例(其中1例CR),双基因突变19例,3个基因突变24例,≥4个基因突变26例。3个基因突变患者的血小板计数最高,双基因突变患者最低(P=0.021)(表2)。
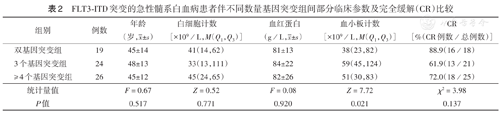
FLT3-ITD突变的急性髓系白血病患者伴不同数量基因突变组间部分临床参数及完全缓解(CR)比较
FLT3-ITD突变的急性髓系白血病患者伴不同数量基因突变组间部分临床参数及完全缓解(CR)比较
| 组别 | 例数 | 年龄(岁, ±s) ±s) | 白细胞计数[×109/L,M(Q1,Q3)] | 血红蛋白(g/L, ±s) ±s) | 血小板计数[×109/L,M(Q1,Q3)] | CR[%(CR例数/总例数)] |
|---|---|---|---|---|---|---|
| 双基因突变组 | 19 | 45±14 | 41(14,62) | 81±13 | 38(23,82) | 88.9(16/18) |
| 3个基因突变组 | 24 | 48±13 | 33(13,111) | 84±22 | 59(45,124) | 61.9(13/21) |
| ≥4个基因突变组 | 26 | 45±12 | 45(24,65) | 82±26 | 51(30,83) | 72.0(18/25) |
| 统计量值 | F=0.67 | Z=0.52 | F=0.08 | Z=7.72 | χ2=3.98 | |
| P值 | 0.517 | 0.771 | 0.920 | 0.021 | 0.137 |
71例FLT3-ITD突变患者初次诱导化疗后可评价疗效66例,首次诱导时达完全缓解(CR)48例(72.7%),未达CR 18例;未达CR患者白细胞计数高于达CR患者(P=0.006)(表3)。
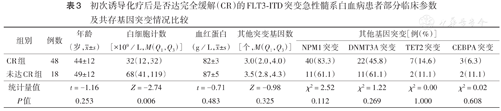
初次诱导化疗后是否达完全缓解(CR)的FLT3-ITD突变急性髓系白血病患者部分临床参数及共存基因突变情况比较
初次诱导化疗后是否达完全缓解(CR)的FLT3-ITD突变急性髓系白血病患者部分临床参数及共存基因突变情况比较
| 组别 | 例数 | 年龄(岁, ±s) ±s) | 白细胞计数[×109/L,M(Q1,Q3)] | 血红蛋白(g/L, ±s) ±s) | 其他突变基因数[个,M(Q1,Q3)] | 其他基因突变[例(%)] | |||
|---|---|---|---|---|---|---|---|---|---|
| NPM1突变 | DNMT3A突变 | TET2突变 | CEBPA突变 | ||||||
| CR组 | 48 | 44±12 | 32(12,32) | 82±3 | 3.0(2.0,4.0) | 40(83.3) | 22(45.8) | 7(14.6) | 3(6.3) |
| 未达CR组 | 18 | 49±12 | 68(41,119) | 87±5 | 3.5(2.8,4.3) | 11(61.1) | 11(61.1) | 2(11.1) | 2(11.1) |
| 统计量值 | t=-1.16 | Z=-2.74 | t=-0.71 | Z=-0.98 | χ2=2.52 | χ2=1.22 | χ2=0.00 | χ2=0.02 | |
| P值 | 0.253 | 0.006 | 0.483 | 0.325 | 0.112 | 0.269 | 1.000 | 0.608 | |
FLT3-ITD是AML中常见的基因突变,也是公认的AML预后不良分子标志,伴有该突变的患者往往具有更高的白细胞水平及骨髓原始细胞比例、更短的生存期及更高的复发率[2,3,6,7]。研究显示,FLT3-ITD可以和NPM1、DNMT3A、TET2等基因突变共存[2,3],但目前关于AML患者FLT3-ITD的共存基因突变研究较少,临床意义尚不明确。
本研究通过高通量DNA测序共检测到28个基因突变与FLT3-ITD突变共存,97.2%的AML患者FLT3-ITD突变与其他基因突变伴随出现,24例患者同时出现3个基因突变,26例患者同时出现≥4个基因突变,最常见的共存突变基因为NPM1、DNMT3A,结果与既往研究结果类似[2]。本研究7例FLT3-ITD与IDH突变共存患者中,4例为IDH1 R132,3例为IDH2 R140,未检测到IDH2 R172与FLT3-ITD突变共存,这可能与IDH2 R172一般不和其他基因突变共存有关[8]。另外,本研究发现除NPM1外,FLT3-ITD最常出现的共存突变为DNA甲基化的调节基因,而极少与RNA剪切子突变伴随出现,考虑与RNA剪切子基因突变在AML中的发生率较低有关。
FLT3-ITD突变伴有不同基因突变AML患者预后也不尽相同[9,10]。正常核型伴单独NPM1突变的AML患者已被美国国立综合癌症网络(NCCN)指南列为预后良好组。NPM1基因在维持白血病细胞遗传学稳定性中起着重要作用,存在NPM1突变的白血病细胞往往具有极大的细胞遗传学不稳定性,容易合并其他基因突变,进而影响AML患者的治疗反应及预后[11]。当FLT3-ITD突变的AML患者合并NPM1突变时,对FLT3-ITD突变带来的不良预后有明显改善[12]。有研究发现,FLT3-ITD与NPM1突变共存组CR率(51%)显著高于单独FLT3-ITD突变组(30%)[2]。本研究结果显示,FLT3-ITD突变伴有NPM1突变者血红蛋白水平高于NPM1野生型患者,但两组患者年龄、CR率差异均无统计学意义,需扩大样本进一步研究。
DNMT3A基因突变多见于老年患者,DNMT3A主要参与表观遗传学修饰,DNMT3A突变患者外周血白细胞计数、血小板计数高,总生存率及复发生存率低,DNMT3A基因突变在诱导缓解后持续存在直至治愈后消失,是预后不良的标志,与FLT3及NPM1基因突变相伴发生率高[13,14,15]。当FLT3-ITD突变的AML患者合并DNMT3A突变时,提示预后不良[2,9]。本研究结果显示,在FLT3-ITD突变AML患者中,DNMT3A突变型患者血红蛋白水平低于DNMT3A野生型患者,但两组患者白细胞、血小板计数以及CR率差异均无统计学意义。有研究显示,AML患者FLT3-ITD和DNMT3A突变共存时,CR率更低及总生存时间更短[9],但本研究发现,在初次诱导化疗达CR的AML患者中,FLT3-ITD突变伴有DNMT3A突变者比例虽较未达CR患者低,但差异无统计学意义,需扩大样本量进一步研究。
TET2基因突变在AML中有较高的发生率。有研究显示,在正常核型AML患者中,伴有TET2突变者表现出更高的年龄、更高的白细胞水平及更低的血小板水平,但FLT3-ITD与TET2突变共存组与单独FLT3-ITD突变组在年龄、血细胞水平、CR率方面无明显差异[16]。CEBPA突变在髓系肿瘤分化中起关键作用,不伴随FLT3-ITD突变时提示预后良好[17]。本研究结果显示,在FLT3-ITD突变AML患者中,CEBPA突变型与野生型患者的年龄、血细胞水平以及CR率差异均无统计学意义。
IDH1/2突变型AML患者具更高的年龄、更高的血小板水平以及更高的骨髓原始细胞比例[18,19]。而且当IDH2 R140Q和FLT3-ITD突变共存时更能促进白血病的发病[20]。本研究结果显示,在FLT3-ITD突变患者中,IDH1突变型与野生型患者年龄、血细胞水平、CR率方面差异均无统计学意义。
目前,关于AML患者基因突变数与临床特征及预后关系鲜见报道,基因突变数可能是影响患者预后的因素之一。但本研究结果显示,3个基因突变和≥ 4个基因突变患者的血小板计数较2个基因突变患者高,但三组CR率差异无统计学意义。
总之,AML患者中FLT3-ITD突变常与其他基因突变共存,共存基因突变数及类型与患者的临床特征有一定的相关性,未来需要更多的前瞻性研究及体内外功能实验来明确这些共存基因突变的生物学特征及临床意义。
所有作者均声明不存在利益冲突



























