近年来,针对肿瘤细胞内异常信号特异性发挥作用的靶向药物为肿瘤治疗提供了更多选择。B细胞受体(BCR)信号通路的过度活化或异常与慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、套细胞淋巴瘤等多种B细胞恶性肿瘤的发生、发展密切相关。布鲁顿酪氨酸激酶(BTK)是B细胞发育过程中关键的效应分子,涉及细胞增殖、成熟、分化、凋亡和迁移,为BCR通路的关键激酶,抑制其活性可产生明显的抗肿瘤效应。目前已研发上市的BTK抑制剂包括伊布替尼、泽布替尼、奥布替尼、阿卡替尼等。为了进一步优化BTK抑制剂在B细胞恶性肿瘤治疗中的临床应用,共识专家组根据目前国内BTK抑制剂应用现状,结合国内外最新的权威指南及循证医学证据,制定了BTK抑制剂治疗B细胞恶性肿瘤中国专家共识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着肿瘤生物学和相关学科的发展,靶向药物的出现为血液系统恶性肿瘤的临床治疗提供了新思路。布鲁顿酪氨酸激酶(BTK)是B细胞发育过程中关键的效应分子,涉及细胞增殖、成熟、分化、凋亡和迁移[1],其异常活化与B细胞肿瘤的发生、发展密切相关[2]。临床研究证实,BTK抑制剂对多种B细胞非霍奇金淋巴瘤(NHL)具有重要治疗价值。目前国内外已有多种BTK抑制剂在研发中,伊布替尼是我国批准的首个BTK抑制剂,目前其单药适用于慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)、套细胞淋巴瘤(MCL)和华氏巨球蛋白血症(WM),但由于其存在脱靶效应[3],在临床应用中有发生感染、腹泻、心房颤动等不良事件的风险[4,5]。结构更优化、靶点占有率更高的新一代BTK抑制剂泽布替尼[6,7,8]、奥布替尼、阿卡替尼应运而生。泽布替尼于2019年11月经美国食品药品管理局(FDA)批准上市,是第1个获得美国FDA"突破性疗法"认证的中国抗癌新药,泽布替尼于2020年6月3日获得我国国家药品监督管理局(NMPA)批准上市;奥布替尼于2020年12月25日获批在我国上市;阿卡替尼于2017年11月经美国FDA批准上市,我国暂未获批。为进一步规范我国临床医生对BTK抑制剂的使用、提高不良事件管理水平,专家组根据目前我国BTK抑制剂应用现状并结合国内外最新的权威指南及循证医学证据,讨论制定本中国专家共识。本共识将随国内外BTK抑制剂的临床研究进展而定期更新。
除T细胞和浆细胞外,BTK在所有其他造血谱系细胞中均有表达[9]。BTK在B细胞疾病发展中的关键作用使其成为B细胞肿瘤靶向治疗的重要靶点。
第1代BTK抑制剂伊布替尼的半衰期为4~6 h[10],通过抑制肿瘤细胞的生长、黏附、侵袭和迁移及促进其凋亡能达到良好的抗肿瘤效果。但伊布替尼对BTK的占有不完全,且存在脱靶效应[3],在临床应用中不良事件发生风险增加[4,5]。基于第1代BTK抑制剂的局限性,目前已有多个新一代BTK抑制剂获批上市。
通过优化结构,新的BTK抑制剂在靶点占有率和选择性方面均进一步改善。有研究分析了4种BTK抑制剂对370种激酶特异性抑制效果,结果显示泽布替尼和奥布替尼对BTK的特异性抑制效果类似,均优于伊布替尼及阿卡替尼[11];BTK半抑制浓度(IC50):泽布替尼(0.5±0.0)nmol/L、伊布替尼(1.5±0.2)nmol/L、阿卡替尼(5.1±1.0)nmol/L、奥布替尼(15.0±5.5)nmol/L[11,12],泽布替尼的IC50最低,临床常用剂量下24 h内的血药浓度可持续高于IC50,保证了24 h对BTK的有效抑制。同时,在外周血和淋巴结中,泽布替尼均可在临床剂量下实现24 h持续抑制BTK作用[7,8,13]。
在B细胞恶性肿瘤(BCM)患者中,伊布替尼剂量在840 mg(最高批准剂量的1.5倍)以内时,暴露量随剂量增加而增加。接受560 mg剂量的MCL患者实测的稳态曲线下面积(AUC)均值为865 ng·h·ml-1(变异系数为69%),接受420 mg剂量的CLL/SLL患者为708 ng·h·ml-1(变异系数为71%),接受420 mg剂量的WM患者为707 ng·h·ml-1(变异系数72%)。伊布替尼口服给药吸收的中位达峰时间为1~2 h,药物半衰期为4~6 h[10]。
泽布替尼在40~320 mg剂量范围内的血浆暴露量[血药峰浓度(Cmax)和AUC]基本随剂量成比例增加。在BCM患者中160 mg/次、2次/d给药后,泽布替尼稳态Cmax的几何均值为299 ng/ml(变异系数为56%),稳态AUC(0~∞)的几何均值为2 099 ng·h·ml-1(变异系数为42%)。重复给药后全身蓄积有限。泽布替尼口服给药的中位达峰时间为2 h,药物半衰期为2~4 h[14]。
奥布替尼在20~400 mg剂量范围内的血浆暴露量(Cmax和AUC)基本随剂量成比例增加。150 mg/次、1次/d剂量下,CLL/SLL及MCL患者连续多次服药达稳态后AUC分别为(7 280±1 750)ng·h·ml-1和(7 970±1 850)ng·h·ml-1,Cmax分别为(1 580±376)ng/ml和(1 330±384)ng/ml,1次/d连续服药无明显药物蓄积。口服给药中位达峰时间约为2 h,CLL/SLL及MCL患者的半衰期分别为(4.04±0.313)h和(4.41±0.663)h[15]。
阿卡替尼及其活性代谢物在75~250 mg剂量范围内的血浆暴露量基本随剂量成比例增加。推荐剂量100 mg/次、1次/d给药后,阿卡替尼的AUC24 h和Cmax的几何均值分别为1 843 ng·h·ml-1(变异系数为38%)和563 ng/ml(变异系数为29%)。阿卡替尼和活性代谢物ACP-5862的中位达峰时间分别为0.9 h和1.6 h,药物半衰期分别为1 h和3.5 h[16]。
CLL/SLL是一种B细胞恶性增殖性疾病,B细胞受体(BCR)信号通路在CLL的发病中发挥重要作用,因此靶向抑制BTK可有效治疗CLL。
(1)不伴del(17p)和(或)TP53突变的初治CLL/SLL患者:①关于≥65岁或存在严重伴随疾病的< 65岁患者的主要研究见表1[17,18,19,20,21]。与免疫化疗方案相比,BTK抑制剂更适合老年CLL/SLL患者,可以明显改善老年患者的无进展生存(PFS),同时患者有良好的耐受性,可提高老年患者的依从性,因此,推荐老年CLL/SLL患者优选BTK抑制剂治疗。与单药苯丁酸氮芥相比,伊布替尼可改善老年患者的PFS和总生存(OS)。RESONATE-2研究中伊布替尼组患者PFS和OS均明显获益[17]。SEQUOIA研究中,泽布替尼、伊布替尼较BR(苯达莫司汀+利妥昔单抗)方案均能更好地改善PFS,依据独立评估委员会(IRC)标准评估的PFS时间获得了显著延长[18]。Alliance A041202研究结果提示单药伊布替尼组的PFS显著优于BR组;在伊布替尼基础上联用利妥昔单抗提高了完全缓解(CR)率,但未改善PFS[19]。iLLUMINATE研究同样观察到患者可从含BTK抑制剂的联合用药方案中获益,中位随访31个月,相比于苯丁酸氮芥联合奥妥珠单抗,伊布替尼联合奥妥珠单抗能显著延长PFS时间[20]。ELEVATE-TN研究中大部分为老年患者,中位随访46.9个月,相较于苯丁酸氮芥联合奥妥珠单抗组,阿卡替尼联合奥妥珠单抗及阿卡替尼单药组中位PFS时间显著延长[21]。②<65岁且无严重伴随疾病的年轻成年患者应用BTK抑制剂治疗同样可获益。伊布替尼Ⅲ期ECOG-ACRIN E1912研究将529例非del(17p)的初治CLL年轻成年患者(中位年龄57岁)按2∶1比例随机分至伊布替尼联合利妥昔单抗组和6个周期FCR(利妥昔单抗+氟达拉滨+环磷酰胺)方案组,中位随访34个月,伊布替尼联合利妥昔单抗组PFS、OS较FCR方案组均更加获益;部分患者进行了IGHV突变检测,受检者中29%有IGHV突变,IGHV突变患者中两治疗方案组3年PFS率均为88%[22]。(2)伴del(17p)和(或)TP53突变的初治CLL/SLL患者:既往研究显示具有17p缺失和(或)TP53突变的CLL/SLL患者对于初始免疫化疗反应较差或达到缓解后易复发,推荐首选BTK抑制剂治疗。关于BTK抑制剂治疗del(17p)和(或)TP53突变的初治CLL/SLL患者的主要研究见表2[17,19,21,23,24]。RESONATE-2研究中伊布替尼单药治疗非del(17p)的伴TP53突变12例患者,中位随访5年,中位PFS未达到,5年估计OS率56%[17]。Alliance研究中伴del(17p)患者,与BR组相比,含伊布替尼的治疗组PFS时间延长[19]。SEQUOIA研究纳入109例17p缺失患者,经泽布替尼单药治疗后中位随访22个月,总反应率(ORR)达到94.5%,预估18个月PFS率和OS率分别为90.6%和95.1%[23]。ELEVATE-TN研究中位随访46.9个月,del(17p)和(或)TP53突变患者阿卡替尼单药及联合奥妥珠单抗治疗48个月PFS率明显高于苯丁酸氮芥联合奥妥珠单抗治疗组[21,24]。

布鲁顿酪氨酸激酶抑制剂治疗不伴del(17p)和(或)TP53突变初治老年或有严重伴随疾病年轻慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者的研究汇总
布鲁顿酪氨酸激酶抑制剂治疗不伴del(17p)和(或)TP53突变初治老年或有严重伴随疾病年轻慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者的研究汇总
| 研究名称 | 研究设计 | 纳入患者 | 干预方案/患者数 | 研究结果 |
|---|---|---|---|---|
| RESONATE-2[17] | Ⅲ期,随访至7年 | 初治、≥65岁或65~69岁由于合并疾病不适合FCR方案,排除del(17p) | 伊布替尼/136例,苯丁酸氮芥/133例 | 伊布替尼:中位PFS时间未达到,6.5年PFS率61%,中位OS时间未达到,6.5年OS率78%;苯丁酸氮芥:中位PFS时间15个月,6.5年PFS率9% |
| SEQUOIA[18] | Ⅲ期,泽布替尼组、BR方案组分别中位随访26.4、25.9个月 | 初治、≥65岁或不适合FCR方案,排除del(17p) | 泽布替尼/241例,BR方案/238例 | 泽布替尼:2年PFS率85.5%,中位PFS时间未达到;BR方案:2年PFS率69.5%,中位PFS时间未达到 |
| Alliance[19] | Ⅲ期,中位随访38个月 | 初治、≥65岁 | 伊布替尼/182例,伊布替尼+利妥昔单抗/182例,BR方案/183例 | 伊布替尼:2年PFS率87%,中位PFS时间未达到;伊布替尼+利妥昔单抗:2年PFS率88%,中位PFS时间未达到;BR方案:2年PFS率74%,中位PFS时间43个月 |
| iLLUMINATE[20] | Ⅲ期,中位随访31个月 | 初治、不适合氟达拉滨、≥65岁或<65伴有CIRS>6分或CrCl<70 ml/min或del(17p)/p53突变 | 伊布替尼+奥妥珠单抗/113例,苯丁酸氮芥+奥妥珠单抗/116例 | 伊布替尼+奥妥珠单抗:30个月PFS率79%,中位PFS时间未达到;苯丁酸氮芥+奥妥珠单抗:30个月PFS 3率1%,中位PFS时间19个月 |
| ELEVATE-TN[21] | Ⅲ期,中位随访46.9个月 | 初治、≥65岁或18~65岁伴有合并疾病 | 阿卡替尼+奥妥珠单抗/179例,阿卡替尼/179例,苯丁酸氮芥+奥妥珠单抗/177例 | 阿卡替尼+奥妥珠单抗:中位PFS时间未达到,48个月PFS率87%,48个月OS率93%;阿卡替尼:中位PFS时间未达到,48个月PFS率78%,48个月OS率88%;苯丁酸氮芥+奥妥珠单抗:中位PFS时间27.8个月,48个月PFS率25%,48个月OS率88% |
注:CIRS为疾病累积评分;CrCl为肌酐清除率;PFS为无进展生存;OS为总生存;BR为苯达莫司汀+利妥昔单抗;FCR为利妥昔单抗+氟达拉滨+环磷酰胺

布鲁顿酪氨酸激酶抑制剂治疗伴del(17p)和(或)TP53突变初治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者的研究汇总
布鲁顿酪氨酸激酶抑制剂治疗伴del(17p)和(或)TP53突变初治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者的研究汇总
| 研究名称 | 研究设计 | 纳入患者 | 干预方案/突变情况/患者数 | 研究结果 |
|---|---|---|---|---|
| RESONATE-2[17] | Ⅲ期,随访至7年 | 初治、≥65岁或65~69岁由于合并疾病不适合FCR方案,排除del(17p) | 伊布替尼/仅TP53突变/12例 | 伊布替尼:中位随访5年,中位PFS时间未达到,5年OS率56% |
| Alliance[19] | Ⅲ期,中位随访38个月 | 初治、≥65岁 | 伊布替尼/del(17p)/9例,伊布替尼+利妥昔单抗/del(17p)/11例,BR方案/del(17p)/14例 | 伊布替尼:中位PFS时间未达到;伊布替尼+利妥昔单抗:中位PFS时间未达到;BR方案:中位PFS时间7个月 |
| SEQUOIA[23] | Ⅲ期,中位随访22个月 | 初治、≥ 65岁或<65岁不适合使用FCR方案 | 泽布替尼/del(17p)/109例 | ORR 94.5%,CR/CRi率6.4%,18个月PFS率90.6%,18个月OS率95.1% |
| ELEVATE-TN[21,24] | Ⅲ期,中位随访46.9个月 | 初治、≥65岁或18~65岁有合并疾病 | 阿卡替尼+奥妥珠单抗/del(17p)/25例,阿卡替尼/del(17p)/23例,苯丁酸氮芥+奥妥珠单抗/del(17p)/25例 | 阿卡替尼+奥妥珠单抗:48个月PFS率75%;阿卡替尼:48个月PFS率76%;苯丁酸氮芥+奥妥珠单抗:48个月PFS率18% |
注:PFS为无进展生存;OS为总生存;ORR为总反应率;CR为完全缓解;CRi为血细胞计数未完全恢复的完全缓解;BR为苯达莫司汀+利妥昔单抗;FCR为利妥昔单抗+氟达拉滨+环磷酰胺
BTK抑制剂是复发难治CLL/SLL患者的首选治疗药物之一,其可使患者持续缓解,相关的主要研究见表3[5,25,26,27,28,29,30,31,32,33]。RESONATE研究显示,伊布替尼治疗者中位PFS显著优于奥法木单抗治疗者,同时也注意到第1代BTK抑制剂相关不良反应,如高血压、心房颤动及出血风险[25]。以亚洲人群为主(中国患者占85%)的Ⅲ期研究CLL3002对比了伊布替尼与利妥昔单抗治疗情况,结果显示伊布替尼改善了PFS[5]。新一代BTK抑制剂同样表现出了极佳的抗肿瘤活性,并且患者具有良好的耐受性。中国人群泽布替尼的关键研究BGB-3111-205中,中位随访34个月,ORR为87.9%,中位PFS时间未达到;在所有亚组患者中,包括细胞遗传学高危患者在内都获得深度和持久的缓解[26,27]。BGB-3111-AU-003研究显示,泽布替尼单药治疗预计中位PFS时间为61.4个月,且治疗线数小的患者PFS时间更长[28]。奥布替尼单药治疗患者中位随访33.1个月,ORR为93.8%,中位PFS时间未达到[29]。ASCEND研究随访36个月的数据显示,与IdR(idelalisib+利妥昔单抗)或BR方案相比,阿卡替尼组PFS获益更多[30,31]。随着多个BTK抑制剂的上市,不同BTK抑制剂的优化选择越来越受到关注。ALPINE研究头对头对比了泽布替尼和伊布替尼在复发难治CLL/SLL患者中的疗效和安全性,公布的中期分析结果显示,泽布替尼组ORR显著高于伊布替尼组,且泽布替尼组12个月PFS率和OS率更高,泽布替尼能够显著降低疾病进展风险达60%(HR=0.40);在高危基因亚型的亚组分析中泽布替尼疗效同样优于伊布替尼;在安全性方面,泽布替尼组心房颤动、出血等不良事件发生率更低,且无患者因心脏不良事件导致治疗终止,伊布替尼组中有7例患者由于心脏不良事件而终止治疗;这项头对头研究的中期分析结果表明,与伊布替尼相比,泽布替尼在疗效和安全性方面表现更佳[32]。在阿卡替尼和伊布替尼头对头Ⅲ期ELEVATE-RR研究中,中位随访40.9个月,两组患者的PFS相似,与伊布替尼组相比,阿卡替尼组心房颤动、出血事件等发生率更低,而头痛、咳嗽的发生率高,因不良事件而停止治疗的患者比例更低(15%比21%)[33]。
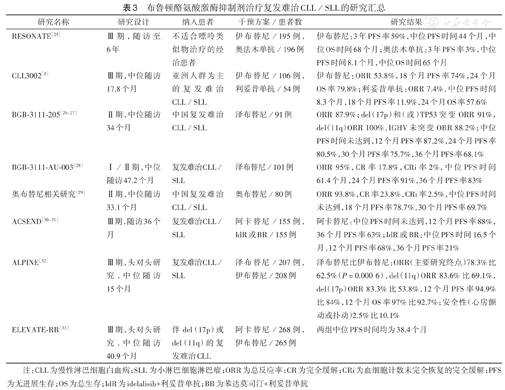
布鲁顿酪氨酸激酶抑制剂治疗复发难治CLL/SLL的研究汇总
布鲁顿酪氨酸激酶抑制剂治疗复发难治CLL/SLL的研究汇总
| 研究名称 | 研究设计 | 纳入患者 | 干预方案/患者数 | 研究结果 |
|---|---|---|---|---|
| RESONATE[25] | Ⅲ期,随访至6年 | 不适合嘌呤类似物治疗的经治患者 | 伊布替尼/195例,奥法木单抗/196例 | 伊布替尼:3年PFS率59%,中位PFS时间44个月,中位OS时间68个月;奥法木单抗:3年PFS率3%,中位PFS时间8.1个月,中位OS时间65个月 |
| CLL3002[5] | Ⅲ期,中位随访17.8个月 | 亚洲人群为主的复发难治CLL/SLL | 伊布替尼/106例,利妥昔单抗/54例 | 伊布替尼:ORR 53.8%,18个月PFS率74%,24个月OS率79.8%;利妥昔单抗:ORR 7.4%,中位PFS时间8.3个月,18个月PFS率11.9%,24个月OS率57.6% |
| BGB-3111-205[26,27] | Ⅱ期,中位随访34个月 | 中国复发难治CLL/SLL | 泽布替尼/91例 | ORR 87.9%;del(17p)和(或)TP53突变ORR 91%,del(11q)ORR 100%,IGHV未突变ORR 88.2%;中位PFS时间未达到,12个月PFS率87.2%,24个月PFS率80.5%,30个月PFS率75.7%,36个月PFS率68.1% |
| BGB-3111-AU-003[28] | Ⅰ/Ⅱ期,中位随访47.2个月 | 复发难治CLL/SLL | 泽布替尼/101例 | ORR 95%,CR率17.8%,CRi率2%,中位PFS时间61.4个月,24个月PFS率91%,36个月PFS率83% |
| 奥布替尼相关研究[29] | Ⅱ期,中位随访33.1个月 | 中国复发难治CLL/SLL | 奥布替尼/80例 | ORR 93.8%,CR率23.8%,CRi率2.5%,中位PFS时间未达到,18个月PFS率78.7%,30个月PFS率69.7% |
| ACSEND[30,31] | Ⅲ期,随访36个月 | 复发难治CLL/SLL | 阿卡替尼/155例,IdR或BR/155例 | 阿卡替尼:中位PFS时间未达到,12个月PFS率88%,36个月PFS率63%;IdR或BR:中位PFS时间16.5个月,12个月PFS率68%,36个月PFS率21% |
| ALPINE[32] | Ⅲ期,头对头研究,中位随访15个月 | 复发难治CLL/SLL | 泽布替尼/207例,伊布替尼/208例 | 泽布替尼比伊布替尼:ORR(主要研究终点)78.3%比62.5%(P=0.000 6),del(11q)ORR 83.6%比69.1%,del(17p)ORR 83.3%比53.8%,12个月PFS率94.9%比84%,12个月OS率97%比92.7%;安全性(心房颤动或扑动)2.5%比10.1% |
| ELEVATE-RR[33] | Ⅲ期,头对头研究,中位随访40.9个月 | 伴del(17p)或del(11q)的复发难治CLL | 阿卡替尼/268例,伊布替尼/265例 | 两组中位PFS时间均为38.4个月 |
注:CLL为慢性淋巴细胞白血病;SLL为小淋巴细胞淋巴瘤;ORR为总反应率;CR为完全缓解;CRi为血细胞计数未完全恢复的完全缓解;PFS为无进展生存;OS为总生存;IdR为idelalisib+利妥昔单抗;BR为苯达莫司汀+利妥昔单抗
MCL是一种罕见的非霍奇金淋巴瘤亚型,存在t(11;14)(q13;q32)细胞遗传学异常,并由此导致CCND1过度表达。
对于初治MCL患者,如常规化疗无法耐受,可考虑起始BTK抑制剂干预;如一线治疗仅达部分缓解(PR)[34],也可考虑使用BTK抑制剂提高疗效。一些使用BTK抑制剂治疗MCL的探索性研究正在进行。正在开展的SHINE研究探索伊布替尼+利妥昔单抗+苯达莫司汀用于初发新诊断老年MCL患者的疗效[35]。正在开展的BGB-3111-306研究计划纳入未接受过治疗且无法进行造血干细胞移植的MCL患者,对比泽布替尼联合利妥昔单抗和苯达莫司汀联合利妥昔单抗对于MCL患者长期PFS的影响[36]。
对于复发难治患者,越早用药生存获益越多,对于首次复发的MCL患者推荐尽早换用BTK抑制剂,以达到更快的缓解和更长时间的生存。在国内外指南中BTK抑制剂均被推荐用于复发难治MCL[37,38]。
BTK抑制剂治疗复发难治MCL患者的主要研究见表4[39,40,41,42,43]。RAY研究中伊布替尼组的ORR和CR率高于西罗莫司组,中位PFS时间长于西罗莫司组,同时显示心房颤动、出血和肺部感染是与伊布替尼用药相关的不良事件[40]。新一代BTK抑制剂在复发难治MCL中的循证医学证据也越来越多[41,42,43],对于复发难治MCL患者,目前也有证据提示尽早启动BTK抑制剂治疗可能使患者有更好的获益。一项泽布替尼治疗复发难治MCL的汇总分析表明,相比后线治疗,接受泽布替尼二线治疗患者的生存期更长[44]。

布鲁顿酪氨酸激酶抑制剂用于复发难治套细胞淋巴瘤的研究汇总
布鲁顿酪氨酸激酶抑制剂用于复发难治套细胞淋巴瘤的研究汇总
| 研究名称 | 研究设计 | 纳入患者 | 干预方案/患者数 | 研究结果 |
|---|---|---|---|---|
| PCYC-1104[39] | Ⅱ期,26.7个月延长随访研究 | 复发难治 | 伊布替尼单药/111例 | ORR 68%,CR率21%,中位PFS时间13.9个月 |
| RAY[40] | Ⅲ期,3年延长随访研究 | 复发难治 | 伊布替尼/139例,西罗莫司/141例 | 伊布替尼比西罗莫司:ORR 77%比47%,CR率23%比3%,PFS时间15.6个月比6.2个月 |
| BGB-3111-206[41] | Ⅱ期 | 复发难治 | 泽布替尼单药/86例 | ORR 83.7%,CR率77.9%,中位PFS时间33个月 |
| ICP-CL-00102[42] | Ⅱ期,随访16.4个月 | 复发难治 | 奥布替尼单药/106例 | ORR 87.9%,CR率34.3%,12个月PFS率70.8% |
| ACE-LY-004[43] | Ⅰ期,26个月延长随访研究 | 复发难治 | 阿卡替尼单药/124例 | ORR 81%,CR率40%,12个月PFS率67%,12个月OS率87% |
注:ORR为总反应率;CR为完全缓解;PFS为无进展生存
对于既往治疗后对伊布替尼、阿卡替尼耐药的复发难治MCL患者,目前也有研究表明可以换用泽布替尼(详见本文"3.6 BTK抑制剂不耐受的患者")。从研究数据来看,新一代BTK抑制剂单药治疗MCL的ORR和CR率普遍高于第1代BTK抑制剂单药治疗,这可能得益于新一代BTK抑制剂的结构优化,使其靶点占有率更高,抑制时间更长。
WM是一种较为少见的惰性BCM,以表达IgM为特征。既往研究证实,MYD88和CXCR4突变在WM的发病中起重要作用。
对于有治疗指征的初治WM患者,尤其是不适合接受化学免疫治疗者,推荐BTK抑制剂单药或联合治疗。可选择伊布替尼±利妥昔单抗以及泽布替尼单药作为优先推荐方案[45],同时该方案也可作为优先推荐方案用于经治WM患者的治疗。
BGB-3111-AU-003研究纳入24例初治患者,中位随访23.5个月,泽布替尼治疗的ORR达100%,预估24个月的PFS率和OS率分别为91.5%和100%[46](表5)。
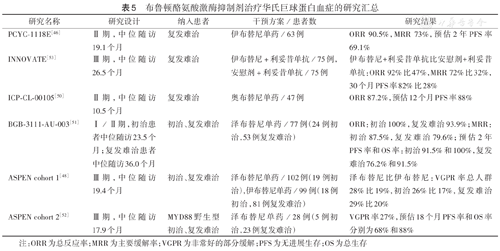
布鲁顿酪氨酸激酶抑制剂治疗华氏巨球蛋白血症的研究汇总
布鲁顿酪氨酸激酶抑制剂治疗华氏巨球蛋白血症的研究汇总
| 研究名称 | 研究设计 | 纳入患者 | 干预方案/患者数 | 研究结果 |
|---|---|---|---|---|
| PCYC-1118E[46] | Ⅱ期,中位随访19.1个月 | 复发难治 | 伊布替尼单药/63例 | ORR 90.5%,MRR 73%,预估2年PFS率69.1% |
| INNOVATE[53] | Ⅲ期,中位随访26.5个月 | 复发难治 | 伊布替尼+利妥昔单抗/75例,安慰剂+利妥昔单抗/75例 | 伊布替尼+利妥昔单抗比安慰剂+利妥昔单抗:ORR 92%比47%,MRR 72%比32%,30个月PFS率82%比28% |
| ICP-CL-00105[50] | Ⅱ期,中位随访10.5个月 | 复发难治 | 奥布替尼单药/47例 | ORR 87.2%,预估12个月PFS率88% |
| BGB-3111-AU-003[51] | Ⅰ/Ⅱ期,初治患者中位随访23.5个月;复发难治患者中位随访36.0个月 | 初治、复发难治 | 泽布替尼单药/77例(24例初治,53例复发难治) | ORR:初治100%,复发难治93.9%;MRR:初治87.5%,复发难治79.6%;预估2年PFS率和OS率:初治91.5%和100%,复发难治76.2%和91.5% |
| ASPEN cohort 1[48] | Ⅲ期,中位随访19.4个月 | 初治、复发难治 | 泽布替尼单药/102例(19例初治),伊布替尼单药/99例(18例初治,81例复发难治) | 泽布替尼比伊布替尼:VGPR率总人群28%比19%,初治26%比17%,复发难治29%比20% |
| ASPEN cohort 2[52] | Ⅲ期,中位随访17.9个月 | MYD88野生型初治、复发难治 | 泽布替尼单药/28例(5例初治,23例复发难治) | VGPR率27%,预估18个月PFS率和OS率分别为68%和88% |
注:ORR为总反应率;MRR为主要缓解率;VGPR为非常好的部分缓解;PFS为无进展生存;OS为总生存
BTK抑制剂单药治疗复发难治WM可获得良好疗效[47],首次复发者优先推荐使用BTK抑制剂,尤其是既往利妥昔单抗方案治疗后1年内复发或治疗无效者。2021年中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南中,WM患者的首选治疗方案增加了伊布替尼±利妥昔单抗或泽布替尼单药方案[38]。对于复发难治WM患者,PCYC-1118E研究中伊布替尼单药治疗63例经治的有症状WM患者的结果显示,整体人群的ORR和主要缓解率(MRR)分别为90.5%和73%[46](表5)。ASPEN研究头对头比较了伊布替尼与泽布替尼治疗WM的疗效,结果显示,在伴MYD88突变的患者中,泽布替尼组具有更高的CR率和非常好的部分缓解(VGPR)率(表5),同时,泽布替尼相比伊布替尼均显示出延长PFS和OS时间的趋势;安全性分析结果显示,对于特别关注的不良事件,泽布替尼组的不良事件发生率均更低[48]。
WM患者的预后存在异质性,其中,MYD88野生型患者的预后较差[49],因此在临床治疗中,MYD88野生型患者的治疗与结局也值得关注。
关于伊布替尼的PCYC-1118E研究中,MYD88和CXCR4野生型患者的ORR和MRR分别为71.4%和28.6%[46],该研究结果也显示MYD88野生型患者对伊布替尼的响应率不理想,预后较差。在奥布替尼治疗WM的研究中,MYD88野生型患者的ORR也仅有25%[50],提示MYD88野生型患者对奥布替尼的应答也较差。关于泽布替尼的BGB-3111-AU-003研究中,MYD88野生型患者治疗后的ORR为100%,MRR为63%,VGPR+CR率为25%[51]。ASPEN cohort 2研究中,泽布替尼单药治疗MYD88野生型患者的ORR为81%,MRR为50%,VGPR为27%[52](表5)。提示对于MYD88野生型患者,泽布替尼可取得较高缓解率。因此初治或复发难治MYD88野生型WM患者均可考虑选择新一代BTK抑制剂泽布替尼治疗。
DLBCL是最常见的B-NHL,在病理形态及生物学行为等方面具有很强的异质性。通过基因分型可以将DLBCL分为生发中心B细胞(GCB)型、活化B细胞(ABC)型及未分类型。
对于初治DLBCL患者目前尚无BTK抑制剂的标准治疗方案,大多基于患者的年龄及预后进行分层后选择合适的方案。除了BTK抑制剂单药治疗外,多在R-CHOP方案的基础上联合治疗。
2019年PHOENIX研究结果表明,在未经治疗的ABC型DLBCL患者中,与安慰剂+R-CHOP方案相比,伊布替尼+R-CHOP方案并未能达到研究主要终点,同时不良事件增加[57](表6)。ACCEPT研究采用阿卡替尼联合R-CHOP方案在38例未经治疗的CD20阳性DLCBL患者中开展单臂试验,中位随访15个月,3例患者PR,未发现严重不良事件[58](表6)。2021年美国血液学会(ASH)年会公布了我国研究者采用泽布替尼、来那度胺联合R-CHOP(ZR2-CHOP)方案治疗10例DLBCL的队列研究结果,根据美国国立综合癌症网络(NCCN)-国际预后指数(IPI)评估,其中7例患者为高-中风险和高风险患者;10例患者完成6个周期治疗,治疗结束时CR率为100%[59](表6);提示ZR2-CHOP方案可作为初治DLBCL患者的治疗选择。

布鲁顿酪氨酸激酶抑制剂治疗弥漫大B细胞淋巴瘤的研究汇总
布鲁顿酪氨酸激酶抑制剂治疗弥漫大B细胞淋巴瘤的研究汇总
| 研究名称或研究者 | 研究设计 | 纳入患者 | 干预方案/患者数 | 研究结果 |
|---|---|---|---|---|
| Wilson等[60] | Ⅰ/Ⅱ期,中位随访11.5个月 | 复发难治 | 伊布替尼单药/80例 | ABC型:ORR 37%,中位PFS时间2.02个月;GCB型:ORR 5%,中位PFS时间1.31个月;整体:ORR 25%,中位PFS时间1.64个月 |
| BGB-3111-AU-003[63] | Ⅰ/Ⅱ期,中位随访5.1个月 | 复发难治 | 泽布替尼单药/26例 | ORR 31%,4例CR,4例PR |
| PHOENIX[57] | Ⅲ期,中位随访34.8个月 | 初治non-GCB | 伊布替尼+R - CHOP/419例,安慰剂+R-CHOP/419例 | 伊布替尼+R - CHOP比安慰剂+R - CHOP:ORR 89.3%比93.1%,CR率67.3%比68%,36个月PFS率70.8%比68.1% |
| Wilson等[61] | Ⅰ/Ⅱ期,中位随访19个月 | 复发难治 | 伊布替尼+来那度胺+DA-EPOCH-R/26例 | 总体:ORR 62%;non - GCB型:ORR 71%;ABC型:ORR 64% |
| Goy等[62] | Ⅱ期,中位随访25.6个月 | 复发难治non-GCB | 伊布替尼+来那度胺+利妥昔单抗/45例 | ORR 38%,CR率24%,中位PFS时间5.5个月 |
| ACCEPT[58] | Ⅰ期,中位随访15个月 | 初治CD20阳性 | 阿卡替尼+R - CHOP/38例 | 24例患者ORR 95%,mCR率82% |
| Zhu等[59] | Ⅱ期,中位随访8个月 | 初治、高风险 | 泽布替尼+来那度胺+R-CHOP/12例 | CR率100% |
注:non-GCB为非生发中心B细胞;ABC为活化B细胞;GCB为生发中心B细胞;ORR为总反应率;CR为完全缓解;mCR为代谢完全缓解;PR为部分缓解;PFS为无进展生存;R-CHOP为利妥昔单抗联合环磷酰胺+多柔比星+长春新碱+泼尼松;DA-EPOCH-R为剂量调整的依托泊苷+泼尼松+长春新碱+环磷酰胺+多柔比星联合利妥昔单抗
对于复发难治患者,多项数据表明非GCB型DLBCL患者使用BTK抑制剂治疗有效[37]。最新的CSCO指南中也新增了新一代BTK抑制剂泽布替尼的治疗方案[38]。
一项伊布替尼单药治疗80例复发难治DLBCL患者的Ⅰ~Ⅱ期临床研究显示,在ABC型、GCB型及所有患者中,ABC型患者ORR最高,同时ABC型患者的中位PFS时间较长[60](表6)。也有伊布替尼+来那度胺+DA-EPOCH-R、伊布替尼+来那度胺+利妥昔单抗等联合方案治疗复发难治DLBCL的研究,ORR分别达到了62%和38%[61,62](表6)。BGB-3111-AU-003 Ⅱ期单臂研究采用泽布替尼单药治疗复发难治DLBCL,ORR为31%[63](表6)。
对4项关于泽布替尼单药或联合治疗121例复发难治DLBCL患者的研究再分析结果显示,泽布替尼治疗myc和bcl-2双表达患者ORR较非双表达患者高[61%(11/18)比29%(11/38),P=0.12],同时也发现含泽布替尼方案治疗CD79B患者ORR高[60%(15/25)比26.9%(14/52),P=0.005][64]。提示患者如存在myc和bcl-2双表达或CD79B突变,可以考虑使用泽布替尼单药或联合治疗方案。
同时,也有一些正在进行的BTK抑制剂治疗复发难治DLBCL患者的早期研究,如MK-1026、Loxo-305等[65,66]。目前BTK抑制剂在DLBCL中的临床应用主要是联合使用。对于其在一些特殊亚组人群中的应用仍需要进一步探索。
原发性或继发性CNSL患者的预后均不佳[67]。近年来陆续有个案报道和临床前研究结果证实BTK抑制剂或可作为一种新的治疗方案改善CNSL患者的生存。
一项伊布替尼单药治疗的Ⅱ期研究结果显示,CNSL患者的ORR为59%,CR率为23%[68]。PROSPECT Ⅰ期研究结果显示,tirabrutinib治疗后复发难治的原发性CNSL患者的ORR为64%(28/44),其中5例患者达到CR,该研究正在进行Ⅱ期探索[49]。泽布替尼用于CNSL患者有个案报道,使用泽布替尼治疗3个周期后,既往接受大剂量甲氨蝶呤(HD-MTX)后疾病进展的患者达CR[70]。一项回顾性病例分析中纳入接受含泽布替尼方案治疗的13例DLBCL患者(8例CNSL和5例系统性DLBCL,其中61.5%为复发难治,84.6%有中枢神经系统累及),治疗评估显示,泽布替尼用于伴中枢神经系统累及DLBCL患者的ORR为84.5%,CR率为76.9%[71]。提示泽布替尼可使CNSL患者临床获益。关于奥布替尼的ICP-CL-00106研究正在进行中,目前仅公布了临床前研究结果,显示其可透过血脑屏障[72]。
MZL和FL是起源于滤泡生发中心的惰性NHL[73],目前靶向治疗被认为是治疗选择之一。2021年CSCO淋巴瘤诊疗指南中,对于Ⅲ、Ⅳ期有症状患者二线方案推荐使用伊布替尼或泽布替尼[38]。
PCYC-1121研究中伊布替尼单药治疗复发难治MZL的ORR为48%,中位PFS时间为14.2个月[74]。伊布替尼单药治疗复发难治FL的ORR为37.5%[34]。新一代BTK抑制剂泽布替尼单药治疗MZL和FL均能获得较高的缓解率。一项关于17例复发难治FL患者的研究结果显示,中位随访7.8个月时的ORR为41%,9例MZL患者ORR为78%[60]。一项泽布替尼联合奥妥珠单抗的临床试验中,36例复发难治FL患者中位随访20个月时的ORR为72%[75]。泽布替尼治疗复发难治MZL患者的一项多中心、Ⅱ期、单臂MAGNOLIA研究纳入68例患者,中位随访15.7个月,ORR为74%,在所有亚型中都观察到了应答,15个月PFS率为82.5%。泽布替尼在复发难治MZL的治疗中表现出高应答率和持久的疾病控制效果,并具有良好的安全性。
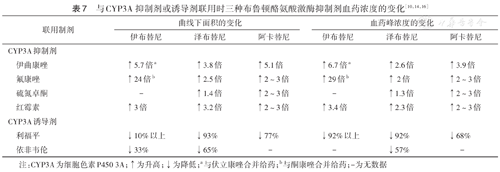
在开始BTK抑制剂治疗前需考虑以下因素。(1)合并疾病:包括出血倾向和对抗凝药的需求,手术需求,心房颤动、高血压等心血管疾病,肝、肾功能损害,乙型肝炎病毒(HBV)感染等;(2)药物与食物相互作用:包括CYP3A抑制剂和诱导剂、葡萄柚和塞尔维亚橙等;(3)感染和疫苗的接种:BTK抑制剂治疗前或治疗过程中可考虑接种疫苗;(4)自身免疫性疾病。需先谨慎评估患者是否存在BTK抑制剂的禁忌证,再开始治疗[76]。
BTK抑制剂主要通过细胞色素P450 3A(CYP3A)代谢,与CYP3A抑制剂或诱导剂联合会影响BTK抑制剂的血药浓度,应避免与强效CYP3A抑制剂或诱导剂联用。3种BTK抑制剂与CYP3A抑制剂或诱导剂联用时血药浓度变化见表7[10,14,16],目前未开展奥布替尼药物相互作用临床研究。
| 联用制剂 | 曲线下面积的变化 | 血药峰浓度的变化 | |||||
|---|---|---|---|---|---|---|---|
| 伊布替尼 | 泽布替尼 | 阿卡替尼 | 伊布替尼 | 泽布替尼 | 阿卡替尼 | ||
| CYP3A抑制剂 | |||||||
| 伊曲康唑 | ↑5.7倍a | ↑3.8倍 | ↑5.1倍 | ↑6.7倍a | ↑2.6倍 | ↑3.9倍 | |
| 氟康唑 | ↑24倍b | ↑2.5倍 | ↑2~3倍 | ↑29倍b | ↑ 2倍 | ↑2~3倍 | |
| 硫氮卓酮 | - | ↑1.4倍 | ↑2~3倍 | - | ↑1.3倍 | ↑2~3倍 | |
| 红霉素 | ↑3倍 | ↑3.2倍 | ↑2~3倍 | ↑3.4倍 | ↑2.3倍 | ↑2~3倍 | |
| CYP3A诱导剂 | |||||||
| 利福平 | ↓10%以上 | ↓93% | ↓77% | ↓92%以上 | ↓92% | ↓68% | |
| 依非韦伦 | ↓33% | ↓65% | - | - | ↓57% | - | |
注:CYP3A为细胞色素P450 3A;↑为升高;↓为降低;a与伏立康唑合并给药;b与酮康唑合并给药;-为无数据
目前,对BCM治疗方案的选择高度个体化,基因突变检测在血液肿瘤分类、确定血液病病因及发病机制中发挥重要作用,建议在治疗前或疗效不佳的情况下对患者进行相应的基因检查。(1)MCL:检测TP53突变情况;(2)CLL/SLL:检测del(11q)、del(17p)/TP53缺失或突变及IGHV突变状态等[77];(3)WM:检测MYD88 L265P和CXCR4 WHIM突变;(4)DLBCL:检测MYD88 L265P、CD79b、bcl-6、bcl-2、Notch1/2及myc等基因突变情况[78]。
使用BTK抑制剂治疗过程中应定期根据相关疾病指南进行疗效评估。通常治疗后3~6个月可见相关指标的改善,且患者生命质量得到显著提高。此外,BTK抑制剂治疗后可能会出现短暂的淋巴细胞增多,淋巴结、脾脏缩小,淋巴细胞增多一般在最初几周出现,部分患者会持续数月,随后多可消退,此时单纯的淋巴细胞增多不作为疾病进展表现,需结合相关指南对淋巴细胞增多的患者进行疗效评估[79]。
临床数据显示BTK抑制剂整体安全性及耐受性良好。发生的不良事件多为1~2级,≥3级不良事件发生率低,且随治疗时间延长而减少,因不良事件停药率低。第1代BTK抑制剂伊布替尼存在脱靶效应,可非特异性作用于其他激酶,与其他重要信号通路蛋白相互影响,治疗过程中常见的不良事件有出血、感染、心房颤动、腹泻等。新一代BTK抑制剂靶点更为精准,减少了脱靶效应,治疗过程中与BTK抑制剂相关不良反应发生率很低,常见的不良事件为中性粒细胞减少、血小板减少症、皮疹、青肿和白细胞减少等,可按说明书和相关指南进行管理。
出血是伊布替尼治疗中较为常见的不良事件,而其在新一代BTK抑制剂治疗中发生较少,其发生机制尚不清楚。对于MCL患者,泽布替尼和阿卡替尼治疗中分别有2.3%和1.3%的患者发生了3级或更高级别的出血事件[43,80],而伊布替尼略高(6%)[40]。BTK抑制剂可能会增加接受抗血小板或抗凝治疗患者的出血风险,应监测患者的出血迹象。研究提示BTK抑制剂联合直接口服抗凝剂(DOAC)(如利伐沙班、达比加群酯、阿哌沙班等)后出血风险可能会降低[81],但目前仍需关注抗凝药物和BTK抑制剂联合应用的风险,应根据患者的临床情况充分评估获益和风险[82]。
如出现与治疗有关的3级或以上的出血,应永久终止治疗,除非导致出血的疾病可以治愈并且再出血风险可以接受(如胃溃疡所致的胃肠道出血)。一旦发生颅内出血,应永久终止治疗。
需接受手术的患者应根据手术类型和出血的风险进行风险和获益评估,考虑在术前和术后暂停用药3~7 d,而后可考虑重新开始服用。
BTK抑制剂治疗中发生的感染多为1~2级,一般无需调整剂量。对于发生≥3级感染的患者,机会性感染风险增加,如治疗期间出现发热或其他感染迹象,应通过彻底检查确定病因和病原微生物,并按照指南进行适当的抗感染治疗;感染高危患者需考虑对单纯疱疹病毒、耶氏肺孢子菌肺炎和其他感染进行预防性治疗。需监测和评估患者是否出现发热或其他感染的症状和体征,并给予相应治疗。此外,老年及先前接受过多线化疗的患者往往免疫力降低,易发生感染,必要时可予静脉注射丙种球蛋白支持治疗。
BTK抑制剂相关临床研究中偶有HBV再激活的报道,对于HBV再激活的影响尚不清楚。由于我国为乙型肝炎高流行区,建议在开始BTK抑制剂治疗前确定患者HBV感染情况,检测HBV表面抗原(HBsAg)和抗乙型肝炎核心抗体(HBc),HBsAg或抗HBc阳性后检测HBV DNA水平。若患者当下或既往有HBV感染,建议在开始治疗前咨询肝炎专科医师,并依据当地诊疗情况常规监测管理,以防止乙型肝炎复发。在临床试验中抗HBc阳性患者须接受预防性抗HBV治疗。
伊布替尼相关临床研究中常见心房颤动不良事件,可能与其对心脏磷酸肌醇3激酶(PI3K)的抑制有关[83]。与第1代BTK抑制剂不同,新一代BTK抑制剂治疗中几乎极少发生心房颤动。新一代BTK抑制剂和伊布替尼头对头的研究已经陆续公布了数据,在WM患者中进行的ASPEN研究安全性结果显示,泽布替尼和伊布替尼的心房颤动发生率分别为2.0%、15.3%,差异有统计学意义[48]。在CLL/SLL患者中进行的ALPINE研究以心房颤动作为次要研究终点,中期分析结果显示,泽布替尼和伊布替尼的心房颤动发生率分别为2.5%、10.1%,泽布替尼组显著低于伊布替尼组[32]。阿卡替尼和伊布替尼头对头的ELEVATE研究同样显示阿卡替尼组心房颤动发生率低于伊布替尼组[21]。存在心脏风险因素、伴有高血压和急性感染的患者发生心律失常的风险可能会增加,因此对于有心房颤动危险因素的患者,推荐优先选择泽布替尼治疗。
在治疗期间应定期监测患者是否发生心律失常,对于出现室性心动过速的症状和(或)体征的患者应暂停伊布替尼治疗,并在可能重新开始治疗前进行全面的临床获益及风险评估。出现心律不齐症状(如心悸、头晕、昏厥、胸部不适或新发呼吸困难)的患者应进行临床评价,根据指征接受心电图(ECG)检查。出现心房颤动时应及时调整治疗,对于出现症状和(或)不能完全控制的心房颤动患者,在心房颤动得到充分控制后,根据医生的评估,可按起始剂量或减半剂量重新开始给药。
首先应反复评估确定疾病是否进展,如确认疾病进展,仍建议继续给予BTK抑制剂治疗并联合其他治疗,因为如果立即停止BTK抑制剂治疗可能会加快复发速度,待相关治疗起效后再考虑减量或停用BTK抑制剂。此外,也可尝试在临床试验中BTK抑制剂治疗基础上联合其他新药方案治疗。
相当一部分接受BTK抑制剂持续治疗的患者因药物不耐受而停止治疗[85],药品说明书中提供了关于短暂停药和减量的一般指导,对症治疗可能改善患者耐受性以尽量延长疗程,从而增加治疗获益。新一代BTK抑制剂因结构优化减少了脱靶效应,从而安全性更好。
关于既往BTK抑制剂(伊布替尼、阿卡替尼)不耐受的复发难治BCM(CLL/SLL、MCL、MZL或WM)患者接受泽布替尼治疗的单臂、开放、多中心Ⅱ期BGB-3111-215研究初步结果显示,泽布替尼在64例患者(包括CLL患者48例)中表现出良好的疗效和耐受性,既往BTK抑制剂相关的不良事件大部分没有发生或严重程度降低。75%伊布替尼不耐受事件在接受泽布替尼治疗后未再发生,再次发生的90%为更低级别。75%阿卡替尼不耐受事件在接受泽布替尼治疗后未再发生,再次发生的33%为更低级别。所有4级不耐受事件和68.3%的3级不耐受事件在接受泽布替尼治疗后均未再发生。没有患者发生更高级别的既往BTK抑制剂不耐受事件,也无患者因发生既往BTK抑制剂不耐受事件而导致停用泽布替尼。同时,89.6%的患者疾病稳定或缓解[86,87]。
在采用阿卡替尼治疗伊布替尼不耐受的60例CLL患者的Ⅱ期临床研究中,将入组患者对阿卡替尼的耐受性与既往对伊布替尼的耐受性进行了比较,结果显示,40%患者在阿卡替尼治疗期间出现了与既往伊布替尼治疗时相同的不良事件,其中67%的不良事件级别低于伊布替尼治疗;且在伊布替尼治疗期间发生过的不良事件中,57%未在阿卡替尼治疗时出现[88]。
针对BTK抑制剂的原发性和继发性耐药问题,目前也有多种非共价结合的可逆性BTK抑制剂处于临床开发阶段。抗耐药可逆性BTK抑制剂pirtobrutinib(LOXO-305)在前期研究中显示可用于治疗NHL[89],Ⅲ期临床研究正在进行中[90];MK-1026(ARQ 531)既能抑制野生型也能抑制C481S突变型BTK[91],目前其针对包括CLL/SLL、MCL、MZL、FL和WM在内的BCM Ⅱ期临床研究正在进行[92]。此外,国内也有尚在研发阶段的可逆性BTK抑制剂,如已公开报道的HBW-3-10、HBW-3-20,并正预备开展相关临床试验。可逆性BTK抑制剂的研发和面世可为未来BCM的诊疗提供更多的可选方案。
BTK是BCR信号通路的关键蛋白,BTK抑制剂无法彻底清除BTK,容易产生耐药。而蛋白水解靶向嵌合体(PROTAC)技术可持续降解新生或原有的BTK蛋白。PROTAC分子由3个部分组成,一端是结合靶蛋白的配体,另一端是E3泛素连接酶识别结构,二者通过连接子相连。PROTAC分子可在细胞内诱导目标蛋白泛素化,进而被蛋白酶识别并降解。PROTAC可实现对靶向特定蛋白的整体降解,可能克服传统小分子抑制剂的耐药性问题。
2021年初我国海思科医药集团的BTK PROTAC分子HSK 29116申报临床试验,为全球首个申报临床试验的口服BTK PROTAC小分子抗肿瘤药物。2021年8月16日,北京百济神州公司在clinicaltrials.gov网站注册了BGB-16673的Ⅰ期临床试验,计划入组76例B细胞淋巴瘤患者,同年10月在我国也申报了临床试验。已公开报道的BTK PROTAC分子结构有Covalent PROTAC 2、Reversible PROTAC 3、Covalent PROTAC 4、Reversible PROTAC 5、RC-3、IR-2、NC-1。也有一些靶向BTK突变体的PROTAC分子在研发中,如P131、L181、DD-03-171[93]。
BTK抑制剂为BCM的治疗带来了新选择。伊布替尼、泽布替尼、奥布替尼、阿卡替尼等在CLL/SLL、MCL及WM的治疗中已显示出良好的临床疗效,且耐受性优于传统化疗及化学免疫治疗方案,尤其适用于老年或无法耐受常规化疗的患者。对不同BTK抑制剂的比较正成为临床应用的焦点,ALPINE及ASPEN等BTK抑制剂的头对头研究对于BTK抑制剂的优化选择一定程度上提供了指导依据。同时,第1代BTK抑制剂不耐受的患者也可考虑替换新一代BTK抑制剂,以改善疗效及安全性。
目前尚有一些新型BTK抑制剂正在研发。此外,已有研究显示BTK抑制剂与bcl-2抑制剂、嵌合抗原受体T细胞(CAR-T)等新药物、新疗法及与传统化疗药物间可能具有协同作用,大量联合方案的探索研究也在进行中。BTK PROTAC技术可持续降解新生或原有的BTK蛋白,期待未来有更多研究进展,带给患者更多的治疗选择。
执笔者 赵东陆、马军、朱军
审阅 沈志祥、吴德沛、李小秋
专家组成员(按姓氏汉语拼音字母排序) 白鸥(吉林大学白求恩第一医院)、蔡清清(中山大学肿瘤防治中心)、曹军宁(复旦大学附属肿瘤医院)、冯茹(南方医科大学南方医院)、胡豫(华中科技大学同济医学院附属协和医院)、黄慧强(中山大学肿瘤防治中心)、纪春岩(山东大学齐鲁医院)、金洁(浙江大学医学院附属第一医院)、李建勇(南京医科大学第一附属医院)、李小秋(复旦大学附属肿瘤医院)、李志铭(中山大学肿瘤防治中心)、马军(哈尔滨血液病肿瘤研究所)、牛挺(四川大学华西医院)、邱录贵[中国医学科学院血液病医院(中国医学科学院血液学研究所)]、沈志祥(上海交通大学医学院附属瑞金医院)、宋永平(郑州大学附属第一医院)、宋玉琴(北京大学肿瘤医院)、苏丽萍(山西省肿瘤医院)、陶荣(复旦大学附属肿瘤医院)、王季石(贵州医科大学附属医院)、王欣(山东省立医院)、吴德沛(苏州大学附属第一医院)、徐卫(南京医科大学第一附属医院)、杨海燕(浙江省肿瘤医院)、张会来(天津医科大学肿瘤医院)、张明智(郑州大学附属第一医院)、张清媛(哈尔滨医科大学附属肿瘤医院)、张曦(陆军军医大学第二附属医院)、赵东陆(哈尔滨血液病肿瘤研究所)、赵维莅(上海交通大学医学院附属瑞金医院)、周道斌(北京协和医院)、周辉(湖南省肿瘤医院)、周可树(河南省肿瘤医院)、朱军(北京大学肿瘤医院)
所有作者均声明不存在利益冲突