
探讨阿扎胞苷联合低剂量HAG方案治疗新诊断不适合强化疗老年急性髓系白血病(AML)患者的效果及安全性。
前瞻性纳入深圳市第二人民医院2019年7月至2021年9月收治的18例新诊断不适合强化疗的老年AML患者,非随机分为阿扎胞苷联合HAG方案(AZA-HAG)组9例和地西他滨联合HAG方案(DEC-HAG)组9例。研究主要终点为总体有效[完全缓解(CR)+部分缓解],次要终点包括CR+伴血细胞计数不完全恢复的完全缓解(CRi)、总生存(OS)和药物安全性。采用Kaplan-Meier法分析OS。
18例患者中位年龄为67岁(60~77岁),其中8例为预后高危组。AZA-HAG组治疗1个疗程后总体有效及CR+CRi均7例,DEC-HAG组均8例,两组差异均无统计学意义(均P=1.000)。两组CR+CRi中位持续时间均为7个月,中位OS时间均为12个月;两组OS差异无统计学意义(χ2=0.02,P=0.895)。AZA-HAG组1例TP53突变和1例ASXL1+RUNX1突变患者均获得CR,1例NPM1野生型合并FLT3-ITD、ASXL1突变患者未缓解。两组3~4级血液学不良反应发生率差异均无统计学意义(均P>0.05)。
阿扎胞苷联合低剂量HAG方案治疗新诊断不适合强化疗老年AML患者的效果及远期生存较理想,不良反应可耐受。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是一种造血系统恶性肿瘤,患者诊断时中位年龄为68岁[1,2]。老年AML患者2、5年总生存(OS)率低,分别约为10%和2%[3,4]。为控制病情并维持较高生命质量,老年AML患者通常选择非治愈性、低强度的化疗方法。美国国立综合癌症网络(NCCN)和欧洲血液学会推荐新诊断老年AML患者使用去甲基化药物(HMA),包括阿扎胞苷或地西他滨[5,6]。然而二者单药治疗老年AML患者缓解率仅10%~50%,中位OS时间不足1年[7,8,9,10]。HAG方案已在国内广泛用于老年AML患者,CR率高达62%[11,12,13,14]。高三尖杉酯碱(HHT)联合标准剂量柔红霉素和阿糖胞苷(HAD)方案治疗新诊断原发AML患者具有较好的OS和无进展生存(PFS)[15]。还有研究表明阿扎胞苷与HHT具有协同作用,可显著增加AML细胞凋亡[16]。本研究旨在探讨阿扎胞苷联合低剂量HAG方案治疗新诊断不适合强化疗的老年AML患者的效果及安全性。
纳入标准:年龄≥60岁;新诊断AML;不适合进行强化疗;美国东部肿瘤协作组(ECOG)评分≤2分;签署知情同意书。排除标准:伴其他恶性肿瘤;3个月内接受过免疫调节治疗、HMA、化疗等治疗;有严重心脏病史;有严重肝肾功能异常;意识不清或有精神疾患不能配合诊疗;对治疗药物成分过敏。
前瞻性选取2019年7月至2021年9月我院收治的18例符合纳入、排除标准的患者作为研究对象,非随机分为阿扎胞苷联合HAG方案(AZA-HAG)组9例和地西他滨联合HAG方案(DEC-HAG)组9例。本研究为Ⅲ期前瞻性临床研究(ClinicalTrials.gov注册号:NCT03873311),根据《赫尔辛基宣言》原则和良好临床实践指南设计,获得深圳市第二人民医院伦理委员会批准(批准文号:20200601003-FS01),患者均知情同意并签署知情同意书。
AZA-HAG组给予阿扎胞苷75 mg/m2皮下注射,1次/d,第1天至第7天;DEC-HAG组给予地西他滨每天20 mg/m2静脉滴注,第1天至第5天。同时两组患者均接受HAG方案治疗:HHT每天1 mg/m2静脉滴注,1次/d,第1天至第14天(如发生4级中性粒细胞减少则为第1天至第7天);阿糖胞苷每天10 mg/m2皮下注射,2次/d,第1天至第14天;粒细胞集落刺激因子每天200 μg/m2皮下注射,第1天至第14天,至中性粒细胞绝对值>10×109/L;每28 d为1个疗程。
两组均给予止吐、保肝、预防感染等对症支持治疗;当血红蛋白<70 g/L时输注去白红细胞悬液;当血小板计数<20×109/L或具有明显出血倾向时,输注单采血小板、皮下注射血小板生成素。
每个疗程结束后根据国际工作组AML治疗反应标准评估患者临床疗效[17,18],分为完全缓解(CR)、部分缓解(PR)、未缓解。根据世界卫生组织急性及亚急性治疗药物不良反应分级标准对不良反应进行分级,主要包括血液学不良反应、骨髓抑制、感染等。主要研究终点:总体有效(CR+PR)。次要研究终点:CR+伴血细胞计数不完全恢复的完全缓解(CRi)、首次达CR+CRi时间、CR+CRi持续时间、OS和药物安全性等。通过住院和打电话方式进行随访,截止时间2021年9月。OS时间定义为从开始治疗至死亡或末次随访的时间。按照2022 NCCN指南评定患者预后。
采用Stata 14.0软件分析数据。计数资料以频数(%)表示,组间比较采用Fisher确切概率法;生存分析采用Kaplan-Meier法,并行log-rank检验。以P<0.05为差异有统计学意义。
18例患者中位年龄为67岁(60~77岁),其中8例为预后高危组。AZA-HAG组≥75岁1例;男性7例;ECOG评分0~1分7例,2分2例;合并糖尿病3例,高血压2例,冠心病1例,结核1例;原发性AML 8例,继发于骨髓增生异常综合征(MDS)1例;FLT3-ITD或TKD突变1例,IDH1或IDH2突变1例,NPM1突变4例,TP53突变1例;预后良好5例,中等1例,不良3例;起病时骨髓原始细胞比例<0.30 5例,≥0.30且<0.50 1例,≥0.50 3例;起病时外周血白细胞计数<10×109/L 5例,≥10×109/L 4例。AZA-HAG组≥75岁2例;男性3例;ECOG评分0~1分6例,2分3例;合并糖尿病2例,高血压2例,冠心病1例,支气管炎1例;原发性AML 6例,继发于MDS 3例;FLT3-ITD或TKD突变3例,IDH1或IDH2突变1例,NPM1突变4例,TP53突变2例;预后良好3例,中等1例,不良5例;起病时骨髓原始细胞比例<0.30 2例,≥0.30且<0.50 2例,≥0.50 5例;起病时外周血白细胞计数<10× 109/L 4例,≥10×109/L 5例。两组患者基线资料比较,差异均无统计学意义(均P>0.05)。
AZA-HAG组治疗1个疗程后总体有效及CR+CRi均7例,DEC-HAG组均8例,差异均无统计学意义(均P=1.000)。AZA-HAG组1例TP53突变和1例ASXL1+ RUNX1突变患者均获CR,1例NPM1野生型合并FLT3-ITD、ASXL1突变患者未缓解。AZA-HAG组中位达CR+CRi时间为1.5个月(0.5~3.0个月)。中位随访12个月(1~20个月),随访率100%。两组CR+CRi中位持续时间均为7个月,中位OS时间均为12个月;两组OS差异无统计学意义(χ2=0.02,P=0.895)(图1)。
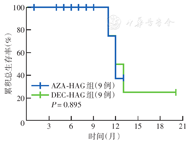

注:HAG为高三尖杉酯碱+阿糖胞苷+粒细胞集落刺激因子方案;AZA-HAG为阿扎胞苷联合低剂量HAG方案;DEC-HAG为地西他滨联合低剂量HAG方案
18例患者均发生不同程度血液学不良反应。AZA-HAG组与DEC-HAG组3~4级血液学不良反应包括贫血(6例比6例)、白细胞减少(9例比9例)、发热性中性粒细胞减少(7例比8例)、血小板减少(9例比7例),差异均无统计学意义(均P>0.05)。18例患者骨髓抑制恢复的中位时间为13.5 d(7~20 d)。AZA+HAG组患者均发生感染,以肺部感染最常见。其他常见非血液学不良反应包括恶心和腹泻,给予护胃、止吐等支持治疗后均可好转。
阿扎胞苷是一种核苷类代谢抑制剂,可双重去甲基化作用于肿瘤细胞DNA和RNA,抑制蛋白合成,并对G1期细胞具有显著的抗肿瘤活性[19]。单药阿扎胞苷治疗AML患者的缓解率仅10%~50%[7,8,9,20,21],中位OS时间仅6~12个月[22,23]。体外研究证实,HHT通过调节SP1-TET1-5hmC21通路表达水平,调节DNA表观遗传学改变,达到有效抗肿瘤效果[16]。另有研究表明HHT与阿扎胞苷具有协同作用,可更有效抑制肿瘤细胞集落形成,显著增强体外AML细胞凋亡能力[24]。本研究显示,阿扎胞苷联合低剂量HAG方案治疗新诊断不适合强化疗老年AML患者1个疗程后的总体有效率和CR+CRi率均较高(均7/9),且达CR+CRi时间短,优于单用阿扎胞苷(3.5个月)或单用地西他滨(4.3个月)[8,9]。
HMA联合维奈克拉400 mg治疗新诊断老年AML患者的CR+CRi率为73%,首次缓解的中位时间为1.2个月(0.8~13.5个月)[25]。本研究阿扎胞苷联合低剂量HAG方案治疗新诊断不适合强化疗老年AML患者1个疗程后的疗效与上述方案相似,而治疗费用更低,后期需要多中心、大样本临床研究进一步证实。此外,阿扎胞苷联合低剂量HAG方案安全性高,患者可耐受常见的不良反应。
本研究存在一些局限性。因样本量有限,暂无法分析各基因突变亚组患者阿扎胞苷联合低剂量HAG方案疗效,未来可进行大样本前瞻性研究探索药物潜在作用机制。另外,排除了既往接受HMA治疗患者也为本研究的1个局限。
综上所述,本研究结果显示阿扎胞苷联合低剂量HAG方案应用于新诊断不适合强化疗老年AML患者疗效肯定,安全性较高。今后将扩大病例数,进一步探索药物疗效及获得CR后的维持治疗方式,为我国老年白血病人群的整体治疗提供更多选择。
所有作者均声明不存在利益冲突



























