
系统评价基于奥妥珠单抗和基于利妥昔单抗的方案治疗B细胞非霍奇金淋巴瘤(B-NHL)的有效性和安全性。
检索Cochrane临床对照试验资料库、PubMed、Embase、美国血液学会年会会议录、美国临床肿瘤学会年会会议录以及ClinicalTrials数据库中应用含奥妥珠单抗或利妥昔单抗方案治疗B-NHL的相关研究,依据用药情况将患者分为奥妥珠单抗组和利妥昔单抗组。应用Review Manager 5.3软件比较两组的疗效和安全性。
共纳入7项随机对照试验,包括4 235例患者(滤泡淋巴瘤1 430例,弥漫大B细胞淋巴瘤2 102例,其他B-NHL患者703例),奥妥珠单抗组和利妥昔单抗组分别有2 121例和2 114例。在可评价的4 162例患者中,奥妥珠单抗组患者客观缓解率(ORR)高于利妥昔单抗组[75.1%(1 565/2 083)比72.7%(1 512/2 079);OR=1.19,95% CI 1.01~1.41,P=0.03]。奥妥珠单抗组患者无进展生存(PFS)优于利妥昔单抗组(HR=0.86,95% CI 0.75~0.99,P=0.03)。在可评估不良反应的3 542例患者中,奥妥珠单抗组3~4级不良反应发生率高于利妥昔单抗组[61.8%(1 098/1 776)比54.2%(958/1 766);OR=1.50,95% CI 1.29~1.74,P<0.001],其中奥妥珠单抗组3~4级输液相关不良反应发生率[7.5%(158/1 776)比3.1%(65/1 766);OR=2.56,95% CI 1.91~3.45,P<0.001]和中性粒细胞减少发生率[34.1%(597/1 749)比29.4%(511/1 738);OR=1.27,95% CI 1.09~1.47,P=0.002]均高于利妥昔单抗组。
应用基于奥妥珠单抗方案治疗的B-NHL患者ORR和PFS均优于基于利妥昔单抗方案治疗的患者,但在选择方案时应考虑不良反应的影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗CD20单克隆抗体(mAb)介导的免疫治疗显著改善了B细胞非霍奇金淋巴瘤(B-NHL)患者的预后。在标准化疗方案中加入利妥昔单抗(Ⅰ型抗CD20单抗)极大改善了弥漫大B细胞淋巴瘤(DLBCL)和滤泡淋巴瘤(FL)患者的疗效和生存,且安全性较好[1,2]。尽管利妥昔单抗在治疗CD20阳性B-NHL方面取得了较好疗效,但仍有一些患者对初始治疗没有反应或较快复发[1]。为进一步提高免疫化疗的效果、解决利妥昔单抗耐药后的治疗问题,迫切需要一种新型的抗CD20单抗。奥妥珠单抗是第一个人源化Ⅱ型抗CD20单抗,其结构增强了免疫活性,同时尝试克服耐药的出现[3]。与利妥昔单抗相比,奥妥珠单抗被证实具有更强的抗体依赖细胞毒性作用和吞噬作用,而补体依赖细胞毒性降低[4]。目前,奥妥珠单抗多用于慢性淋巴细胞白血病(CLL)和FL的治疗。关于接受奥妥珠单抗治疗患者的疗效和生存是否优于利妥昔单抗的随机对照临床试验正在进行中,但结果并不一致[5,6,7,8,9]。奥妥珠单抗用于B-NHL患者一线和后续治疗的有效性和安全性的随机对照试验(RCT)数据有限,我们对这些文献进行了系统评价,比较基于奥妥珠单抗与基于利妥昔单抗的治疗方案对B-NHL患者疗效、生存和安全性的影响。
选取Cochrane临床对照试验资料库(截至2021年8月)、PubMed(截至2021年8月)、Embase(截至2021年8月)、美国血液学会年会会议录(2018年至2021年)和美国临床肿瘤学会年会会议录(2018年至2021年)以及ClinicalTrails数据库(http://www.clinicaltrials. gov/ct,http://clinicaltrials.nci.nih.gov/,截至2021年8月),交叉检索术语"Obinutuzumab"和类似术语、"Rituximab"和类似术语、"Lymphoma,non-Hodgkin"。阅读按检索策略获得的所有文献;无论发表状态和发表日期,纳入检索到的比较奥妥珠单抗与利妥昔单抗单独或联合其他药物一线和后线治疗B-NHL的RCT,检索所有纳入文献的参考文献。
由2名评价员分别独立从纳入文献中提取数据。如果意见不一致,由第3名评价员再次提取数据,协商一致后获得最终结果。使用Cochrane Collaboration的偏倚风险评估工具评估纳入RCT的偏倚风险,主要评估以下领域:随机序列的产生、分配隐藏、实施者和参与者双盲、结局评估的盲法、不全结局数据和选择性报告,并根据Cochrane手册(6.2版)中规定的标准将评估结果分级为低偏倚风险、不明确风险(缺乏信息或不确定潜在偏倚)或高偏倚风险[10]。
客观缓解率(ORR)、无进展生存(PFS)、总生存(OS)、3级及以上不良反应。根据Lugano 2014标准对疗效进行评价,ORR定义为达到完全缓解(CR)及部分缓解(PR)患者之和在所有可评价疗效患者中的比例。PFS定义为从治疗开始至因任何原因复发或进展或死亡或末次随访的时间。OS定义为从治疗开始至因任何原因死亡或末次随访的时间。根据不良反应通用术语标准(CTCAE)评估不良反应。
采用Review Manager 5.3软件进行Meta分析。采用Q检验和I2统计量进行异质性检验,若PQ<0.1或I2≥50%则各研究结果间存在异质性,采用随机效应模型进行Meta分析,反之则采用固定效应模型。用漏斗图评估文献是否存在发表偏倚。将危险比(HR)作为时间-事件数据的汇总统计指标,HR<1表示有利于患者从含奥妥珠单抗的方案中获益。使用Mantel-Haenszel方法估计二分类数据的比值比(OR)和95%置信区间(CI)。OR>1表示客观缓解和不良反应在基于奥妥珠单抗的方案组中发生更频繁。以P<0.05为差异存在统计学意义。
检索后共产生194条记录,去除重复文献、综述、会议摘要等,得到85篇文献,通过阅读文献题目及摘要后获得9篇文献,阅读全文后纳入7项RCT [6,7,9,11,12,13,14],共4 235例患者,按用药情况将患者分为奥妥珠单抗组和利妥昔单抗组,分别有2 121例和2 114例(表1)。其中一项RCT在60岁以下的患者中进行[6],其他试验的患者中位年龄为48~74岁。在纳入的RCT中,抗CD20抗体单独给药[12],或与CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)[6,7,9]、维奈克拉+CHOP[13]、CVP(环磷酰胺+长春新碱+泼尼松)[7]、ACVBP(多柔比星+环磷酰胺+泼尼松+博来霉素+长春地辛)[6]、苯达莫司汀[7]、度维利塞[11] 、苯丁酸氮芥联用[14]。患者多为Ⅲ期或Ⅳ期B-NHL,包括FL 1 430例[7,11,12,13]、DLBCL 2 102例[6,9,13]和其他B-NHL 703例[CLL和边缘区淋巴瘤(MCL)[12,13,14]]。4 056例患者为初治B-NHL(FL 1 277例,DLBCL 2 102例,其他B-NHL 677例),179例患者为复发难治B-NHL。奥妥珠单抗通常在第1个周期的第1、8、15天及随后每个周期的第1天静脉输注1 000 mg,利妥昔单抗在每个周期的第1天以375 mg/m2静脉输注。有2项RCT进行了奥妥珠单抗或利妥昔单抗维持治疗,其中奥妥珠单抗剂量为每2个月静脉输注1 000 mg,利妥昔单抗为每2个月375 mg/m2[7,12]。
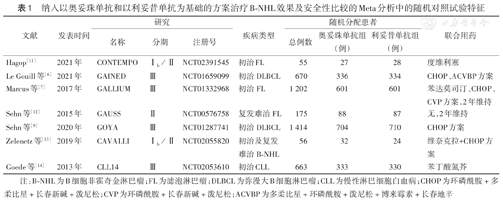
纳入以奥妥珠单抗和以利妥昔单抗为基础的方案治疗B-NHL效果及安全性比较的Meta分析中的随机对照试验特征
纳入以奥妥珠单抗和以利妥昔单抗为基础的方案治疗B-NHL效果及安全性比较的Meta分析中的随机对照试验特征
| 文献 | 发表时间 | 研究 | 疾病类型 | 随机分配患者 | 联合用药 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 名称 | 分期 | 注册号 | 总例数 | 奥妥珠单抗组(例) | 利妥昔单抗组(例) | ||||
| Hagop[11] | 2021年 | CONTEMPO | Ⅰb/Ⅱ | NCT02391545 | 初治FL | 55 | 27 | 28 | 度维利塞 |
| Le Gouill等[6] | 2021年 | GAINED | Ⅲ | NCT01659099 | 初治DLBCL | 670 | 336 | 334 | CHOP、ACVBP方案 |
| Marcus等[7] | 2017年 | GALLIUM | Ⅲ | NCT01332968 | 初治FL | 1 202 | 601 | 601 | 苯达莫司汀、CHOP、CVP方案,2年维持 |
| Sehn等[12] | 2015年 | GAUSS | Ⅱ | NCT00576758 | 复发难治FL | 175 | 88 | 87 | 无,2年维持 |
| Sehn等[9] | 2020年 | GOYA | Ⅲ | NCT01287741 | 初治DLBCL | 1 414 | 704 | 710 | CHOP方案 |
| Zelenetz等[13] | 2019年 | CAVALLI | Ⅰb/Ⅱ | NCT02055820 | 初治及复发难治B-NHL | 56 | 32 | 24 | 维奈克拉+CHOP方案 |
| Goede等[14] | 2013年 | CLL14 | Ⅲ | NCT02053610 | 初治CLL | 663 | 333 | 330 | 苯丁酸氮芥 |
注:B-NHL为B细胞非霍奇金淋巴瘤;FL为滤泡淋巴瘤;DLBCL为弥漫大B细胞淋巴瘤;CLL为慢性淋巴细胞白血病;CHOP为环磷酰胺+多柔比星+长春新碱+泼尼松;CVP为环磷酰胺+长春新碱+泼尼松;ACVBP为多柔比星+环磷酰胺+泼尼松+博来霉素+长春地辛
根据Cochrane偏倚风险评价标准评估显示,5项研究的选择偏倚风险较低(充分的分配隐藏和序列生成);所有研究均为开放标签研究;1项未发表的研究没有报告随机分配生成和隐藏方法,被判断为选择偏倚风险未知(图1)。


注:绿色为低风险;黄色为风险未知
纳入的所有7项RCT均评估了ORR[6,7,9,11,12,13,14]。在可评估疗效的4 162例患者中,奥妥珠单抗组ORR高于利妥昔单抗组[75.1%(1 565/2 083)比72.7%(1 512/2 079);OR=1.19,95% CI 1.01~1.41,P=0.03],各研究结果间无异质性(I2=0)(图2)。组织学类型亚组分析中,FL[7,11,12,13]、DLBCL[6,9,13]、其他类型[13,14]利妥昔单抗组和奥妥珠单抗组间ORR差异均无统计学意义(均P>0.05),各项研究结果间无异质性(I2=0)(图3)。
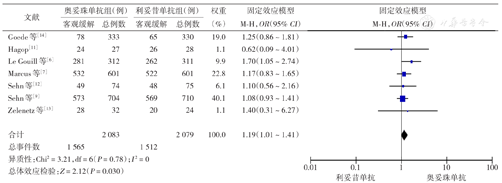

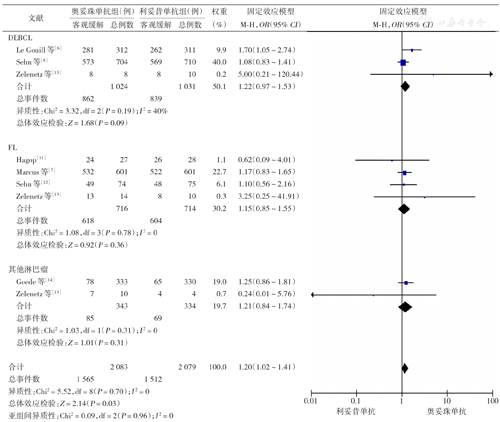

注:DLBCL为弥漫大B细胞淋巴瘤;FL为滤泡淋巴瘤;其他淋巴瘤包括慢性淋巴细胞白血病、套细胞淋巴瘤等
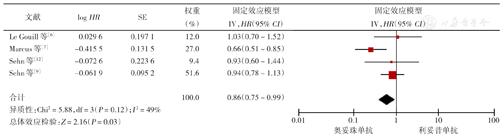
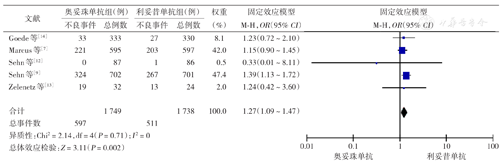
7项RCT中4项用HR评估PFS[6,7,9,12]。与利妥昔单抗组相比,奥妥珠单抗治疗组PFS明显获益(HR=0.86,95% CI 0.75~0.99,P=0.03),各项研究结果间具有中等异质性(I2=49%)(图4)。有4项研究用HR评估了OS[6,7,9],奥妥珠单抗组OS较利妥昔单抗组未显示出更好的获益(HR=0.95,95% CI 0.79~1.15,P=0.61),4项研究结果间无异质性(I2=0)(图5)。

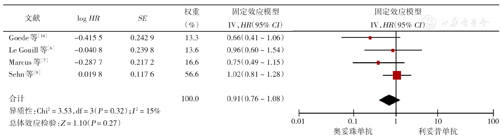

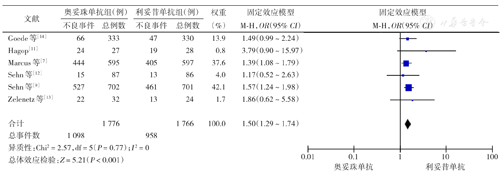
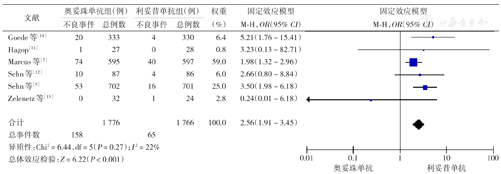
6项RCT报告了3级或4级不良反应的总体发生率[7,9,11,12,13,14],在可评价的3 542例患者中,奥妥珠单抗组3~4级不良反应发生率高于利妥昔单抗组[61.8% (1 098/1 776)比54.2%(958/1 766);OR=1.50,95% CI 1.29~1.74,P<0.001](图6),其中奥妥珠单抗组3~4级输液相关不良反应(IRR)发生率[7.5%(158/1 776)比3.1%(65/1 766);OR=2.56,95% CI 1.91~3.45,P<0.001]和中性粒细胞减低发生率[34.1%(597/1 749)比29.4%(511/1 738);OR=1.27,95% CI 1.09~1.47,P=0.002]均高于利妥昔单抗组,各项研究间的异质性较低(I2值分别为0、22%)(图7、图8)。



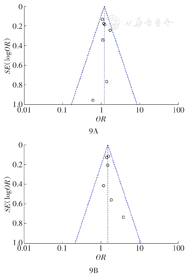
纳入的研究中,大样本试验相对集中分布于漏斗中部,小样本试验散在分布于漏斗底部。因原始资料可能存在发表偏倚,局部可能不规则,但总体未见明显发表偏倚(图9)。

本Meta分析汇总了7项RCT,在4 235例B-NHL患者中比较了应用奥妥珠单抗方案与应用利妥昔单抗方案的疗效及安全性。结果显示,与基于利妥昔单抗的方案相比,基于奥妥珠单抗的方案显著改善了B-NHL患者的ORR和PFS;在奥妥珠单抗组中3~4级不良反应发生的风险增加,其中3~4级IRR及中性粒细胞减低风险均增加。
RCT多采用不同方案联合抗CD20单抗,与接受利妥昔单抗方案患者的疗效相比,虽然接受奥妥珠单抗治疗患者的客观反应略有改善,但本Meta分析B-NHL人群中,基于奥妥珠单抗治疗方案的ORR明显高于利妥昔单抗相关治疗方案(OR=1.19,95% CI 1.01~1.41,P=0.03)。无统计异质性的结果进一步支持了我们的结论[6,7,9,12]。虽然本研究中FL、DLBCL及包括CLL及MCL等其他类型淋巴瘤的亚组分析中基于奥妥珠单抗、利妥昔单抗的治疗方案间ORR差异无统计学意义,但各亚组中均OR>1,提示含奥妥珠单抗的方案较含利妥昔单抗的方案可能有更好的反应趋势。
本研究大部分RCT集中在初治B-NHL中,奥妥珠单抗在复发难治B-NHL的治疗中也体现出巨大的潜力。在GAUSS研究中,患者为接受过至少1种(1~5种)含利妥昔单抗方案治疗的复发难治FL,单独应用奥妥珠单抗患者的ORR高于单独应用利妥昔单抗的患者(44.6%比33.3%,P=0.08)[12]。独立审查小组也证实了这一结果,该小组发现应用奥妥珠单抗较应用利妥昔单抗治疗有更高的ORR(44.6%比26.7%,P=0.01),应用奥妥珠单抗患者中达到CR、未确定的完全缓解(CRu)的患者比例高出应用利妥昔单抗患者近1倍(41.9%比22.7%)。在单臂多中心GALEN研究中,奥妥珠单抗联合来那度胺方案治疗复发难治FL患者ORR达到了84%[15],而MAGNIFY研究中应用来那度胺联合利妥昔单抗治疗的同类患者ORR仅为66%[16]。GADOLIN研究中,奥妥珠单抗加苯达莫司汀治疗后应用奥妥珠单抗维持治疗的最佳反应率为79%,并可提高利妥昔单抗难治的惰性B-NHL患者的生存率[5]。
本Meta分析对4项研究的生存数据汇总分析显示,奥妥珠单抗组的PFS优于利妥昔单抗组(HR=0.86,95% CI 0.75~0.99,P=0.03)。在GALLIUM研究中,1 202例应用奥妥珠单抗方案治疗的初治FL患者3年PFS率高于应用利妥昔单抗治疗者(80.0%比73.3%,P=0.001)[7]。GOYA研究对1 418例初治DLBCL患者分析显示,与利妥昔单抗联合CHOP方案治疗患者相比,奥妥珠单抗联合CHOP方案治疗可稍改善患者PFS(63.8%比62.6%),但差异无统计学意义[9]。GAINED研究也未证实两药治疗的60岁以下初治DLBCL患者PFS存在差异[6]。在本Meta分析中,仅4项研究中报告了OS,且奥妥珠单抗组和利妥昔单抗组间OS差异无统计学意义。奥妥珠单抗与利妥昔单抗相比具有更强的抗体依赖细胞毒性作用和吞噬作用[4],这可能是奥妥珠单抗更能改善CD20阳性B-NHL患者PFS的原因。虽然目前结果未观察到奥妥珠单抗治疗有延长OS的优势,但B-NHL患者的生存时间相对较长,目前数据较少,可能会影响结果,需要延长随访时间进一步观察。
不良反应是临床用药需要考虑的另一个重要因素。B-NHL患者接受奥妥珠单抗方案治疗有更高的3级或4级不良反应发生风险,如更多的感染、IRR、血小板减少症和心脏事件发生[17]。本Meta分析结果与已知的奥妥珠单抗不良反应相关报道一致,相较于利妥昔单抗,奥妥珠单抗治疗发生3 ~ 4级IRR风险更高(7.5%比3.2%)。白细胞介素(IL)-6、IL-8、CCL3和干扰素γ(IFN-γ)等细胞因子的释放可通过减少自然杀伤(NK)细胞的循环快速破坏B细胞,诱导IRR的发生[18,19]。根据GAINED研究的观察结果,IRR通常发生在第1次输注期间[6],通过提前应用对乙酰氨基酚、苯海拉明和糖皮质激素等药物或降低输注速度、暂停输注可减少IRR的发生及降低其严重程度[20]。另外,本Meta分析结果显示,与利妥昔单抗组相比,奥妥珠单抗组3~4级中性粒细胞减低的发生率也较高。予粒细胞集落刺激因子等对症处理后,患者中性粒细胞减低可得到控制。
总之,本Meta分析结果表明将奥妥珠单抗应用于CD20阳性B-NHL的标准治疗中可能改善患者的疗效和生存,奥妥珠单抗引起的不良反应可以通过适当的预处理得到较好控制。但本研究存在一定的局限性:虽然纳入患者包括了初治和复发难治的不同类型B-NHL,但由于复发难治B-NHL患者的研究较少,信息有限,没有足够数据进行更细的分类,对于初治、复发难治及年龄、分期等需要进一步分析,对B-NHL患者预后的影响仍然有待进一步探究。
所有作者均声明不存在利益冲突



























